Сульфат алюминия

Сульфат алюминия растворим в воде и, в основном, используется в качестве флокулянта для очистки питьевой и технической воды станциями очистки сточных вод, а также в производстве бумаги.
Сульфат алюминия иногда упоминается как серная кислота, квасцы алюмоаммиачные или пищевая добавка Е 523. Безводная форма встречается в природе как редкий минерал Миллозевичит, содержащийся в вулканических средах, а также получается при сжигании угольных отходов. Сульфат алюминия образует множество различных гидратов, в числе которых кристаллогидрат Al2(SO4)3*16H2O и октадекагидрат Al2(SO4)3*18H2O.
Сульфат алюминия обладает способностью поглощать и удерживать молекулы воды из окружающей атмосферы.
Получение сульфата алюминия технического возможно путем добавления гидроксида алюминия Al(OH)3 в серную кислоту H2SO 4.
Также возможно получение сульфата алюминия из тетрагидроксоалюмината натрия.
Сульфат алюминия – это белое или почти белое кристаллической формы или в виде порошка соединение без запаха. Он растворим в воде, не летуч и легковоспламеняем. Сульфат алюминия обладает чрезвычайно кислым вкусом.
Применение сульфата алюминия
Раствор сульфата алюминия используется для очистки воды и как краситель в обработке текстиля. В процессе очистки воды раствор сульфата алюминия приводит к коагулированию, нежелательные примеси и загрязненные частицы оседают на дно сосуда и легко отфильтровываются.
При растворении в большом количестве нейтральной или слегка щелочной воды, раствор сульфата алюминия образует студенистый осадок гидроксида алюминия Al(OH)3, который используется при печати и окрашивании тканей, так как является нерастворимым пигментом.
Сульфат алюминия иногда используется для снижения pH почвы сада, что в свою очередь приводит при выращивании некоторых видов цветов (Гортензии) к их повторному цветению.
Сульфат алюминия является активным ингредиентом некоторых антиперспирантов.
В строительстве он используется в качестве гидроизолятора и ускорителя в производстве бетона.
Сульфат алюминия может быть использован в борьбе с моллюсками, насекомыми и слизняками.

В медицине сульфат алюминия входит в состав лекарств, облегчающих боль и дискомфорт, вызванные укусами насекомых. Он помогает разрушить токсичные химические вещества, содержащиеся в укусах, и помогает уменьшить их воздействие на кожу. Эти препараты выпускается в виде спреев, которые наносятся непосредственно на пораженные участки кожи и эффективнее помогают, если будут использованы сразу же после укуса.
Вред сульфата алюминия
Сульфат алюминия вреден при проглатывании или вдыхании. Вдыхание паров сульфата алюминия вызывает кашель и, возможно, одышку.
При контакте с кожей или глазами сульфат алюминия вызывает раздражение, покраснение, зуд и боль. Употребление сульфата алюминия внутрь приводит к сильному раздражению кишечника и желудка, сопровождаемое рвотой, тошнотой и диареей.
Это соединение может вызывать сильные ожоги, если контактирует с открытыми участками кожи.
Первая помощь при отравлении сульфатом алюминия
При попадании сульфата алюминия на кожу или в глаза необходимо промыть пораженный участок водой. В случае вдыхания паров необходимо выйти из токсичной области и медленно отдышаться. Если сульфат алюминия был применен внутрь, необходимо выпить стакан молока, а затем спровоцировать рвоту.
При отравлении сульфатом алюминия ни в коем случае нельзя использовать бикарбонаты, так как такое сочетание в буквальном смысле является взрывным.
Хранение сульфата алюминия
Сульфат алюминия необходимо хранить в прохладном, сухом месте в плотно закрытой таре, не смешивая с другими веществами.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Источник
Алюминий (сульфат, или сернокислый) — краткое описание, области использования
Алюминий (сульфат, или сернокислый) является сложным неорганическим веществом. Это белая соль с характерным голубоватым оттенком (допустим оттенок розовый). Кристаллогидрат бесцветен. Гигроскопичен. В воде растворяется довольно быстро.
Раствор сульфата алюминия часто используют для очистки вод (при коагулировании примеси оседают и отфильтровываются уже без проблем), в обработке текстилей. В слегка щелочной среде (как и в нейтральной) образует осадок (студенистый нерастворимый пигмент), используемый при окрашивании ткани и при печати.
Алюминий (сульфат, или сернокислый) великолепно нейтрализует почвы сада с завышенной рН. Этим свойством пользуются садоводы, добиваясь повторного цветения некоторых видов цветов.
Алюминий (сульфат, конечно же) включается в ряд антиперспирантов. Правда, вопрос о его негативном влиянии на кожу задается все чаще и чаще. Считается, что он способен при частом применении вызвать раздражение и даже аллергию.
Используется сернокислый алюминий (сульфат) и в строительном деле (в качестве ускорителя, гидроизолятора). Довольно эффективен он в борьбе с слизняками, моллюсками, насекомыми. Мало того, алюминий сернокислый можно встретить в составе комплексных удобрений. Без него невозможно производство огнетушителей. Некоторые косметические компании используют это вещество при производстве своей продукции (тушь, тени).
В пищевой промышленности алюминия сульфат находится в ряде добавок-эмульгаторов (под названием Е-520). Это вещество, являющееся одновременно и отвердителем, и средством для снятия кожицы с плодов, и заменителем дрожжей. Им осветляют воду, обрабатывают омаровое и крабовое мясо. А еще – это отличное средство, позволяющее добиться более плотной консистенции при консервации овощей.
Сульфат алюминия технический (Al2(SO4)3) получается при реакции серной кислоты и гидроксида алюминия. Мы можем наблюдать его в кристаллах (пластинах) и неопределенной формы кусках до 10 кг (второй или третий сорт), однако обычно это однородное сыпучее вещество (кристаллы до 20 мм, высший сорт).
Оказание первой помощи в случае отравления сульфатом алюминия предполагает:
— промывание глаз или кожи;
— выход из области отравления на свежий воздух;
— принятие стакана молока с дальнейшим провоцированием рвоты;
— обращение к врачу.
Хранится сульфат алюминия в прохладных, сухих местах. Тара должна быть плотно закрыта. Смешивание с другими веществами недопустимо (контакт с бикарбонатами, например, в буквальном смысле взрывоопасно).
Источник
Промышленное применение сульфата алюминия
Сульфат алюминия — неорганическая соль, используемая в бытовых и промышленных нуждах. Физические свойства соединения: цвет — белый, с голубоватым, серым или розовым оттенком; плотность — 2,146 грамм на сантиметр кубический; температура плавления — 770 градусов по Цельсию. Химические свойства: хорошо растворяется в воде и плохо в спирту; молярная масса — 342,14 грамм на моль. Вступает в реакцию с гидроксидами, кислотами и солями, а также азотом и водой.
При обычных условиях кристаллогидрат сульфата алюминия содержит одну молекулу соли и 16 молекул воды. При нагревании вода испаряется, но твердость вещества при этом не изменяется. Сульфат обладает свойством поглощения воды непосредственно из атмосферы, так что его необходимо держать в защищенном от влаги месте. Сернокислый алюминий относится к сильным электролитам. При электрической диссоциации сульфат алюминия распадается сразу на пять ионов: два катиона трехвалентного алюминия и три аниона двухвалентного сульфата. Это подтверждает его сильные электролитические свойства, так как слабые электролиты распадаются всего на два иона.
Реакция гидролиза сульфата алюминия проходит в три этапа. На первом этапе растворенное вещество образует гидроксосульфат алюминия и серную кислоту. На втором этапе образуется дигидроксосульфат алюминия. И, наконец, после завершения реакции остается две молекулы гидроксида алюминия и одна молекула серной кислоты. Сульфат реагирует со щелочами более активных, чем алюминий металлов. При этом происходит реакция обмена с образованием новой соли и гидроксида алюминия.
Получение сульфата алюминия
Как же получают сульфат алюминия? Для этого существует несколько способов. Первый подразумевает растворение гидроксида алюминия в горячей концентрированной серной кислоте. При этом происходит реакция замещения, когда более активный химический элемент алюминий вытесняет из состава кислоты менее активный водород. На выходе получается одна молекула кислой соли и 6 молекул воды. Такой способ позволяет изготавливать чистый продукт с минимальным содержанием примесей.
Если это не имеет принципиального значения, можно получить технический сульфат алюминия путем растворения в серной кислоте боксита или глинозема. При этом происходит реакция вытеснения водорода более активным алюминием. На выходе образуется сульфат, а вытесненный водород улетучивается в атмосферу. Такой способ также применяется как промежуточный процесс при выделении чистого алюминия из добытой руды.
Также получить сульфат алюминия можно путем растворения оксида в серной кислоте. На выходе после завершения реакции образуется соль и вода. Получить сернокислый алюминий можно и в домашних условиях. Но при этом необходимо соблюдать предельную осторожность, так как одним из компонентов реакции будет серная кислота. Работать следует в специальных защитных перчатках и очках, чтобы защитить себя от ее вредного воздействия. Для проведения опытов лучше выбрать хорошо проветриваемое помещение.
Сульфат алюминия очень вреден при проглатывании или вдыхании. Он может вызывать ожог верхних дыхательных путей, кашель или приступы отдышки. При попадании в желудок вызывает сильнейшее раздражение, сопровождаемое рвотой, поносом и болезненными ощущениями. При контакте с незащищенными участками кожи может вызывать раздражение, зуд или ожоги. Поэтому необходимо соблюдать максимальные меры предосторожности, чтобы опыты не имели негативных последствий. При проглатывании вещества ни в коем случае нельзя употреблять химические лекарственные препараты, так как их компоненты могут привести к неконтролируемым реакциям в желудке. Нужно выпить как можно больше жидкости (воды или молока) и вызвать рвоту естественным путем.
Промышленное применение вещества
Применение сульфата алюминия охватывает многие промышленные, бытовые и сельскохозяйственные сферы. Вещество применяют в текстильном производстве в качестве красителя. Используется в печатном деле в качестве составляющего для производства нерастворимых пигментов. Как коагулянт сульфат алюминия применяют для очистки питьевой воды. Он позволяет нейтрализовать все вредные химические вещества и загрязнители в воде, которые при взаимодействии с сульфатом выпадают на дно в виде осадка. Затем используются специальные фильтры, и вода становится чистой и пригодной для употребления.
Среда раствора сульфата алюминия — нейтральная, что позволяет без проблем использовать его в водоочистных системах. Вещество входит в состав некоторых ядов и удобрений, которые применяются для борьбы с насекомыми, слизняками и сорняками. Раствор сульфата алюминия также используют для нейтрализации кислотно-щелочного баланса почвы, что является важным условием для произрастания некоторых сельскохозяйственных культур. В бытовой химии сульфат применяют в качестве активного ингредиента антиперспирантов.
В строительной отрасли он используется как гидроизолятор при изготовлении бетонных конструкций. Входит в состав некоторых видов огнетушителей. В медицинской сфере вещество применяют при изготовлении спреев, помогающих при укусах насекомых. Сульфат алюминия разрушает токсины и облегчает боль. Эффективнее всего препараты действует при немедленном нанесении на место укуса, пока токсичные вещества еще не успели распространиться.
В продажу вещество поступает в упакованном виде в таре весом от 5 до 750 килограмм. Цена сульфата алюминия составляет около 20 рублей за килограмм. При крупной оптовой покупке стоимость может быть снижена до 15 рублей по договоренности с поставщиком. Окончательная цифра также будет зависеть от качества очистки вещества и доле примесей в составе. Технический сульфат обойдется намного дешевле, чем продукция с высоким уровнем очистки. Сернокислый алюминий бессмысленно покупать про запас, если нет возможности обеспечить оптимальные условия хранения. Он очень быстро впитывает влагу, поэтому требует идеально сухих помещений. В противном случае его эксплуатационные качества будут далеки от ожидаемых.
Источник
Способы подкисления почвы. Как это сделать правильно
Такое понятие как уровень кислотности почвы является важным показателем для успешного выращивания большинства растений. Он демонстрирует степень насыщенности щелочными минералами или кислыми солями, которые способны препятствовать усвоению растениями ключевых макро- и микроэлементов.
При этом для каждой культуры существует свой оптимальный уровень кислотности, при котором она чувствует себя наилучшим образом.
Есть целый ряд растений, которые значительно лучше растут и быстрее развиваются именно на кислых или слабокислых грунтах.
По этой причине уровню кислотности почвы стоит уделять особенное внимание, чтобы своевременно принять меры, и при необходимости изменить ее кислотно-щелочной баланс. О том так это сделать правильно, мы сегодня и поговорим, но сначала давайте определим, что включает в себя понятие кислотность.
Кислотно-щелочной баланс почвы
Для нахождения величины кислотности обычно используется показатель рН, который определяется по шкале от 0 до 14. При этом «0» является нижней границей наивысшего уровня кислотности, а верхний показатель соответствует максимальному щелочному значению.
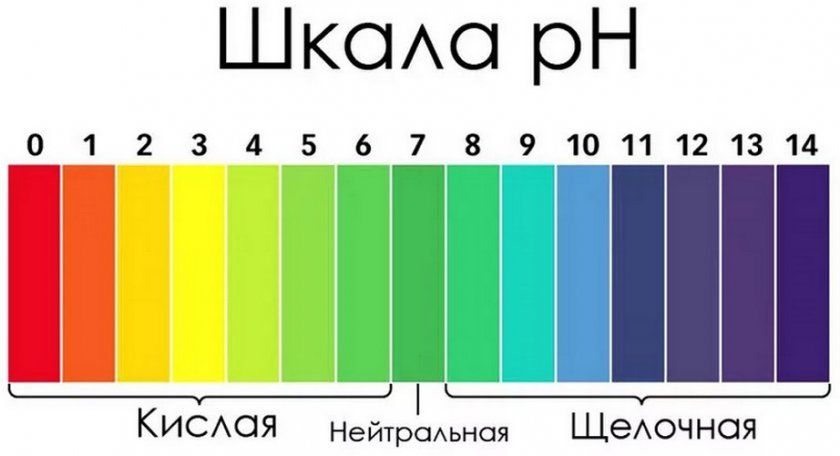
Типы грунтов, исходя из показателей (рН):
Близкие к нейтральным
Порода, из которой образована почва, является основным фактором ее кислотности. Если грунт основан на известняках и известковых сланцах, то у него изначально будет высокий уровень pH.
Почва, сформировавшаяся на песчаниках и гранитах, будет иметь более низкую кислотность. При этом кислая реакция обычно проявляется на подзолистых грунтах в лесных зонах, а сильнокислая на подзолах и верховых торфяниках.
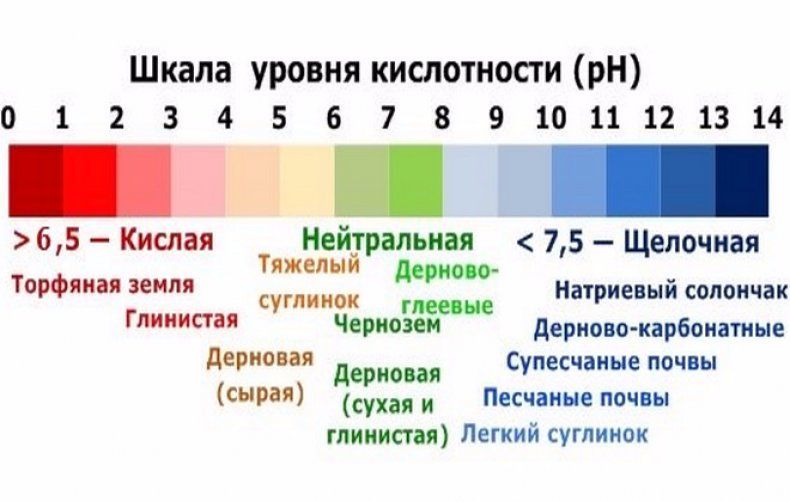
Завышенный уровень кислотности (при рН ниже 5 единиц), обычно приводит к тому, что многие минеральные компоненты, находящиеся в почве переходят в состояние, при котором они перестают усваиваться растениями, а деятельность многих полезных микроорганизмов при этом приостанавливается. Дело в том, что кислые почвы содержат большое количество растворимого алюминия и его солей, а также марганец, которые способны связывать такие щелочные минеральные вещества как кальций, магний, калий, селен и другие, препятствуя их усвоению растениями.
На слишком щелочных грунтах (при рН выше 7,5 единиц), растения тоже, как правило, растут плохо. Их листья преждевременно приобретают желтую окраску, поскольку не могут получить достаточное количество железа.

Причины изменения уровня кислотности почвы
Кислотность не является величиной постоянной и на протяжении определенного периода может существенно изменяться.
К причинам, которые способствуют изменению уровня кислотности, относится:
♦ Выделение микроорганизмами и корневой системой растений углекислого газа, в результате растворения которого происходит образование угольной кислоты
♦ Всасывание растениями вместе с почвенной влагой катионов щелочных металлов, которые в итоге обогащают грунт кислотными элементами
♦ Внесение в почву кислотообразующих удобрений на основе мочевины
♦ Кислотные осадки, вместе с которыми в грунт могут попадать кислоты (серная, сернистая и азотная)
Кроме того, изменению кислотности может способствовать организация на участке искусственного полива, в результате которого из почвы постепенно вымываются минеральные вещества. При этом если вода слишком мягкая, то ее кислотность в этом случае будет постепенно повышаться, а если жесткая, то понижаться.
Показатель водопроводной воды обычно находится в пределах от 6,5 до 8,5 единиц рН, то есть она имеет повышенную щелочную реакцию, а потому при регулярном и продолжительном ее использовании почву желательно подкислить.
Чтобы исключить влияние данного фактора, обычно используются специальные водяные фильтры, но удовольствие это слишком дорогое и потому неоправданное.

Как установить кислотность почвы
Прежде чем определится со способом повышения уровня кислотности, необходимо изначально с точностью определить структуру и состав грунта на участке, чтобы четко понимать, на сколько единиц необходимо понизить значение показателя pH.
Для этого можно обратиться в специальную лабораторию, специалисты которой могут произвести полное обследование представленных образцов почвы, чтобы определить значение рН с максимальной точностью.
Однако для домашнего культивирования растений, знать столь точный уровень кислотности грунта не обязательно, тем более, что примерные показатели можно измерить и другими, более простыми методами.
Например, специализированные торговые точки, предлагающие товары для садоводов и огородников рекомендуют приобрести несложный прибор, позволяющий измерять не только кислотность почвы, но и определять ее влажность, температуру, уровень освещенности и другие показатели.

Существует также способ определения уровня рН при помощи лакмусовых бумажных полосок и цветовой таблицы, на которой каждый оттенок означает установленный уровень кислотности или щелочности.
Большинство из нас использовали подобные бумажные индикаторы в школе на уроках химии, когда под воздействием определенного раствора бумага меняла свою цветовую окраску. Желтый цвет обычно соответствовал нейтральной кислотности, красная окраска указывала на повышенную кислотность, а синий цвет означал наличие в растворе щелочной среды. При этом интенсивность оттенка полностью зависела от концентрации того или иного вещества. Нам оставалось только, после того как бумага изменит цвет выбрать наиболее подходящий оттенок на цветовой шкале и сверить показатели рН с цветовой шкалой.
Для определения кислотности грунта также можно воспользоваться прибором Алямовского, который представляет собой набор из химических реактивов, позволяющий производить анализ водной и солевой вытяжек почвы. Последовательность действий при работе с этим набором такая же, как и в случае с лакмусовой бумажкой.

Существует еще более простой способ определения уровня рН, правда он дает весьма приблизительное понимание того, насколько кислотной или щелочной является почва. Для этого следует взять образец грунта, разделить его примерно поровну и сформировать две небольшие горки. На одну необходимо вылить немного уксусной кислоты, а на другую раствор пищевой соды. Если грунт под воздействием уксуса начал пенится – он имеет щелочную реакцию. Если такой же эффект наблюдается при выливании на почву содового раствора, значит, она имеет повышенную кислотность.
Определить уровень кислотности можно и при помощи листьев смородины или вишни. Для этого необходимо взять несколько свежих смородиновых или вишневых листочков и заварить их в крутом кипятке. После того, как вода полностью остынет, в посуду необходимо бросить горсть земли, которую вы хотите проверить на кислотность. Через некоторое время вода внутри начнет изменять свой цвет. Если она при этом приобретает красноватый оттенок – значит грунт кислый, если станет индиговой – слабокислый, а если окрасится в зеленый цвет, значит, почва имеет нейтральную кислотность.

Для определения уровня рН можно использовать и натуральный виноградный сок. Необходимо взять посуду около 50 миллиграмм, налить в нее свежий сок и бросить небольшую горсть земли. Если в результате появится пена – значит почва имеет щелочной или нейтральный показатель, а если какая-либо реакция отсутствует, то грунт, скорей всего кислый.
Во время взятия образцов почвы для анализа следует помнить, что кислотность даже на рядом расположенных грядках может несколько отличаться. Кроме того, она может иметь различные значения, если образцы были взяты на разных глубинах. По этой причине почву для пробы желательно брать из разных мест, в том числе удаленных друг от друга на значительном расстоянии.

Хорошим индикатором для определения повышенной кислотности является и наличие на участке таких сорняков как хвощ полевой, иван-да-марья, кислица, клевер, вереск, подорожник, конский щавель, крапива и полевая мята. Подкисленную почву предпочитают также ползучий пырей, ромашка, одуванчик, полевая березка, мать и мачеха, луговой василек и багульник.
При этом считать перечисленные растения индикаторами кислотности можно лишь в том случае, если они представлены не единично, поскольку семена могут попадать на участок случайным образом, а, как правило, представляют собой густые заросли.
Из культурных растений наиболее восприимчивы к кислой почве представители папоротниковых и вересковых.

Давайте рассмотрим подробнее, для каких именно растений подходит повышенный уровень кислотности.
Можжевельник, гортензия, голубика, брусника
Черника, рябина, люпин, камелия, ландыш, папоротник, фуксия, гардений, монстера, аконит, дицентра, гравилат, физостегия, дельфиниум, сибирский ирис, дриада, ракитник, дрок, рододендрон
Хвойные растения (пихта, ель, сосна), пеларгония, аспарагус, трехцветная фиалка, бегония, азалия, фикус
Сибирский ирис, лилия, примула, садовая земляника, малина, жасмин
Астры, гвоздики, гиацинты, смородина, облепиха, крыжовник
Что касается традиционных овощных культур, выращиваемых в Украине, то они, как правило, предпочитают нейтральную или слабокислую, или слабощелочную среду.

Как подкислить почву до значения рН в диапазоне от 4,5 до 5,8 единиц
При наличии на участке легких супесчаных и песчаных грунтов, для ее окисления достаточно внести большое количество органических удобрений (перегной, компост, коровяк, сосновые иголки, перепревшие опилки и так далее), поскольку органика способна, пусть и незначительно, но повышать уровень кислотности.
При этом процесс окисления будет происходить достаточно медленно, но зато действует он на протяжении длительного периода времени. Дело в том, что в процессе разложения органических веществ развиваются микроорганизмы, которые выделяют закисленные компоненты жизнедеятельности.
Если же почва на участке тяжелая и глинистая, то чрезмерное увлечение органическими удобрениями будет способствовать еще большему ощелачиванию грунта.

Подкисление почвы при помощи серы
Часто в качестве окислителя используется такое вещество как сера. Вода, попадая в грунт, вступает с ней в реакцию, постепенно превращая в серную кислоту. Следует помнить, что процесс окисления после внесения серы может занимать весьма продолжительный период времени (от нескольких месяцев до одного года), поэтому ждать мгновенного результата не стоит.
Однако, применяя серу, следует помнить, что чем более тонкого помола будет это вещество, тем быстрее произойдет процесс окисления.
Чтобы снизить показатели кислотности на 2,5 единицы рН, обычно в почву вносится от 100 до 150 грамм серы на один квадратный метр.
Рассыпать серу желательно при безветренной погоде, поскольку серная пыль очень мелкая и способна легко разноситься ветром. При этом необходимо обязательно использовать индивидуальные средства защиты и соблюдать меры предосторожности.

Для подкисления почвы можно вносить также коллоидную серу. Главное ее достоинство – это дешевизна.
Подкисление почвы при помощи коллоидной серы обычно производится за 8 – 12 месяцев до посадки растений.
При подкислении почвы для посадки деревьев и кустарников желательно закапывать серный порошок на глубину не менее 30 сантиметров. Безусловно, это делает процесс ее внесения более трудоемким и дорогостоящим, но в ином случае на изменение кислотности в прикорневой зоне растений могут потребоваться годы.
Для цветов и декоративных культур, предпочитающих кислую почву, норма внесения серы должна составлять около 4 грамм на 10 литров грунта.

Подкисление почвы сульфатом алюминия
Обычно сульфат алюминия используются в цветоводстве, чтобы получить красиво цветущую гортензию, поскольку это растение в щелочной или нейтральной среде не способно формировать цветы ярко-синего оттенка.
Чтобы изменить уровень кислотности почвы на одну единицу рН, достаточно внести один килограмм этого вещества на площадь 15 квадратных метров. При этом эффект можно ожидать уже в течение двух первых недель.
Однако следует помнить, что большое количество сульфата алюминия может негативно отражаться на проценте содержания в почве такого ценного элемента как фосфор. При этом данный окислитель будет способствовать накоплению алюминия, который может легко превысить допустимый уровень токсичности.
Недостаток фосфора, провоцируемый сульфатом алюминия, обычно легко устраняется путем дополнительного внесения фосфатных удобрений. Но делать это следует уже после завершения процесса окисления.

Подкисление почвы сульфатом железа
Сульфат железа обладает такими же окислительными способностями как и сульфат алюминия, быстро подкисляя грунт, но при этом он еще и удобряет почву железом. Норма внесения вещества составляет около 500 грамм на 10 квадратных метров площади.
Однако следует не забывать, что сульфат железа при использовании его в больших объемах может также препятствовать доступности фосфора, поэтому его желательно вносить дополнительно.

Окисление почвы при помощи электролита
Разбавленную серную кислоту можно добыть из старой автомобильной аккумуляторной батареи. Для этого из нее необходимо слить весь электролит.
Чтобы приготовить это вещество самостоятельно, необходимо взять 5 миллилитров концентрированной серной кислоты и аккуратно (!) вылить ее в 10-литровое ведро, наполненное водой. Раствор тщательно перемешать и можно поливать им грунт. При этом кислотность почвы поднимется от 1 до 2 единиц рН.
Данную операцию можно производить в течение всего периода вегетации несколько раз, плавно повышая показатель кислотности до желаемого.

Альтернативные методы подкисления почвы
В качестве элементов, которые способны повышать кислотность грунта, можно использовать вещества, содержащие в своем составе аммиак, в частности хлористый аммоний, калийные соли (кроме нитратов калия и кальция) и мочевину.
Некоторые огородники и садоводы в качестве альтернативы коллоидной сере используют уксусную, лимонную или яблочную кислоту, поскольку они демонстрируют наиболее быстрый подкисляющий эффект. Однако следует помнить, что эти кислоты оказывают негативное воздействие на микроорганизмы, в том числе убивая полезную микрофлору. Поэтому применять их следует только в исключительных случаях. Для этого необходимо взять 1-2 чайных ложки лимонной кислоты или около 100 миллиграмм уксуса, а затем развести их в 10 литрах воды. Одного ведра достаточно для обработки одного квадратного метра.
Может хорошо подкислить почву и внесение в нее сфагнового подстилочного болотного торфа, который затем следует тщательно перемешать с грунтом. Болотный торф обладает высоким уровнем кислотности, поэтому способен изменять показатель рН до 4 единиц.
Вносить торф рекомендуется под перекопку, из расчета 1,5 килограмма на каждый квадратный метр площади. При этом следует помнить, что процесс окисления будет проходить достаточно медленно и может занять несколько лет. А потому для желающих получить быстрый результат данный метод не подходит.

Окисление почвы при помощи растений-сидератов
Способ окисления при помощи сидератов является наиболее природным и экологически чистым. Корневая система этих растений содержит большое число органических кислот. Помимо прочего, эти культуры обладают мощными фитосанитарными свойствами и способны восполнять запас макро- и микроэлементов.
К сидератам, которые обладают способностью окислять грунт, относятся в первую очередь рапс, овес и белая горчица. При этом растения семейства бобовых (вика, соя, люпин) помогают хорошо поддерживать уже устоявшийся pH-баланс.
В любом случае, к работам по окислению почвы следует подходить ответственно и осознанно, учитывая при этом особенности грунта на земельном участке. Это как раз тот случай, когда важно соблюсти правило золотой середины, чтобы не навредить. В противном случае придется опять целенаправленно повышать щелочность почвы, используя для этой цели доломитовую муку или известь, но это уже совсем другая история.
Источник





