БУФЕРНОСТЬ ПОЧВЫ
БУФЕРНОСТЬ ПОЧВЫ, буферная способность почвы — способность её противостоять изменениям реакции. Благодаря Б. почв их реакция, при добавлении небольших количеств кислот или щелочей, сравнительно мало меняется, что очень важно для произрастания р-ний на почвах и развития в них микроорганизмов.
Буферной способностью обладает твёрдая часть почв и в меньшей степени почвенный раствор. В нейтральных и слабокислых почвах буферная способность почвенных растворов зависит б. ч. от наличия в них буферной системы из углекислоты и бикарбоната кальция. При добавлении к указанной буферной системе сильной кислоты образуется нейтрально реагирующая кальциевая соль последней и слабая кислота — СO2 в свободном состоянии; так. обр., вместо сильной кислоты в почвенном растворе остаётся слабая кислота, благодаря чему кислотность раствора мало повышается. Свободные щёлочи, в случае их прибавления к этой буферной системе, связываются углекислотой в углекислые соли [напр., Са(ОН)2 в трудно растворимый углекислый кальций], вследствие чего резкого подщелочения реакции не происходит. При наличии в почвенном растворе буферной системы из углекислоты и бикарбоната кальция рН раствора обычно колеблется в пределах от 5,3 до 8,4.
Буферность почвенных растворов может обусловливаться также наличием в них др. буферных систем — из фосфорной кислоты и её солей, органических кислот и их солей, солей алюминия и пр. или содержанием в почвенном растворе амфотерных веществ, обладающих способностью связывать как водородные, так и гидроксильные ионы (аминокислоты, гуминовые вещества и т. д.).
Состав почвенного раствора и, следовательно, его буферные свойства зависят от свойств твёрдой части почвы; последняя, в основном, и определяет буферность почв.
Буферность твёрдой части почв обусловливается способностью органических и минеральных коллоидов к поглощению катионов (см. Поглотительная способность почвы). Поглощённые почвой основания обусловливают Б. п. по отношению к кислотам. Последние при их добавлении к почве нейтрализуются, в результате обменных реакций с поглощёнными основаниями, по уравнению:
С др. стороны, Б. п. по отношению к щелочам обусловливается нейтрализацией последних поглощёнными ионами водорода по уравнению:
* ( В поглощающем комплексе почвы)
** ( Водородные ионы кислоты и кальций соли в растворе)
Для определения Б. п. предложены спец. лабораторные методы. Можно судить о буферной способности почв и не пользуясь этими методами, зная количество и состав поглощённых катионов в почве.
Б. п. имеет большое значение для плодородия почвы и для применения удобрений. Чем больше Б. п., тем обычно выше их плодородие. Минеральные удобрения (особенно в кислых формах) на почвах с высокой буферной способностью лучше используются; наоборот, на почвах с низкой буферной способностью кислые формы минеральных удобрений могут дать неполный эффект или даже снизить урожаи.
Известь на почвах с малой буферной способностью по отношению к кислотам и высокой — по отношению к основаниям обычно даёт больший эффект и должна применяться в повышенных дозах.
Повышение Б. п. на малобуферных почвах м. б. достигнуто как в результате применения органических удобрений (навоз, торф, зелёное удобрение), так и в результате культуры многолетних трав. При пониженной кислотности для повышения Б. п. необходимо вносить известь.
Литература: Гедройц К., Учение о поглотительной способности почв, 4 изд., М., 1933; Каппен Г., Почвенная кислотность (пер. с нем.), М., 1934; Прянишников Д., Агрохимия, 3 изд., М., 1940.
- Сельскохозяйственная энциклопедия. Т. 1 (А — Е)/ Ред. коллегия: П. П. Лобанов (глав ред) [и др.]. Издание третье, переработанное — М., Государственное издательство сельскохозяйственной литературы, 1949, с. 620
Источник
Буферность почвы
Буферность почвы—способность жидкой и твердой фаз почвы противостоять изменению условий среды, например, рН, окислительно-восстановительным свойствам и другим. Так, противодействие изменению реакции среды (рН) происходит при добавлении сильной кислоты или физиологически кислых удобрений (кислое плечо, кислый интервал буферности или щелочки, щелочное плечо, щелочной интервал), при известковании или внесении физиологически щелочных солей. Буферность зависит от состава и свойств почвы и свойств почвенного раствора. Буферность почвенного раствора зависит от наличия ионов Na+, К+, Са2+, Мg2+, СО32- и НСО3-, растворенного СО2, гуматов, фульватов и некоторых других веществ. Буферность почвенного раствора обусловлена присутствием солей сильных кислот и слабой кислоты, которые и создают буферность. Сильными основаниями являются Nа, К, более слабыми — Са, Мg. Органические слабые кислоты — ГК, ФК.
Буферность почвы зависит от механического состава почв. У тяжелых почв, например, глинистых или суглинистых, буферная способность проявляется за счет большего содержания илистых и коллоидных частиц, которые, в свою очередь, содержат значительное количество поглощенных катионов, таких, как Са, Мg. Если в такую почву внести кислоту, то подкисления не произойдет в силу обменной реакции:
[ППК] 
Вместо водорода появляются нейтральные соли СаС12 и МgС12, т.е. реакция среды не изменится или изменится незначительно. В песчаных почвах, обедненных коллоидами, в которых поглощенных оснований содержится мало, ионы водорода кислоты остаются в растворе, в результате чего резко изменяется реакция среды, т.е. для этих почв характерна низкая буферность.
Практика сельского хозяйства показывает, что в слабоудобренных почвах реакция среды может довольно резко меняться от внесения физически кислых или щелочных удобрений. В почвах, обладающих большой буферной емкостью, этого не происходит.
Буферность почвы можно повысить путем внесения органических и минеральных коллоидов. В кислых почвах буферную емкость по отношению к кислотам можно повысить известкованием. На почвах с малой буферностью рекомендуется вносить минеральные удобрения, особенно физиологически кислые и физиологически щелочные, в несколько приемов и малыми дозами, чтобы предотвратить резкое изменение реакции среды.
Источник
Реакция и буферные свойства почвы
Реакция почвы – физико-химическое свойство почвы, обусловленное соотношением ионов Н + и ОН — в ее твердой и жидкой частях. Почва кислая, если в ней преобладают ионы Н + , и щелочная, если ионы ОН — . Реакция почвы оказывает большое влияние на развитие растений и почвенных микроорганизмов, на эффективность удобрений, на химические и биохимические процессы в почве. Для количественной оценки реакции почвы применяют различные показатели: рН суспензии почвы в воде или в растворе КС1.
Концентрацию ионов водорода в растворе принято выражать условной величиной рН (отрицательный логарифм концентрации Н + ионов).
Принято следующее деление минеральных и торфяных почв республики в зависимости от реакции почвенного раствора рНКС1.
3.1. Градация почв по степени кислотности
| Группа | Степень кислотности | Почвы | |
| минеральная | торфяная | ||
| I | Сильнокислые | Меньше 4,5 | 4,0 |
| II | Среднекислые | 4,51 – 5,00 | 4,01 – 4,50 |
| III | Кислые | 5,01 – 5,50 | 4,51 – 5,00 |
| IV | Слабокислые | 5,51 – 6,0 | 5,01 – 5,50 |
| V | Близкие к нейтральным | 6,01 – 6,50 | 5,51 – 6,00 |
| VI | Близкие к нейтральным и нейтральные | 6,51 – 7,00 | 6,01 – 6,50 |
| VII | Нейтральные и слабощелочные | Более 7,0 | Более 6,50 |
По кислотности почв выделяют актуальную (активную) и потенциальную (скрытую) кислотность. Последняя подразделяется, в свою очередь, на обменную и гидролитическую.
Актуальная кислотность – это кислотность почвенного раствора, обусловленная повышенной концентрацией в нем ионов Н + , а также слабых минеральных (Н2СО3), органических кислот и гидролитически кислых солей (А1С13). Последние при гидролизе образуют слабое основание и сильную кислоту:
3НС1 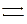
Актуальная кислотность непосредственно влияет на развитие растений и почвенных микроорганизмов.
Потенциальная (скрытая) кислотность обусловлена ионами Н + , А1 3+ и Fe 3+ , поглощенными ППК с отрицательным зарядом. Часть поглощенных ионов водорода и алюминия может быть вытеснена в раствор катионами нейтральных солей (КС1):
|
|
ППК) + KCl 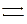
в результате чего почвенный раствор подкисляется. Это обменная потенциальная кислотность почвы, выражается рН в КС1.
При обработке почвы уксуснокислым натрием CH3COONa или уксуснокислым кальцием (СН3СОО)2Са все ионы, обусловливающие кислотность почвы, вытесняются в раствор:
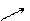
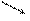
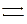
ППК) + СН3СООН + 2Na + + 2ОН –
Эта полная кислотность получила название гидролитической.
Кислотность, обнаруживаемая при обработке почвы раствором CH3COONa, включает актуальную и потенциальную кислотность – как обменную, так и собственно гидролитическую (которая не обнаруживается КС1). Гидролитическая кислотность выражается в мэкв в 100 г почвы.
Свойства почвы характеризуются также степенью насыщенности основаниями – суммой поглощенных оснований, выраженной в процентах от емкости катионного обмена (ЕКО):
где V – степень насыщенности почвы основаниями, %; S – сумма поглощенных оснований (кроме Н + ); Т (ЕКО) – поглотительная способность всех катионов, включая ионы водорода в мэкв на 100 г почвы.
Степень насыщенности основаниями показывает, какая часть общей емкости поглощения приходится на поглощенные основания и какая – на ионы водорода. Например, V = 70 % означает, что 70 % от общей емкости катионного обмена (Т) занимают основания и 30 % – ионы водорода.
Буферная способность почв. Почвенный раствор подкисляется в результате выделения углекислоты при дыхании корней, образовании HNО3 при нитрификации и от продуктов жизнедеятельности микроорганизмов. Реакция почвы изменяется также от применения удобрений. Изменение реакции разных почв под действием этих факторов неодинаково. Способность почвы противостоять изменению реакции почвенного раствора в кислую или щелочную сторону называется буферной способностью почвы. Буферность почвы в целом зависит от буферных свойств ее твердой и жидкой частей. Буферность раствора создается слабыми кислотами и их солями. Слабые кислоты диссоциируют не полностью, большая часть их находится в виде недиссоциированных молекул:
СН3СООН 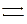
Н2СО3 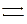
Если к этому раствору прибавить NaOH, то произойдет связывание ионов Н + с образованием воды и рН изменится мало. Следовательно, слабая кислота будет противодействовать подщелачиванию раствора.
Раствор слабой кислоты и ее соли будет буферным также и против подкисления:
CH3COONa + HC1 = СН3СООН + NaCl.
Буферность почвенного раствора обусловливается также водорастворимыми органическими кислотами и их солями:
Чем больше общая емкость поглощения и степень насыщенности почвы основаниями, тем сильнее почва противостоит подкислению:
| |
|
ППК) + Н2SО4 
Чем больше ионов водорода в почве, тем сильнее она будет противостоять подщелачиванию.
На почвах с низкой буферной способностью (песчаных, супесчаных, бедных гумусом) при внесении физиологически кислых удобрений возможны резкие сдвиги реакции в кислую сторону. На таких почвах вносят также меньшие дозы извести, чем на суглинистых, так как они слабо противостоят подщелачиванию. Это нужно учитывать при внесении минеральных удобрений и извести.
Дата добавления: 2015-12-29 ; просмотров: 623 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Буферность почвы
Что такое буферность почвы? Это способность почвы противостоять подкисляющему действию кислот либо подщелачивающему действию щелочей.
Буферность почвы зависит от наличия илистых частиц. По этой причине буферность глинистых почв, особенно богатых гумусом, выше, нежели у песчаных.
Если взять два образца почвы, одинаковых по весу: глинистую почву, насыщенную илистыми частицами и песчаную почву, бедную на илистые частицы и добавить в них одинаковое количество кислых удобрений или кислоты, то кислотность глинистой почвы, для которой характерна большая буферность, повысится в меньшей степени, чем у песчаной, слабобуферной почвы.
Часть минеральных удобрений подкисляют почву, а другие подщелачивают. Порой удобрения вносятся, чтобы изменить в определенную сторону реакцию почвенного раствора, к примеру, мергель.
Возможно побочное явление в случае изменения почвенной реакции под влиянием внесенного удобрения. Если внести повышенные дозы такого удобрения, то кислотность почвы существенно изменится, причем в худшую сторону.
В случае внесения удобрений в почву, обладающей повышенной буферностью, последствия будут не так заметны, поскольку кислотность изменится на незначительную величину. В случае слабой буферности следует принять специальные меры предосторожности.
Для увеличения буферности легкой песчаной почвы можно добавлять в нее глину или прудовой ил. Это не легкий процесс, но он эффективен. Желательно с этой целью вносить торф либо иное органическое удобрение, поскольку они сильнее увеличивают буферность, нежели глина.
На буферных почвах допускается внесение минерального удобрения за один прием в более высоких дозах, нежели на слабобуферных.
Удобрения, вносимые в саду окажут положительное действие при условии, что известны основные свойства почвы. В этом случае садовод правильно определит способ внесения удобрения, их дозы и форму.
Источник