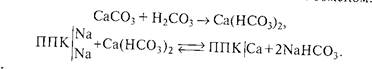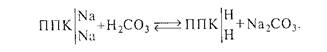Понятие о кислотности и щелочности почвы
Характерным свойством почвы является ее реакция. Она определяется соотношением свободных ионов Н + и ОН — в почвенном растворе. Концентрация свободных ионов Н + выражается величиной РН, представляющей отрицательный логарифм концентрации ионов водорода. РН=7 характеризует нейтральную реакцию, РН 7 – щелочную.
Реакция почвенного раствора в различных почвах колеблется от РН 3,5 до 8-9 и выше. Наиболее кислую реакцию имеют болотные почвы верховых торфяников. Кислой реакцией почвенного раствора характеризуются подзолистые и дерново-подзолистые почвы, а также красноземы (РН 4-6). Черноземы имеют реакцию близкую к нейтральной. Наиболее щелочная реакция у солончаков, особенно содовых (РН-8-9 и выше).
Сельскохозяйственные растения предъявляют разные требования к реакции почвы. Наиболее благоприятная слабокислая и слабощелочная реакция. С реакцией почвенного раствора тесно связана жизнедеятельность почвенной микрофлоры. В кислой среде преобладает грибная микрофлора, в нейтральной или слабощелочной – бактериальная.
С реакцией почвенного раствора связаны процессы превращения компонентов минеральной и органической частей почв, растворение веществ, образование осадков, миграция и аккумуляция веществ в почвенном профиле. Кислая среда является следствием развития в почве кислотности, щелочная реакция – следствие щелочности почвы.
Кислотность почвы — способность почвы подкислять воду и растворы нейтральных солей. Различают актуальную (активная) и потенциальную (скрытая) кислотность.
Актуальная кислотность обусловлена концентрацией свободных ионов Н + и характеризует кислотность почвенного раствора. Потенциальная кислотность характерна для твердой фазы почвы. Между актуальной и потенциальной кислотностью в почве сохраняется подвижное равновесие
В большинстве почв актуальная кислотность обусловлена угольной кислотой и ее кислыми солями. Причиной потенциальной кислотности почвы являются обменные ионы Н + и Al +++ , т.к. при взаимодействии почвы с растворами солей эти катионы вытесняются в раствор и подкисляют его:
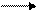
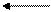
В зависимости от характера вытеснения Н+ и Al +++ различают 2 формы потенциальной кислотности: обменную и гидролитическую.
Обменная кислотность проявляется при взаимодействии почвы с растворами нейтральных солей, которые образуются при соединении сильных оснований с сильными кислотами (KCl, BaCl2, NaCl и т.п.)





ППК Аl +++ +4КСl ППК — Mg ++ + HCl + AlCl3



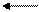
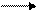
Гидролитическая кислотность обычно больше обменной. Она может рассматриваться как суммарная кислотность почвы, состоящая из актуальной и потенциальной кислотности. Кислотность выражается в миллиграмм – эквивалентах (м-экв) на 100г почвы.
Для устранения кислотности почв проводят известкование.При определении степени нуждаемости почвы в известковании следует учитывать насыщенность почвы основаниями (таблица 2), а также ее гранулометрический состав и набор культур в севообороте.
Таблица 2 -Деление почв по степени нуждаемости в известковании.
| Степень нуждаемости в известко-вании | РН – солевой вытяжки | Степень насыщен-ности почвы основа-ниями (%) |
| Сильная | До 4,5 | До 50 |
| Средняя | 4,6-5,0 | 50-70 |
| Слабая | 5,1-5,5 | >70 |
| Отсутствует | >5.5 | >80 |
Дозу извести чаще всего рассчитывают по величине гидролитической кислотности. Для этого гидролитическую кислотность умножают на коэффициент 1,5; полученная величина означает дозу (в т/га), которая должна быть внесена в почву для доведения ее реакции до слабокислой
Если для известкования используют не чистый СаСО3, то проводят перерасчет на содержание СаСО3 в применяемом известковом материале, а для MgСО3, СаО и Са(ОН)2 пользуются соответственно коэффициентами 0,84;0,56 и 0,74. Можно также пользоваться дозами извести, предлагаемыми справочниками по удобрениям для отдельных почвенных разновидностей с учетом рН солевой вытяжки. На легких почвах с низкой буферностью полную дозу извести, рассчитанную по гидролитической кислотности, обычно уменьшают на 25-30%. Для отдельных культур (лен, картофель) дозу извести можно снизить на 50%. При расчете доз известкования освоенных торфяников необходимо иметь в виду значительно меньший объемный вес их по сравнению с минеральными почвами
Щелочность почвы обуславливается повышенной концентрацией в почве ионов гидроксила ОН — . Различают актуальную и потенциальную щелочность. Актуальная щелочность обуславливается наличием в почве гидролитически щелочных солей (Na2CO3, NaHCO3, Ca(HCO3)2 и др.).
Потенциальная щелочность обнаруживается у почв, содержащих поглощенный Na.








Щелочность почвы устраняют гипсованием- традиционный способ ее нейтрализации. Дозу гипса для замены натрия на кальций в ППК вычисляют по формуле:
где, Х – доза гипса в т/га;
0,086 – миллиэквиваленты гипса, в г;
Na – содержание обменного натрия, в м-экв. на 100г почвы;
Н- мощность пахотного слоя, в см;
d – плотность массы мелиорируемого горизонта, г/см 3 .
С изменением реакции среды тесно связано важное свойство почв – их буферность, т.е. буферная способность.
Буферностью называют способность почвы противостоять изменению реакции почвенного раствора. Буферная способность различных почв неодинакова. Почвы, богатые карбонатами (черноземы, каштановые), хорошо противостоят смещению реакции в кислую сторону, тогда как почвы, обедненные основаниями (подзолы, красноземы), имеют высокую буферность при изменении реакции в щелочную сторону. Особенно низка буферность песчаных и супесчаных почв, а также содержащих мало органического вещества.
Благодаря этому замечательному свойству почвы (буферности) возможно применение хорошо растворимых солей в качестве минеральных удобрений, в противном случае в зонах вокруг гранул удобрений создавались бы губительные для растений концентрации солей.
Контрольные вопросы:
1 Происхождение, состав и основные свойства почвенных коллоидов?
2. Что такое ацидоиды, базоиды и амфолитоиды? Дайте им характеристику.
3. Охарактеризуйте процессы коагуляции и пептизации коллоидов?
4. Как Вы понимаете поглотительную способность почвы, от чего она зависит?
5.Назовите закономерности обменного поглощения катионов и анионов в почве.
6. Назовите состав обменных катионов в основных типах почв.
7. Какова роль поглотительной способности в плодородии почв?
8. Что называется емкостью поглощения почв, от чего она зависит, в каких пределах колеблется?
9. Каковы происхождение и виды почвенной кислотности и щелочности?
Источник
ЩЕЛОЧНОСТЬ ПОЧВ
Щёлочность почв – способность почв нейтрализовать компоненты кислой природы и подщелачивать воду. Различают актуальную и потенциальную формы шелочности.
Актуальная щелочность. Актуальная щелочность связана с наличием в почвенном растворе гидролитически щелочных солей, при диссоциации которых образуется гидроксильный нон:
Определенное значение в формировании щелочности почв имеют анионы слабых кислот. Практически все анионы слабых кислот, присутствующие в почвенном растворе, могут участвовать в формировании щёлочности почвы, образуя сопряженные кислотно-основные пары.
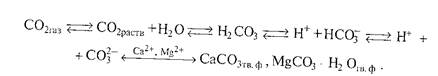
Реальный вклад того или иного соединения в щёлочность почвы определяется не только величиной константы основности, но и концентрацией ионов в почвенных растворах. Обычно при характеристике актуальной щёлочности природных вод, водных вытяжек и почвенных растворов выделяют общую щелочность, щёлочность от нормальных карбонатов и щелочность от гидрокарбонатов, которые отличаются по граничным значениям рН. Их определяют путем титрования вытяжки кислотой в присутствии различных индикаторов. Результаты выражают в мг-экв/100 г почвы. Щёлочность от нормальных карбонатов обусловлена присутствием Na2CO3, СаСО3, МgСОз. Щёлочность от гидрокарбонатов связана с NaНСО3 и Са(НСО3)2. В большинстве почв с щелочной реакцией преобладают карбонаты, которые и обусловливают соответствующую реакцию среды. В связи с этим выделяют карбонатно—кальциевую систему и карбонатно-кальциевое равновесие. Карбонатно-кальциевая система включает СаС03 твердой фазы, ионы в ППК, ноны почвенного раствора: Са 2+ , Са НСО3 + , CO3 2- ОН — , Н + , Н2С03, а также СО2 почвенного раствора, находящегося в равновесии с СО2 почвенного воздуха. Эта система очень подвижная и включает несколько равновесий:
При уменьшении парциального давления СО2 равновесие сдвигается в сторону образования СО-групп. В этом случае образуется труднорастворимое соединение СаСО3, выпадающее в осадок, и увеличивается рН почвенного раствора, так как СО является более сильным акцептором протонов, чем НСО3 — , и в большей степени подщелачивает среду. В итоге на фоне увеличения рН величина карбонатной щелочности снижается. Увеличение парциального давления СО2 приводит к уменьшению рН и росту карбонатной щелочности в результате увеличения раствори-
мости СаСО3.
Расчеты показывают, что рН раствора, находящегося в равновесии с СаС03 твердой фазы и СО2 атмосферы, имеет значение 8,2-8,3. Когда же свободный доступ СО2 затруднен, значения рН достигают 9,8-10,0.
Потенциальная щелочность обусловлена наличием в ППК обменно-поглощённого иона натрия, который при определенных условиях может переходить в почвенный раствор с образованием карбонатов и гидрокарбонатов, вызывая его подщелачивание. Например, при образовании угольной кислоты вследствие дыхания растений и разложения органических остатков происходит переход карбоната кальция в более растворимый гидрокарбонат с последующим ионном обменом:
Угольная кислота может непосредственно взаимодействовать с поглощающим комплексом почв, содержащих обменный натрий, с образованием соды (карбоната натрия):
Почвы с щелочной реакцией среды формируются в регионах с дефицитом атмосферных осадков, где ограничен вынос из почв и почвообразующих пород продуктов выветривания и почвообразования. Щелочная реакция среды типична для каштановых и светло-каштановых, бурых полупустынных и серо-бурых пустынных почв, сероземов карбонатных разностей черноземов и темно-каштановых почв, особенно высокой щёлочностью отличаются содовые солонцы и солончаки.
Высокая щелочность почв неблагоприятна для большинства сельскохозяйственных культур. В условиях щелочной среды в растениях нарушается обмен веществ, снижается растворимость и доступность фосфатов, соединений железа, меди, марганца, бора и цинка. При щелочной реакции в почвенном растворе появляются токсичные для растений вещества, в частности сода и алюминаты натрия. В случае резкого повышения рН корневые волоски растений испытывают щелочной ожог, что негативно отражается на их дальнейшем развитии и может привести к отмиранию. сильнощелочные почвы характеризуются ярко выраженными отрицательными агрофизическими свойствами, что связано с сильной пептизацией почвенных коллоидов и растворением гумусовых веществ. Такие почвы оструктуриваются, приобретают высокую липкость во влажном состоянии и твердость в сухом, отличаются плохой фильтрацией и неудовлетворительным режимом. Сильнощелочные почвы малоплодородны.
Эффективный прием повышения плодородия почв с щелочной реакцией — химическая мелиорация. В качестве мелиоранта широко применяют гипс и различные вещества.
При внесении гипса в щелочные почвы происходит, с одной стороны, нейтрализация солью почвенного раствора, с другой — вытеснение обменного натрия из ППК:
После гипсования содовых почв, а также в натурных карбонатных почвах реакция среды будет находиться на уровне, определяемом наличием СаСОз и МgCОз (рН 8,2-8,6). При необходимости дальнейшего снижения рН применяют кислые мелиорирующие вещества, в частности серную кислоту. Кислование содовых почв высокоэффективный прием. При кисловании происходит не только полная нейтрализация щелочности, но и вытеснение натрия из ППК:
Важное условие эффективного проведения химической мелиорации щелочных почв — удаление продуктов нейтрализации и обменных реакций, чаще всего сернокислого натрия. Хотя сульфат натрия менее вреден для растений, чем, например, сода, его присутствие в почве все же нежелательно. Кроме того, возможно обратное поглощение натрия ППК почвы. Для удаления легкорастворимых солей натрия, образующихся при химической мелиорации, применяют промывки почв.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник