КХА почвы
Задача количественного анализа — определить количество элемента или соединения в исследуемом образце.
Количественный химический анализ состава почвы
Задача количественного анализа — определить количество элемента или соединения в исследуемом образце. Чаще интересует не абсолютное количество, а концентрация, либо массовый процент. Следует помнить, что методы аналитической химии не рассчитаны на определение «полного точного состава». Любой метод способен определить только «концентрацию чего-то в чем-то». К примеру, метод, позволяющий определить концентрацию алюминия в воде, не подойдет для определения концентрации алюминия в краске или в пищевых продуктах. Поэтому количественный химический анализ — это заключительный этап исследования химического состава для неизвестного образца. И прежде чем провести количественный анализ, необходимо точно узнать, из каких веществ состоит образец (этап качественного анализа) и какие конкретно вещества следует определить количественно.
Погрешность количественного химического анализа.
В аналитической химии результаты анализа характеризуются такими понятиями, точность, воспроизводимость, повторяемость, правильность, а также с результатами анализа связаны такие понятия как погрешность и доверительный интервал. Чтобы, не углубляясь в понятия, объяснить, что значит «погрешность анализа», с точки зрения результатов, которые поучает заказчик, приведем простой пример. Если вас спросят, какая температура сейчас на улице? Ответ 25 ± 1С 0 обычно всех устраивает с точки зрения «погрешности». При этом «погрешность» данного ответа составляет 4% от полученной величины, а реальное значение температуры лежит в пределах от 24 до 26 С 0 . Но если попытаться определить температуру человека с той же погрешностью 4%, то ответ получится 36,6 ± 1,5 С 0 (то есть реальное значение лежит в пределах от 35,1 до 38,1 С 0 ). Для выяснения, болен ли человек, измерения температуры с такой погрешностью явно недостаточно.
Аналогичная ситуация происходит и в химическом анализе. Невозможно никакую величину измерить бесконечно точно, любое измерение имеет свою погрешность, и в качестве результата всегда указывается интервал, в котором, вероятнее всего, лежит истинное значение. Разные аналитические методы имеют различную погрешность. Причем погрешность вносится на различных этапах: в процессе пробоотбора, взвешивания, разделения на компоненты, измерения объема, добавления реагентов, измерения аналитического сигнала и др. Поэтому чем больше ступеней занимает анализ, тем большие погрешности могут быть внесены. Поэтому классические методы, такие как титриметрия и гравиметрия, хоть и трудоемки, и рассчитаны на определение только одного компонента, но позволяют получить результат с очень маленькой погрешностью. Инструментальные методы, позволяющие определить сразу несколько компонентов, дают больше информации, но и результат получается с большей погрешностью.
Поэтому прежде чем приступить к анализу, необходимо уточнить, с какой погрешностью требуется получить ответ, чтобы он был информативен. Затем следует убедиться, что современные методы позволяют решить поставленную задачу.
Количественный химический анализ, документация (ГОСТ, РД, ПНД Ф и др.) и разработка новых методик
Существует множество различных методик определения тех или иных компонентов в различных пробах. Есть методики, разработанные и используемые внутри какой-то одной лаборатории, есть также методики, прошедшие валидацию (то есть подробное исследование) с участием нескольких лабораторий. Но наибольшим доверием пользуются методики, записанные в нормативных документах. Характеристики таких методик изучены в процессе масштабных межлабораторных исследований. Такие методики описаны в серии документов ГОСТ (Государственные стандарты), ПНД Ф, РД, МУК. Для этих методик четко описана вся последовательность действий и измерений; объекты, для которых подходит данная методика; указаны также метрологические характеристики, такие как доверительный интервал (погрешность анализа) и диапазон измерений определяемого компонента. Следует понимать, что нормативные методики установлены на определенные образцы и определенные вещества. То есть, если методика предназначена, например, для определения содержания формальдегида в питьевой воде, это значит, что измерить содержание формальдегида в лакокрасочной продукции по этой же методике нельзя.
Ясно, что невозможно задокументировать методики для всех существующих объектов анализа, поскольку ежедневно создается множество новых материалов, продуктов, смесей и других образцов, подлежащих анализу. Появляются также и новые методы анализа, показывающие более высокую эффективность и точность. Поэтому в случае, если не существует четкой методики, по которой можно провести исследование, аналитическая лаборатория может адаптировать какую-либо существующую методику под новый объект или диапазон измерений, либо разработать новую методику, отталкиваясь от аналитических возможностей доступных методов анализа. В данном случае правильность результатов анализа зависит от компетентности аналитической лаборатории. Проверить работоспособность вновь созданной или измененной методики можно как внутри самой лаборатории, проведя исследование «контрольного образца» с заранее известным содержанием компонента, так и проведя межлабораторный эксперимент. Второй вариант позволяет получить больше уверенности в надежности методики и качестве получаемых данных, но он и значительно дороже. Поэтому решение вопроса о межлабораторных исследованиях и валидации новых методик зависит от целей исследования: насколько критична правильность получаемых результатов и существует ли потребность для применения разработанной методики в регулярных исследованиях.
Количественный химический анализ. Классические и инструментальные методы
Среди методов аналитической химии, позволяющих определить точное содержание вещества (или элемента), можно различить однокомпонентные (одномерные) и многокомпонентные (двумерные методы). Такие классические методы, как титриметрия или гравиметрия, позволяют определить только один компонент, более сложные инструментальные методы позволяют определить одновременно несколько компонентов. Однако преимущество классических методов в их простоте и точности анализа. Ниже перечислены некоторые наиболее популярные методы количественного анализа.
Классические методы количественного химического анализа
Гравиметрия. Один из самых трудоемких, и длительных, но очень простой и точный метод анализа. Это метод, основанный на выделении определяемого вещества с последующим взвешиванием. Определяемое вещество выделяют в чистом виде, либо в виде какого-то определенного соединения. Существуют метод возгонки и более широко используемый метод осаждения. Определяемое вещество переводится в форму малорастворимого осадка, который после последующей обработки (фильтрации, высушивания, прокаливания) взвешивается.
Титриметрия. Классический метод анализа, основанный на точном измерении объемов двух веществ, вступающих в химическую реакцию. Этот метод, так же как и гравиметрия, одномерный — позволяет одновременно провести измерение только одного показателя. Это может быть один компонент или сумма каких-то конкретных компонентов (например, совместное титрование ионов кальция и магния — определение «жесткости» воды). Титриметрический метод является одним из наиболее точных методов, однако он обладает меньшей чувствительностью по сравнению с инструментальными методами, то есть не подходит для определения следовых количеств вещества.
Инструментальные методы количественного химического анализа
Методы вещественного анализа
ГХ-МС — газовая хроматография с месс-спектрометрическим детектированием. Этот метод основан на разделении веществ в газовой фазе при пропускании их через капилляр и детектировании веществ по массам осколков их молекул. Метод применяется для анализа газовых смесей, анализа летучих органических веществ (пробы воздуха) и некоторых нелетучих, но легкоиспаряемых веществ. Например, при анализе воздуха можно детектировать до 2000 различных присутствующих в нем соединений. Также можно определить состав органических смесей неизвестного происхождения.
· широкий спектр определяемых веществ
· возможность анализировать газовые смеси
· возможность анализа многокомпонентных жидких смесей
· погрешность анализа 20-25%
· нельзя анализировать смеси, содержащие трудноиспаряемые вещества (минеральные масла, смолы, полимеры)
· нет возможности анализировать твердые образцы без растворения
· анализ водных растворов, содержащих органику требует предварительной экстракции
ВЭЖХ — высокоэффективная жидкостная хроматография (с различными вариантами детектирования). Метод, основанный на разделении веществ в жидком состоянии при пропускании через хроматографическую колонку, заполненную и последующем их детектировании. Этот метод хорошо подходит для анализа жидких органических смесей, и водных растворов, содержащих органику. Метод ВЭЖХ очень востребован при анализе биологических растворов, вещественный состав которых нарушается при нагревании. Например, этим методом проводят анализ плазмы крови; им можно разделить смесь, содержащую молекулы белка чтобы затем определить структуры этих белков; можно проводить анализ многокомпонентных растительных экстрактов, содержащих сотни различных биологических веществ. При наличии соответствующих образцов сравнения методом ВЭЖХ можно идентифицировать различные сорта чая, определить состав биологически активной добавки и многое другое. ВЭЖХ активно применяется в медицинских исследованиях, криминалистике, анализе продуктов питания и экологической экспертизе.
· возможность анализа водных растворов, содержащих органику
· широкий спектр определяемых веществ
· возможность проводить анализ без испарения веществ (важно для биологических веществ)
· возможность определять трудноиспаряемые органические компоненты
· погрешность анализа 15-20%
· нет возможности анализировать твердые образцы без растворения и газы
· необходимость правильного подбора сорбента в зависимости от состава пробы
Капиллярный электрофорез. Метод, основанный на разделении элементов сложной смеси в кварцевом капилляре под действием приложенного электрического поля. На выходе вещества детектируются и получается электрофореграммы. Характеристикой вещества является его время удерживания в капилляре, а о концентрации говорит площадь пика на электрофореграмме. Метод капиллярного электрофореза активно используется для анализа объектов окружающей среды, например, определения катионов и анионов в водах (железо, марганец, сульфаты, хлориды, нитраты и др.); пестицидов в воде и почве; таких опасных токсикантов, как фенол и другие. Также метод КЭ используется в пищевой промышленности (определение витаминов, аминокислот, консервантов и др.); в фармацевтике (производство и контроль качества лекарств); в медицине (разделение белков и компонентов плазмы крови); в криминалистике (определение следов взрывчатых и наркотических веществ).
· высокая степень разделения компонентов (возможность исследования сложных смесей)
· хорошая воспроизводимость результатов анализа (0,5-5%)
· экономичность (малый расход реактивов, не требуются дорогостоящие и токсичные реактивы)
· широкий диапазон определяемых концентраций
· высокая чувствительность метода
· нет возможности исследовать твердые образцы без растворения и газы
· не подходит для анализа сложных органических смесей (образованных неполярными веществами)
ИК-спректрофотометрия. Метод, основанный на возбуждении колебательных спектров молекул при помощи излучения в инфракрасной области и регистрации поглощения излучения исследуемым образцом. Инфракрасные спектры можно использовать для идентификации веществ по известным спектрам, а также для установления структуры неизвестного вещества. Поэтому ИК-спектрометрия активно применяется в современных разработках для исследования вновь получаемых соединений, различных полимерных материалов, сорбентов и др.
· возможность исследовать неизвестные вновь синтезированные соединения
· возможность установить структуру молекулы вещества
· возможность определить класс соединения (для органических соединений: алифатические, алкены, ароматические и др. соединения)
· возможность исследовать образец без растворения (анализ твердых материалов)
Методы элементного анализа
АЭС (атомно-эмиссионная спектроскопия). Метод основан на получении спектров эмиссии возбужденных атомов веществ. Проба вводится в источник, где происходит испарение, атомизация и возбуждение атомов, затем регистрируются испускаемые спектры. Источниками атомизации и возбуждения могут служить пламя, дуговой (ДПТ) и искровой разряды, индуктивно-связанная плазма (ИСП), микроволновая плазма, тлеющий разряд. Методы атомно-эмиссионной спектроскопии используются не только для качественного, но и для количественного анализа с высокой точностью. ИСП-АЭС метод подходит для анализа растворов и растворимых образцов, методом ДПТ-АЭС и АЭС с искровым разрядом можно анализировать твердые образцы. Следует отметить, что атомно-эмиссионные методы позволяют регистрировать очень низкие содержания элементов, их следовые количества, что крайне важно при анализе сверхчистых материалов и в других областях.
· сравнительно низкая погрешность анализа (воспроизводимость 1-5%)
· широкий круг определяемых элементов
· широкий диапазон определяемых концентраций
· низкие пределы обнаружения (возможность определять следовые количества)
· возможность исследования растворов
· нет возможности анализа пробы без растворения
· не определяются галогены, инертные газы, кислород, углерод
· возможность исследовать твердые пробы без растворения
· широкий круг определяемых элементов
· погрешность анализа около 20%
· достаточно выражены матричные эффекты (влияние состава пробы на сигнал аналита), что может приводить к занижению результатов в пробах со сложной матрицей
· сложная пробоподготовка (необходимо отсутствие органики, соответственно при отжиге органики из пробы есть риск потери определяемых элементов в виде летучих соединений)
· пределы обнаружения выше, чем у ИСП-АЭС
· не определяются галогены, кислород, азот, углерод и некоторые другие элементы
Источник
ОБЛАСТЬ ПРИМЕНЕНИЯ
Настоящий документ устанавливает методику количественного химического анализа проб почв, грунтов, илов, донных отложений, отходов производства и потребления для определения в них водорастворимых форм сульфат-ионов при массовой доле от 20,0 до 1000 мг/кг гравиметрическим методом.
Если массовая доля сульфат-ионов в анализируемой пробе превышает верхнюю границу диапазона, то допускается разбавление вытяжки таким образом, чтобы массовая доля сульфат-ионов соответствовала регламентированному диапазону.
Определению мешает присутствие больших количеств кальция, железа (III), нитрат-ионов. Для разложения карбонатов образцы карбонатных почв нагревают до 900 °С.
1 ПРИНЦИП МЕТОДА
Определение основано на осаждении сульфат-ионов раствором хлорида бария в солянокислом растворе с последующим определением сульфата бария гравиметрическим методом.
2 ПРИПИСАННЫЕ ХАРАКТЕРИСТИКИ ПОГРЕШНОСТИ ИЗМЕРЕНИЙ И ЕЕ СОСТАВЛЯЮЩИХ
Настоящая методика обеспечивает получение результатов анализа с погрешностью, не превышающей значений, приведённых в таблице 1.
Значения показателя точности методики используют при:
— оформлении результатов анализа, выдаваемых лабораторией,
— оценке деятельности лабораторий на качество проведения испытаний;
— оценке возможности использования результатов анализа при реализации методики в конкретной лаборатории.
Таблица 1 — Диапазон измерений, значения показателей точности, повторяемости и воспроизводимости методики
Показатель точности (границы относительной погрешности при вероятности Р = 0,95), ±δ, %
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости) σr, %
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости), σR, %
от 20 до 100 вкл.
св. 100 до 1000 вкл.
3 СРЕДСТВА ИЗМЕРЕНИЙ, ВСПОМОГАТЕЛЬНОЕ ОБОРУДОВАНИЕ, МАТЕРИАЛЫ, РЕАКТИВЫ
3.1 Средства измерений, вспомогательное оборудование, посуда и материалы
— Весы лабораторные с наибольшим пределом взвешивания 200 г по ГОСТ 24104-2001.
— Шкаф сушильный с регулятором температуры с погрешностью ±1 °С.
— Печь муфельная любого типа, обеспечивающая температурный режим от 700 до 900 °С.
— Баня водяная любого типа.
— Электроплитка с регулятором нагрева и закрытой спиралью по ГОСТ 14919-83.
— Колбы мерные, 2-100-2, 2-250-2, 2-500-2 по ГОСТ 1770-74.
— Пипетки градуированные 2 класса точности вместимостью 1, 2, 5, 10 см 3 по ГОСТ 29227-91.
— Пипетки с одной отметкой вместимостью 25 см 3 по ГОСТ 29169-91.
— Цилиндры или мензурки, 1(3)-50, 1(3)-100, 1(3)-250 по ГОСТ 1770-74.
— Государственный стандартный образец состава раствора сульфат-иона с погрешностью аттестованного значения не более 1 % при Р = 0,95, ГСО 6693-93.
— Стаканы химические В-1-100, B-1-250, B-1-500 по ГОСТ 25336-82.
— Колбы конические по ГОСТ 25336-82.
— Колбы круглодонные вместимостью 1000 см 3 по ГОСТ 25336-82.
— Стаканчики для взвешивания (бюксы) по ГОСТ 25336-82.
— Воронки лабораторные по ГОСТ 25336-82.
— Тигли фарфоровые диаметром 25 — 35 мм по ГОСТ 9147-80.
— Часовые стекла диаметром 7 — 10 мм.
— Фильтры мембранные «Владипор МФА-МА». С, 44 мкм по ТУ 6-05-1903.
— Фильтр обеззоленный «синяя лента» по ТУ 6-09-1678-86.
— Бумага индикаторная универсальная по ТУ 6-09-1181-76.
Допускается использование других типов средств измерений и вспомогательного оборудования, посуды и материалов с метрологическими и техническими характеристиками не хуже указанных.
— Барий хлористый дигидрат по ГОСТ 4108-72.
— Кислота хлористоводородная (соляная) по ГОСТ 3118-77.
— Серебро азотнокислое по ГОСТ 1277-75.
— Метиловый красный, индикатор.
— Спирт этиловый ректификованный по ГОСТ 18300-87.
— Кальций хлористый безводный по ТУ 6-09-4711-81 (для эксикатора).
— Вода дистиллированная по ГОСТ 6709-72.
— Вода бидистиллированная по ТУ 6-09-2502-77.
Все реактивы должны иметь квалификацию «хч» или «чда».
4 УСЛОВИЯ БЕЗОПАСНОГО ПРОВЕДЕНИЯ РАБОТ
4.1 При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007-76 и ПОТ Р М-004-97.
4.2 Электробезопасность при работе с электроустановками по ГОСТ 12.1.019-79.
4.3 Организация обучения работающих безопасности труда по ГОСТ 12.0.004-90.
4.4 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83.
5 ТРЕБОВАНИЯ К КВАЛИФИКАЦИИ ОПЕРАТОРОВ
Выполнение измерений может проводить химик-аналитик, владеющий техникой анализа, освоивший методику выполнения измерений и уложившийся в нормативы контроля точности.
6 УСЛОВИЯ ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
При выполнении измерений в лаборатории должны быть соблюдены следующие условия:
Температура окружающего воздуха (20 ± 5) °С.
Атмосферное давление (84 — 106) кПа.
Относительная влажность не более 80 % при температуре 25 °С.
Напряжение в сети (220 ± 22) В.
Частота переменного тока (50 ± 1) Гц.
7 ОТБОР И ХРАНЕНИЕ ПРОБ
Отбор проб производится в соответствии с требованиями ГОСТ 17.4.3.01-83 «Почвы Общие требования к отбору проб»; ГОСТ 17.4.4.02-84 «Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа»; ПНД Ф 12.1:2:2.2:2.3.2-2003 «Отбор проб почв, грунтов, осадков биологических очистных сооружений, шламов промышленных сточных вод, донных отложений искусственно созданных водоемов, прудов-накопителей и гидротехнических сооружений», ПНД Ф 12.4.2.1-99 «Отходы минерального происхождения. Рекомендации по отбору и подготовке проб. Общие положения» или другими нормативными документами, утверждёнными и применяемыми в установленном порядке.
При отборе проб составляется сопроводительный документ, в котором указывается:
цель анализа, предполагаемые загрязнители;
место, время отбора;
должность, фамилия отбирающего пробу, дата.
8 ПОДГОТОВКА К ВЫПОЛНЕНИЮ ИЗМЕРЕНИЙ
8.1 Приготовление растворов
На аналитических весах взвешивают 12 г бария хлористого дигидрата, растворяют в 90 см 3 дистиллированной воды и фильтруют через фильтр синяя лента. Срок хранения 6 месяцев.
Соляную кислоту разбавляют дистиллированной водой в соотношении (1:3) и ( 1:100), осторожно приливая кислоту в воду.
Срок хранения 6 месяцев.
Навеску 0,1 г метилового красного растворяют в 50 см 3 60 % раствора этилового спирта. Раствор хранят в склянке из темного стекла до помутнения или изменения окраски.
8.2 Определение влажности пробы
Пустые пронумерованные чашки доводят до постоянной массы в сушильном шкафу при t = (105 ± 2) °С, охлаждают в эксикаторе и взвешивают.
8 .2.2 Для пересчета массы навески на абсолютно сухую пробу определяют содержание гигроскопической влаги. Для этого берут 3 навески той же массы, помещают в предварительно подготовленные фарфоровые чашки (п. 8.2.1) и высушивают при t = (105 ± 5) °С в сушильном шкафу до постоянной массы.
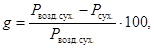
где g — содержание гигроскопической влаги, %;
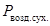
P сух. — масса абсолютно сухой навески, г.
При выполнении условия: | g max — g min | ≤ 12 % вычисляют g cp :
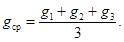
Определяют коэффициент пересчета на абсолютно-сухую пробу:
g cp — содержание гигроскопической влаги, %.
Точная масса навески абсолютно сухой пробы почвы (г) рассчитывается по формуле:
где K — коэффициент пересчета (формула 3).
9 ВЫПОЛНЕНИЕ ИЗМЕРЕНИЙ
Пробу анализируют в свежем состоянии. Помещают 100 г пробы в круглодонную колбу вместимостью 1000 см 3 , приливают 500 см 3 бидистиллированной воды, закрывают пробкой и взбалтывают в течении 3 мин. Вытяжку фильтруют через обеззоленный фильтр «синяя лента».
Для определения сульфат-ионов следует брать такое количество вытяжки, чтобы масса осадка сульфата бария была не больше 200 мг и не меньше 20 мг. Объем вытяжки доводят дистиллированной водой до 40 — 50 см 3 . Раствор подкисляют соляной кислотой (1:3) до появления розовой окраски по метиленовому красному.
Переносят 5 — 50 см 3 фильтрата в химиче ский стакан , подкисляют 10 % раствором хлористоводородной кислоты до розовой окраски по метиловому красному.
Избытка хлористоводородной кислоты следует избегать, так как растворимость сульфата бария в сильнокислом растворе значительно увеличивается.
Для определения сульфат-ионов следует брать такое количество вытяжки, чтобы вес осадка сульфата бария был не больше 200 мг и не меньше 20 мг.
При наличии в вытяжке органических веществ (проба окрашена в темный цвет) ее выпаривают в фарфоровой чашке на водяной бане досуха. Прокаливают в муфельной печи при температуре 700 °С в течение 2 ч, затем охлаждают, добавляют 1 см 3 соляной кислоты (1:3) и выпаривают досуха на водяной бане. При нагревании растворяют остаток в соляной кислоте (1:100), фильтруют через обездоленный фильтр «синяя лента» и доводят объем фильтрата дистиллированной водой до 40 — 50 см 3 .
Раствор нагревают до кипения и приливают к нему по каплям 10 см 3 горячего 10 % раствора хлорида бария, тщательно размешивая раствор палочкой после добавления каждой капли.
Колбу закрывают часовым стеклом и кипятят 10 мин. Затем колбу ставят на кипящую водяную баню на 2 часа для отстаивания осадка и фильтруют через обеззоленный фильтр «синяя лента». Предварительно в воронку с фильтром наливают доверху горячей бидистиллированной поды, чтобы уменьшить поры фильтра. Если в фильтрате появится осадок сульфата бария, то фильтрат снова фильтруют через тот же фильтр.
Осадок на фильтре промывают горячей дистиллированной водой, подкисленной соляной кислотой, до прекращения реакции на барий.
Фильтр с осадком подсушивают на воронке, помещают в тигель, доведенный до постоянной массы, и ставят в холодную муфельную печь, постепенно поднимая температуру до 750 °С. При этой температуре пробу выдерживают в течение 30 — 60 мин. Пробу доводят до постоянной массы и по разности весов тигля с пробой и пустого тигля вычисляют вес сульфата бария.
10 ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
Содержание сульфат-ионов (мг/кг) рассчитывают по формуле:
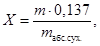
где m — масса сульфата бария, мг;
m абс.сух. — навеска анализируемой пробы, рассчитанная по формуле (4), кг;
0,137 — коэффициент пересчета сульфата бария в серу.
При расчете учитывается степень разбавления.
Полученные результаты содержания сульфатов могут быть пересчитаны на различные формы серы (таблица 2).
Источник
