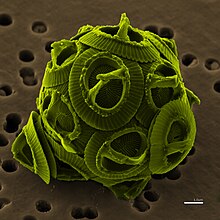
Культивирование микроводорослей в инкубаториях — Culture of microalgae in hatcheries
Микроводоросли или микроскопические водоросли растут как в морских, так и в пресноводных системах. Они являются основными производителями в океанах, которые превращают воду и углекислый газ в биомассу и кислород в присутствии солнечного света.
Самое древнее задокументированное использование микроводорослей было 2000 лет назад, когда китайцы использовали цианобактерии Nostoc в качестве источника пищи во время голода. Другой тип микроводорослей, цианобактерии Arthrospira ( Spirulina ), были обычным источником пищи среди населения Чада и ацтеков в Мексике еще в 16 веке.
Сегодня культивируемые микроводоросли используются в качестве прямого корма для людей и наземных сельскохозяйственных животных, а также в качестве корма для культивируемых водных видов, таких как моллюски и ранние личиночные стадии рыб и ракообразных. Это потенциальный кандидат для производства биотоплива . Микроводоросли могут расти в 20 или 30 раз быстрее, чем традиционные пищевые культуры, и им не нужно бороться за пахотные земли. Поскольку производство микроводорослей является центральным для многих коммерческих применений, существует потребность в производственных технологиях, которые повышают производительность и являются экономически выгодными.
СОДЕРЖАНИЕ
Обычно культивируемые виды микроводорослей
| Разновидность | заявка |
|---|---|
| Chaetoceros sp. | Аквакультура |
| Хлорелла обыкновенная | Источник природных антиоксидантов |
| Дуналиелла салина | Производят каротиноиды ( β-каротин ) |
| Haematococcus sp. | Производят каротиноиды ( β-каротин ), астаксантин , кантаксантин |
| Phaeodactylum tricornutum | Источник антиоксидантов |
| Порфиридий круентум | Источник антиоксидантов |
| Rhodella sp. | Краситель для косметики |
| Skeletonema sp | Аквакультура |
| Arthrospira maxima | Высокое содержание белка — Пищевая добавка |
| Arthrospira platensis | Высокое содержание белка — Пищевая добавка |
Технологии производства инкубатория
В инкубаториях выращивают различные виды микроводорослей, которые различными способами используются в коммерческих целях. Исследования оценили основные факторы успеха системы инкубирования микроводорослей, такие как размеры контейнера / биореактора, в котором выращиваются микроводоросли, воздействие света / облучения и концентрация клеток в реакторе.
Система открытых прудов
Этот метод используется с 1950-х годов. Выращивание микроводорослей в открытых водоемах дает два основных преимущества . Во-первых, систему открытых водоемов проще построить и эксплуатировать. Во-вторых, открытые пруды дешевле закрытых биореакторов, потому что закрытые биореакторы требуют системы охлаждения. Однако недостатком использования систем открытого пруда является снижение продуктивности некоторых коммерчески важных штаммов, таких как Arthrospira sp. , где оптимальный рост ограничен температурой. Тем не менее, для компенсации этого можно использовать отходящее тепло и CO2 из промышленных источников.
Метод эрлифта
Этот метод используется при выращивании и выращивании микроводорослей в открытом грунте; где воздух перемещается внутри системы для циркуляции воды там, где растут микроводоросли. Культура выращивается в прозрачных трубках, которые лежат горизонтально на земле и соединены сетью труб. Воздух проходит через трубку так, что воздух выходит из конца, который находится внутри реактора, содержащего культуру, и создает эффект, похожий на перемешивание.
Закрытые реакторы
Самым большим преимуществом культивирования микроводорослей в закрытой системе является контроль над физической, химической и биологической средой в культуре. Это означает, что факторы, которые трудно контролировать в системах открытых водоемов, такие как испарение, градиенты температуры и защита от загрязнения окружающей среды, делают закрытые реакторы более предпочтительными по сравнению с открытыми системами. Фотобиореакторы являются основным примером закрытой системы, в которой можно контролировать абиотические факторы. На сегодняшний день было протестировано несколько закрытых систем для культивирования микроводорослей, несколько важных из них упомянуты ниже:
Горизонтальные фотобиореакторы
Эта система включает трубы, проложенные на земле и образующие сеть петель. Смешивание суспендированной культуры микроводорослей происходит с помощью насоса, который поднимает культуру вертикально через определенные промежутки времени в фотобиореактор . Исследования показали, что импульсное перемешивание через определенные промежутки времени дает лучшие результаты, чем использование непрерывного перемешивания. Фотобиореакторы также ассоциируются с более высокой производительностью, чем системы открытых прудов, поскольку они могут поддерживать лучший температурный градиент. Пример, отмеченный в более высокой продуктивности Arthrospira sp. использование в качестве пищевой добавки было связано с более высокой продуктивностью из-за более подходящего температурного диапазона и более продолжительного периода выращивания в летние месяцы.
Вертикальные системы
В этих реакторах используются вертикальные полиэтиленовые рукава, подвешенные к железной раме. В качестве альтернативы также можно использовать стеклянные трубки. Микроводоросли также выращивают в вертикальных альвеолярных панелях (ВАП), которые представляют собой тип фотобиореактора . Этот фотобиореактор отличается низкой производительностью. Однако эту проблему можно решить, изменив отношение площади поверхности к объему ; где более высокий коэффициент может повысить производительность. Перемешивание и деоксигенация являются недостатками этой системы, и их можно устранить путем непрерывного барботирования воздуха со средней скоростью потока. Два основных типа вертикальных фотобиореакторов — это проточные VAP и пузырьковые колонки VAP.
Плоские реакторы
Реакторы с плоской пластиной (FPR) построены с использованием узких панелей и размещаются горизонтально для максимального поступления солнечного света в систему. Концепция FPR заключается в увеличении отношения площади поверхности к объему, чтобы можно было эффективно использовать солнечный свет. Эта система выращивания микроводорослей изначально считалась дорогой и не способной распространять культуру. Таким образом, использование FPR в целом было признано нецелесообразным для коммерческого производства микроводорослей. Однако экспериментальная система FPR в 1980-х годах использовала циркуляцию внутри культуры из газообменной установки через горизонтальные панели. Это решает проблемы с циркуляцией и обеспечивает преимущество открытой газообменной установки, которая снижает накопление кислорода. Примеры успешного использования FPR можно увидеть в производстве Nannochloropsis sp. используется из-за высокого уровня астаксантина .
Реакторы ферментерного типа
Реакторы ферментерного типа (FTR) — это биореакторы, в которых осуществляется ферментация . FTRs не получили большого развития в выращивании микроводорослей и имеют недостаток в соотношении площади поверхности к объему и сниженной эффективности использования солнечного света. FTR были разработаны с использованием комбинации солнечного и искусственного света, что привело к снижению производственных затрат. Однако доступная информация о крупномасштабных аналогах разрабатываемых лабораторных систем очень ограничена. Основное преимущество заключается в том, что внешние факторы, то есть свет, можно контролировать, а производительность может быть увеличена, так что FTR может стать альтернативой для продуктов для фармацевтической промышленности.
Коммерческие приложения
Использование в аквакультуре
Микроводоросли являются важным источником питания и широко используются в аквакультуре других организмов либо напрямую, либо в качестве дополнительного источника основных питательных веществ. Фермы аквакультуры, выращивающие личинок моллюсков , иглокожих , ракообразных и рыб, используют микроводоросли в качестве источника питания. Низкое содержание бактерий и высокая биомасса микроводорослей — важный источник пищи для аквакультуры моллюсков.
Микроводоросли могут стать началом цепочки дальнейших процессов аквакультуры. Например, микроводоросли являются важным источником пищи в аквакультуре морских креветок . Морские креветки производят спящие яйца, называемые цистами , которые могут храниться в течение длительного времени, а затем вылупляться по мере необходимости, чтобы обеспечить удобную форму живого корма для аквакультуры личинок рыб и ракообразных.
Другие применения микроводорослей в аквакультуре включают повышение эстетической привлекательности рыб, выращиваемых в неволе. Один из таких примеров можно отметить в аквакультуре лосося , где микроводоросли используются для придания более розового цвета мясу лосося. Это достигается за счет добавления в рацион сельскохозяйственных животных натуральных пигментов, содержащих каротиноиды, таких как астаксантин, производимый микроводорослями Haematococcus . Два вида микроводорослей, I. galbana и C. calcitrans , в основном состоят из белков, которые используются для придания яркости лососям и родственным видам.
Питание человека
Основными видами микроводорослей, выращиваемых в качестве здоровой пищи, являются хлорелла и спирулина ( Arthrospira platensis ). Основные формы производства происходят в небольших прудах с искусственными смесителями. Arthrospira platensis — сине-зеленая микроводоросль, долгое время использовавшаяся в качестве источника пищи в Восточной Африке и доколониальной Мексике. Спирулина с высоким содержанием белка и других питательных веществ находит применение в качестве пищевой добавки и при недоедании. Он хорошо растет в открытых системах, и коммерческие производители сочли его хорошо подходящим для выращивания. Одна из крупнейших производственных площадок — озеро Тескоко в центральной Мексике. Растения производят множество питательных веществ и большое количество белка и часто используются в коммерческих целях в качестве пищевой добавки. Хлорелла имеет сходные со спирулиной питательные вещества и очень популярна в Японии . Он также используется в качестве пищевой добавки с возможным влиянием на скорость метаболизма .
Производство длинноцепочечных омега-3 жирных кислот , важных для питания человека можно также культивировать через микроводоросли рыбоводных систем.
Австралийские ученые из Университета Флиндерса в Аделаиде экспериментируют с использованием морских микроводорослей для производства белков для потребления человеком, создавая такие продукты, как « икра », веганские гамбургеры, поддельное мясо , джемы и другие пищевые спреды . Управляя микроводорослями в лаборатории , можно увеличить содержание белка и других питательных веществ , а также изменить вкус, чтобы сделать их более вкусными. Эти продукты оставляют гораздо более легкий углеродный след, чем другие формы белка, поскольку микроводоросли поглощают, а не производят углекислый газ , который способствует образованию парниковых газов .
Производство биотоплива
Чтобы удовлетворить потребности в ископаемом топливе , исследуются альтернативные виды топлива. Биодизель и биоэтанол — это возобновляемые виды биотоплива с большим потенциалом, которые важны в текущих исследованиях. Однако возобновляемые виды топлива на основе сельского хозяйства могут быть не полностью устойчивыми и, следовательно, не смогут заменить ископаемое топливо. Микроводоросли могут быть чрезвычайно богаты маслами (до 80% сухой массы биомассы ), пригодными для преобразования в топливо. Более того, микроводоросли более продуктивны, чем земледельческие культуры, и поэтому могут быть более устойчивыми в долгосрочной перспективе. Микроводоросли для производства биотоплива в основном производятся с использованием трубчатых фотобиореакторов .
Фармацевтика и косметика
Новые биоактивные химические соединения могут быть выделены из микроводорослей, таких как сульфатированные полисахариды . Эти соединения включают фукоиданы , каррагинаны и ульваны , которые используются из-за их полезных свойств. Эти свойства являются антикоагулянтами , антиоксидантами , противораковыми средствами, которые проходят проверку в медицинских исследованиях.
Красные микроводоросли характеризуются пигментами, называемыми фикобилипротеинами, которые содержат натуральные красители, используемые в фармацевтике и / или косметике .
Биоудобрение
Сине-зеленая водоросль впервые использовалась как средство фиксации азота, позволяя цианобактериям размножаться в почве, действуя как биоудобрение . Фиксация азота важна как средство, позволяющее преобразовывать неорганические соединения, такие как азот , в органические формы, которые затем могут быть использованы растениями. Использование цианобактерий — это экономически выгодный и экологически чистый метод повышения урожайности. Этот метод использовался для выращивания риса в Индии и Иране с использованием азотфиксирующих свойств свободноживущих цианобактерий для увеличения содержания азота в почвах.
Другое использование
Микроводоросли являются источником ценных молекул, таких как изотопы, т.е. химические варианты элемента, содержащие разные нейтроны. Микроводоросли могут эффективно включать в свою биомассу изотопы углерода ( 13 C), азота ( 15 N) и водорода ( 2 H). 13 C и 15 N используются для отслеживания потока углерода между различными трофическими уровнями / пищевыми цепями. Изотопы углерода, азота и серы также могут использоваться для определения нарушений в донных сообществах, которые иначе трудно изучить.
Проблемы
Хрупкость клеток — самая большая проблема, ограничивающая производительность закрытых фотобиореакторов . Повреждение клеток может быть связано с турбулентным потоком внутри биореактора, который необходим для создания перемешивания, чтобы свет был доступен всем клеткам.
Источник
Энергоэффективные очистные сооружения
Культивирование биомассы микроводорослей
Производство биомассы микроводорослей обычно более затратно, чем выращивание сельскохозяйственных культур. Для процесса фотосинтеза требуется свет, диоксид углерода, вода и неорганические соли. Температуру необходимо поддерживать в пределах 20-30°С. С целью снижения расходов требуется доступный солнечный свет. Питательная среда должна содержать неорганические элементы для формирования клеток микроводорослей, в числе которых азот, фосфор, железо и в некоторых случаях кремний.
Биомасса микроводорослей содержит до 50% углерода, полностью образующегося за счет поглощения диоксида углерода. При производстве 100 т биомассы водорослей фиксируется 183 т диоксида углерода. При этом для производства биодизельного топлива может быть использован диоксид углерода, выделяющийся на электростанциях при сжигании топлива [3].
При промышленном производстве биомассы микроводорослей в дневное время при воздействии солнечного света организуют непрерывную подачу питательной среды и непрерывный отвод с той же скоростью жидкой среды, содержащей микроводоросли. Подачу прекращают в ночное время, но перемешивание для предотвращения оседания биомассы должно быть непрерывным. Около 25% биомассы, произведенной в дневное время, может быть потеряно в ночное время в результате дыхания микроорганизмов. Масштаб этих потерь зависит от интенсивности дневного света, температуры в дневное и ночное время.
Около 100 компаний в странах мира занимаются производством биодизельного топлива из микроводорослей. Среди них Algenol, Algodyne Ethanol Energy, Solazyme, Green Star Products и др.
В настоящее время для реализации процесса используют в основном системы с взвешенной биомассой, работающие в непрерывном, периодическом или полупериодическом режимах. К наиболее распространенным крупномасштабным такого рода сооружениям относятся:
- открытые пруды в виде системы каналов с принудительным движением питательной среды,
- трубчатые фотобиореакторы,
- стабилизационные пруды для сточных вод [3].
Пруды с принудительным движением
Пруды с принудительным движением представляют собой замкнутые каналы с циркуляцией питательной среды глубиной около 0,3 м.
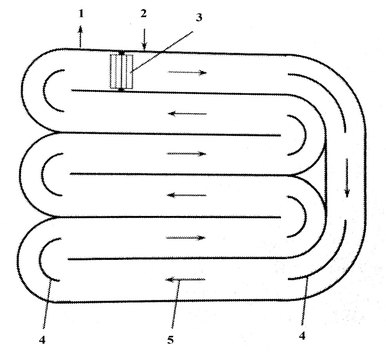
Для смешения и циркуляции используют гребное колесо. Поток жидкости направляется отражательными перегородками. Каналы выполнены из бетона или утрамбованной земли, могут быть выстланы изолирующим пластиком. Гребное колесо работает постоянно для предотвращения оседания биомассы.
Подобные сооружения находятся в эксплуатации с 1950-х годов с целью более эффективной обработки сточных вод (в сравнении с стабилизационными прудами) и получения биомассы для потенциального производства энергии. Крупнейшие из них занимают площадь свыше 400 тыс. м²[4].
Для данной технологии требуются сравнительно невысокие капиталовложения и эксплуатационные затраты. В этих сооружениях, однако, удается получать только низкую концентрацию биомассы микроводорослей.
Фотобиореакторы
Фотобиореакторы являются другой широко распространенной технологией культивирования биомассы водорослей.
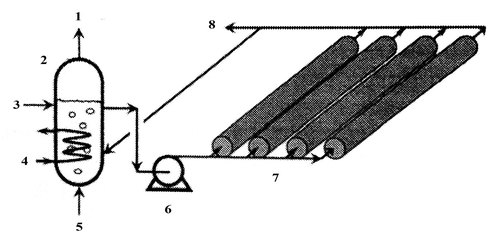
В этих закрытых системах существует возможность достижения высокой производительности по биомассе, а также создания стерильных условий для выращивания монокультуры водорослей. В этих системах проведены эксперименты по культивированию микроводорослей на сточных водах. Выращивание монокультуры, однако, не всегда целесообразно на городских сточных водах. Фотобиореакторы в настоящее время предназначены для культивирования монокультуры с высоким липидным содержанием и, соответственно, высоким энергетическим потенциалом [5].
Фотобиореакторы предназначены для длительного культивирования монокультуры микроводорослей и практически используются для получения больших количеств биомассы. Такой реактор состоит из батареи прозрачных труб, изготовленных из стекла или пластика, являющихся солнечным коллектором. Диаметр труб должен быть не более 0,1 м, чтобы солнечный свет мог проникать в плотную биомассу водорослей. Субстрат циркулирует между резервуаром (колонна для дегазирования) и батареей труб. Поверхность площадки под трубами часто выстилают пластиком для увеличения отражения света. В случае фотобиореактора небольшой производительности вместо горизонтального расположения трубы из гибкого пластика могут быть свернуты спиралью по внешней поверхности вертикального цилиндрического основания. Оседанию микроводорослей в трубах препятствует высокая турбулентность потока.
В процессе фотосинтеза происходит выделение кислорода. Максимальная скорость этого процесса достигает 10 г(О₂)/м³мин. Концентрация растворенного кислорода выше определенного предела ингибирует фотосинтез и в сочетании с интенсивным освещением разрушает клетки водорослей. Удаление избыточного кислорода проводят в колонне для дегазации при барботаже воздуха.
По мере продвижения субстрата по трубам происходит увеличение рН среды в результате потребления СО₂, который дозируют в зону дегазации. Дополнительные точки дозирования СО₂ могут быть предусмотрены по длине труб. Фотобиореакторы требуют охлаждения в период наибольшей интенсивности солнечного света. Температурный контроль нужен и в ночное время. В частности потери биомассы в ночное время в результате дыхания могут быть уменьшены при понижении температуры [3].
Технологическая схема на базе фотобиореакторов, обеспечивающая производство 100000 т/год биомассы, включает 6 независимых установок, каждая из которых состоит из 132 параллельных труб длиной до 80 м, диаметром 0,06 м. Площадь производственной площадки составляет порядка 6000 м². Выход масла достигает 140 м3/га (при 70%-ном содержании масла в биомассе). Аналогичная по годовой производительности биомассы схема на базе открытых скоростных прудов включает 8 водоемов площадью около 1000 м2 (82х12), глубиной 0,3 м. В этом случае производственная площадь достигает 8000 м², а выход масла – порядка 100 м³/га [2].
Стабилизационные пруды
Стабилизационные пруды наиболее распространены для проведения фототрофного технологического процесса. В США, например, насчитывается более 7000 такого рода очистных сооружений, составляющих треть централизованных систем очистки сточных вод [6].
В течение дневного времени фототрофы производят растворенный кислород, усиливающий снижение ХПК аэробными гетеротрофными бактериями и способствующий фотоокислительной инактивации патогенных микроорганизмов. Стабилизационные пруды обеспечивают экономичную обработку сточных вод, но используются, главным образом, в сельской местности из-за потребности в больших земельных площадях. Эти сооружения используют исключительно для очистки сточных вод (снижение ХПК, удаление азота, фосфора, тяжелых металлов).
Лишь в нескольких публикациях обсуждаются перспективы культивирования в них биомассы для производства энергии. Между тем именно на базе стабилизационных прудов имеется наиболее реальная перспектива создать очистные сооружения, обеспечивающие собственные энергетические потребности, или даже являющиеся производителями энергии [7].
Итак, в стабилизационных прудах проводят обработку городских или сельскохозяйственных сточных вод. К настоящему времени цель применения подобных сооружений — удаление биогенов (часто наряду с ХПК), но не извлечение биогенов или сырья для производства энергии. Более капиталоемкие системы, такие как фотобиореакторы, предназначены, главным образом, для культивирования фототрофов. В этом случае преследуется в основном цель получения сырья для производства энергии, а не очистки сточных вод.
Стоимость сбора биомассы (включая флокуляцию, центрифугирование и отстаивание) остается основным препятствием реализации схем с микроводорослями, находящимися во взвешенном состоянии. Отстаивание относится к сравнительно недорогим технологическим операциям, но обеспечивает извлечение 50-90% биомассы.
Для достижения извлечения свыше 95% биомассы расходы существенно возрастают. В этой связи привлекают внимание процессы с прикрепленной биомассой, которую по мере накопления снимают с поверхности канала. В части культивирования микроводорослей из такого рода оборудования относительное распространение получил ATS (Algal turf scrubber)-скруббер, представляющий собой расположенный под углом 1-2° канал (1х30 м), выложенный изолирующим материалом (0,75 мм) (аналогичным слою изоляции полигонов ТБО), поверх которого уложена нейлоновая сетка (толщиной до 5-6 мм). Протекающая по поверхности скруббера жидкость поступает в бетонный зумпф. На поверхности формируется биопленка, перерабатывающая биогены. По мере накопления биомассы каждые 4-12 сут проводят ее вакуумное удаление [8].
Примерами промышленной реализации данной технологии являются процессы Aquafiber Technologies (30 тыс. т/сут) и HydroMentia (120 тыс. т/сут) [6].
Автор статьи: Кофман Владимир Яковлевич
Источник