Физиологическая реакция солей (удобрений)
Растения обладают избирательной поглотительной способностью и потребляют больше тех элементов, которые им необходимы. В результате этого неиспользованные растениями ионы, нейтральных вне сферы деятельности корневой системы, может приводить к изменению рН среды, если в ней выращиваются растения. В зависимости от преимущественного поглощения растениями из солей катионов или анионов их делят на физиологически кислые и физиологически щелочные соли.
Соли, из состава которых в больших количествах поглощаются анионы, чем катионы – NaNO3, KNO3, Ca(NO3)2 и в результате происходит подщелачивание, являются физиологически щелочными.
Соли, из которых растения в больших количествах используют катион, чем анион – (NH4)2SO4, NH4Cl, KCl, K2SO4 и в результате подкисляется раствор, называются физиологически кислыми.
Кальциевая, натриевая и калийная селитры являются физиологически щелочными удобрениями, так как при их внесении растения преимущественно используют анион NO3 — , а остающиеся неиспользованными катионы натрия, кальция или калия образуют основания (Са(ОН)2, КОН, NаОН) и сдвигают реакцию почвенного раствора в щелочную сторону. Физиологическая щелочность калийной селитры, кроме того обусловлена гораздо более высоким содержанием в ней калия, чем азота, при этом в почве остаются неиспользованными ионы калия и почвенный раствор подщелачивается. Благодаря нейтрализующему действию нитратные азотные удобрения эффективны на кислых дерново-подзолистых почвах.
Наиболее типичными представителями физиологически кислых солей являются аммонийные азотные удобрения – сульфат аммония и хлористый аммоний. При их внесении растения преимущественно используют катион аммония, а остающиеся анионы образуют кислоты (НCl, H2SO4), подкисляя почву. Физиологически кислым удобрением является и аммонийная селитра, за счет более энергичного поступления в корневую систему NH4 + по сравнению с NO3 — .
Однако следует иметь в виду, что при определенных условиях не только не проявляется преимущество аммиачного питания над нитратным, но нитратное питание может быть лучшим. Это наблюдается при кислой реакции среды, недостатке в ней кальция и наличии достаточного количества молибдена, марганца, участвующих в восстановительных процессах нитратов в растениях, а также при внесении азотных удобрений в рядки при посеве сельскохозяйственных культур. Использование аммонийных азотных удобрений может вызвать аммиачное отравление молодых проростков растений, особенно у культур с мелкими семенами, которые содержат малый запас углеводов.
Аммонийный азот удобрений в почве может подвергаться нитрификации с образованием азотной кислоты и ее солей – нитратов. В результате подкисляющее действие удобрения на почву, вызванное избирательным поглощением растениями аммония, усиливается за счет образования азотной кислоты при нитрификации некоторой части аммонийного азота или ослабляется при последующим образовании солей азотной кислоты. Поскольку нитрификация происходит при участии микроорганизмов, аммонийные удобрения являются не только физиологически, но и биологически кислыми.
Карбамид, содержащий азот в амидной форме, в почве, под действием уробактерий, выделяющих фермент уреазу, за 2 – 3 дня аммонифицируется с образованием малостойкого соединения – углекислого аммония, легко разлагающегося на аммиак и бикарбонат аммония, что может приводить к потерям азота:
В первые дни после внесения мочевины происходит временное местное подщелачивание почвы. Образующийся аммоний обменно поглощается почвой, постепенно нитрифицируется в результате чего подщелачивание сменяется подкислением. Подкисление почвы возможно также за счет избирательного поглощения растениями ионов аммония после аммонификации мочевины. Это биологически и физиологически кислое удобрение.
Калийные удобрения (кроме калийной селитры) также проявляют физиологическую кислотность, но она выражена слабее, чем у аммонийных солей, и часто зависит от вида растений. При внесении этих удобрений под калиелюбивые растения подкисляющее действие их на почву проявляется сильнее, вследствие более интенсивного использования катиона калия, а остающиеся анионы образуют кислоты (HCl, H2SO4), подкисляя почву.
Систематическое использование физиологически кислых удобрений требует опережающего известкования для нейтрализации кислот. Физиологическая кислотность аммонийной селитры значительно слабее, чем чисто аммонийных удобрений, но сильнее, чем хлористого калия, и примерно одинаковая с мочевиной. Так, для нейтрализации физиологической кислотности 1 ц хлористого аммония требуется 1,4 ц СаСО3, 1 ц сульфата аммония – 1,3 ц, мочевины – 0,8 ц, аммонийной селитры – 0,75, хлористого калия – 0,5 ц СаСО3.
В реальных условиях подкисляющее или подщелачивающее действие зависит от буферной способности почв, ее микробиологической активности, доз вносимых удобрений, гранулометрического состава почв и других факторов.
От физиологически кислых и щелочных солей следует отличать гидролитически кислые и гидролитически щелочные. Все соли применяемые в качестве удобрений по химическим свойствам могут быть нейтральными, гидролитически кислыми или щелочными. К нейтральным солям относятся, образованные сильным основанием и сильной кислотой (например, KCl, K2SO4, Na2SO4, NaNO3 и т. д.). К гидролитически щелочным относят соли, образованные сильным основанием и слабой кислотой (K2CO3, Nа2CO3 и др.), которые при взаимодействии с водой сообщают раствору щелочную реакцию:
Наоборот, соли слабого основания и сильной кислоты (FeCl3) при гидролизе подкисляют раствор за счет образования сильной кислоты:
Ряд удобрений (например, суперфосфат, аммонийная селитра, сульфат аммония), в силу несовершенства технологического процесса производства, могут иметь так называемую свободную кислотность, которая подкисляет почвенную среду.
Источник
13. Физиологическая реакция солей. Физиологически кислые, физиологические щелочные и нейтральные удобрения, их влияние на агрохимические, агрофизические и биологические свойства почвы
Физиологическая реакция солей имеет большое значение при выборе удобрений для различных почвенных условий. Например, длительное применение на кислых почвах физиологически кислых удобрений может привести к дальнейшему подкислению почв, что может отрицательно сказаться на ее плодородии. Физиологическая реакция солей связана с питанием растений. Кроме химических свойств солей, на реакцию питательной смеси оказывает влияние их физиологическая реакция, связанная с неодинаковым потреблением растением составных частей каждой соли. Физиологическая реакция солей, входящих в питательную смесь, обусловливает изменение реакции смеси под влиянием воздействия растения с течением времени. Направление этого изменения, то есть физиологическая кислотность или физиологическая щелочность питательной смеси, зависит главным образом от того, в виде каких солей находится в ней азот, так как в эквивалентах азота потребляется растением больше, чем других элементов. Физиологическая реакция солей, входящих в питательную смесь, обусловливает изменение реакции смеси под влиянием воздействия растения с течением времени. Направление этого изменения, то есть физиологическая кислотность или, физиологическая щелочность питательной смеси, зависит главным образом от того, в виде каких солей находится в ней азот, так как в эквивалентах азота потребляется растением больше, чем других элементов. Физиологическая кислотность удобрения— свойство его подкислять реакцию среды, связанное с преимущественным использованием растениями катионов из состава соответствующей соли. К ним относятся аммиачные удобрения, хлористый калий. Физиологическая кислотность этих удобрений связана с преимущественным использованием растениями катионов (NH , К+ и др.) из состава соответствующих солей; сопутствующие анионы (S04 —, С1_ и др.) остаются в почве и, постепенно накапливаясь, подкисляют ее. Физиологическая щелочность удобрения— свойство удобрения подщелачивать реакцию среды, связанное с преимущественным использованием растениями анионов из состава соли. К ним относятся в основном нитратные удобрения. Физиологическая щелочность этих удобрений связана с преимущественным использованием растениями анионов (NO3-, S04 и др.) из состава соответствующих солей. Сопутствующие катионы (Na , К или Са ) остаются в почве и подщелачивают ее.
14.Значение азота в питании раст и его содержание в различных органах с/х культур. N входит в состав всех простых и сложных белков, нуклеиновых к-т, хлорофилла, ферментов и витаминов. Регулируя N-ое пит-ие раст, можно в значит мере корректировать уровень урожая. При хорошем Nном питании раст повышается синтез белковых в-в. Раст образуют мощные стебли и листья, что позволяет раст накапливать большое кол-во продуктов фотосинтеза.При недост N, в первую очередь дефецит N сказывается на развитии вегет массы. Сред сод-ние N в раст нах-ся в пределах 0,5-5% воз.сух массы. Большое кол-во N в семенах.В вегет органах N меньше: в соломе боб-х 1-1,4%, в соломе злак-х 0,45-0,65%. Еще меньше N в корне и клубнеплодах и овощных раст, карт(0,32%), сах свекла(0,24), капуста (0,33). Содерж N может меняться в завис-ти от возраста, почв-климат усл-й, обеспеч пит эл-тами. В молод возрасте вегет органы раст наиболее богаты N. По мере из старения N в-ва передвигаются во вновь появляющиеся листья и побеги.
15.Значение фосфора в жизни раст, и его содержание в различных органах раст. Р накапливаеися больше всего в репрод органахи в тех органах, где интенсивно идут процессы синтеза орг в-в.Р в раст сод-ся в минер и орган соединениях(минер-5-15%, орган 85-95%) наиболее важную роль в жизни раст играет Р, входящий в состав орган соед-й: нуклеин к-т, нуклеопротеидов, фосфатопротеидов, аденозинфосфатов, сахарофосфатов, фосфатидов, фитина. Большая часть Р нах-ся в репродук органах и молодых интенсивно растущих частях раст. Р ускоряет форм-ние корн системы раст-она сильнее ветвится и глубже проникает в почву. Осн кол-во Р раст потребляют в первые фазы роста и разв-я. В дальнейшем реутилизируется.Хорошая обеспечен Р способствует экон расходованию влаги, что повыш засухоустойч.
Р в раст в 2-3 раза меньше, чем N. Р в раст содер-ся гораздо больше в зерне и в товарной продукции, чем в соломе. Оз пш(0,85-1%), горох (0,9-1,1%), карт(0,14%)
Источник
7. Физиологическая реакция удобрений. Значение её для практики применения удобрений.
Соли, применяемые в качестве минеральных удобрений, могут быть физиологически кислыми, щелочными / нейтральными. Растения в процессе роста избирательно поглощают ионы. Значение тех / иных катионов и анионов в питании растений определяет различную интенсивность их поглощения. Остающиеся в пит-ном р-ре ионы опред его реакцию.
Физиолог кислотность удобрения — св-во его подкислять среду (преимущественное использование растениями катионов из состава соответствующей соли).
Физиолог щелочность удобрения — св-во удобрения подщелачивать среду, связанное с преимущественным использованием растениями анионов из состава соли. При определении действия пит-х смесей на изменение рН среды следует учитывать не только первичную реакцию солей, но и их физиологическую реакцию.
В практике, особенно при высоком уровне применения удобрений и на малобуферных почвах, следует обязательно учитывать физиолог реакцию солей. В случае применения физиолог кислых солей необходимо проводить опережающее известкование.
8. Некорневое питание, его роль в системе удобрения овощных культур защищенного грунта.
При малообъемном выращивании овощных культур в защищенном грунте дополнением к корневому питанию служат некорневые подкормки (НПо). Их применяют с определенной периодичностью, а при недостатке какого-либо пит-го элем, при заболевании растений — по мере необходимости. При НПо раст-й активизир окисло-восстан процессы, дыхание, оплодотворение.
Для таких подкормок только водорастворимые удобрения, не содержащие вредные для растения примеси. Для опрыскивания растений в ранние фазы роста и развития — р-р меньшей конц, чем для опрыскивания взрослых растений.
Обработку растений производят в пасмурную погоду / во второй половине дня. При таких условиях испарение с поверхности листьев ниже, чем при ярком солнечном свете, и растения поглощают пит-е в-ва из низко концентрированного р-ра. При быстром испарении воды с поверхности листа конц пит-х элементов может резко увеличиваться, при этом возникает опасность появл ожогов, в том числе солнечных, на листьях.
Конц раствора для НПо устанавливают в зависимости от биолог особенностей культуры и стадии развития растений. Причем в первый период роста конц пит-го раствора должна быть ниже, чем в период плодоношения.
В состав раствора наряду с макроэлементами, целесообразно вводить микроэлементы. Часто для некорневых подкормок применяют только растворы микроэлементов.
Микроэлем, внесенные на листовую поверхность, способствуют повышению иммунитета растений к возбудителям ряда болезнен: усил рост корней (бор, медь); ускор развитие растений и созревание семян (бор, медь, молибден, марганец). НПо микроэлем повышают качество овощной продукции.
9. Понятие о «критическом» и «максимальном» периодах поглощения.
Поглощ элем пит-я в период роста растений неравномерное. Недостаточная обеспеченность пит-я в тот / иной период их жизни ведѐт к снижению урожая и ухудшению его качества. При планировании системы пит-я раст-й учитывается критич период их развития, когда размеры потребл пит-х элем минимальные, но их недостаток сказывается в последующие фазы развития. У всех растений таким периодом явл фаза всходов, когда корневая система слабо развита и не может усваивать достаточно пит-х в-в из почвы.
В прикорн зоне элем пит-я должны быть в раствор-й форме и конц не должна быть высокой. Период обуслов тем, что весной конц элем пит-я очень низкая. На всех почвах у всех раст-й отмеч-ся КП в отнош фосфора. Последующее нормальное питание N, P не может исправить ущерба, нанесѐнного в начале роста.
Вторым периодом, в котором растения весьма чувствительны к недостатку элементов питания — фаза интенсивного накопления вегетативной массы. Период максимального потребления элем питания, под которым понимают период наибольшего поглощения пит-х в-в.
Источник
Физиологическая кислотность удобрения обусловлена
Эффективность удобрения определяется свойствами как солей, входящих в его состав, так и почвой, в частности, реакциями, которые происходят между удобрением и различными почвенными компонентами. И именно препятствия на пути от гранулы к корню растения снижают коэффициент использования удобрения и, соответственно, возврат инвестиций. (Статья Ирины Логиновой для журнала «Агроиндустрия», сентябрь 2019 г.)
Препятствие первое. Растворение
Зависит от количества влаги в почве и характеристик самих удобрений. Первое мы можем до некоторой степени контролировать путем выбора оптимального срока и способа внесения удобрения в почву. Так, заделка во влажный слой почвы повышает шансы удобрения раствориться до начала активного потребления растением. Это особенно актуально для фосфорных удобрений, ввиду очень низкой подвижности фосфора в почве и неспособности промываться на достаточную глубину в корнеобитаемый слой при поверхностном внесении.
В немного лучшие условия попадают жидкие удобрения, для которых отсутствует стадия растворения, и которые менее зависимы от влажности почвы на момент внесения. Правда, это не относится к безводному аммиаку, для которого внесение в недостаточно увлажненную почву может приводить к повышению непродуктивных потерь азота.
Во-вторых, характеристики самих удобрений определяют их растворимость в почвенной влаге. Традиционные азотные удобрения являются хорошо растворимыми в воде солями, исключение составляют только специальные азотные удобрения контролируемого и пролонгированного действия. То же относится и к калийным удобрениям: хлориды и сульфаты калия, которые чаще всего являются солями традиционных калийсодержащих удобрений, хорошо растворимы в воде.
Растворимость фосфорсодержащих удобрений зависит от их солевого состава: по растворимости в различных растворах фосфорные удобрения делятся на водорастворимые, содержащие преимущественно однозамещенные фосфаты (SSP, TSP, MAP, DAP, APP), цитраторастворимые, содержащие двухзамещенные фосфаты (DCP, термофосфаты) и труднорастворимые фосфаты, содержащие трехзамещенные фосфаты (фосфоритная мука).
В состав сложных NPK удобрений входят преимущественно соли первой группы; однако, на рынке есть также составы, содержащие большую долю двух- и трехзамещенных фосфатов, что напрямую будет влиять на их растворимость и эффективность. Также на растворимость NPK удобрений будет влиять их марка: как правило, высокоазотные марки лучше растворимы в воде.
Необходимо также заметить, что даже в группе водорастворимых фосфорных удобрений есть различия. Хотя и кальций- и аммонийфосфаты относятся к водорастворимым, они имеют разную растворимость и степень диффузии в почве: аммонийфосфаты (МАР, DAP) являются более водорастворимыми соединениями в сравнении с кальцийфосфатами (SSP, TSP).
Таким образом, компонентный (солевой) состав удобрений в первую очередь влияет на их растворимость в почве и динамику высвобождения элементов питания в почвенный раствор.
Кроме того, технология производства и характеристики самой гранулы будут оказывать влияние на растворение в почвенной влаге. Методы грануляции оказывают влияние на размер, форму, прочность гранулы и другие ее характеристики, которые косвенно также влияют на характер растворения в почве. На растворимость гранулы будут оказывать влияние также филлеры (наполнители), примеси и кондиционирующие добавки.
Размер гранул играет важную роль: стартовые микрогранулированные удобрения, специализированные для внесения при посеве в борозду (технология In-Furrow), ввиду малого размера гранул, обеспечивают лучшее распространение в почве при внесении и более равномерное распределение, что увеличивает площадь контакта с почвой и корнями растений и способствует большей эффективности удобрения.
Растворение гранул водорастворимых удобрений происходит достаточно быстро, даже при условии невысокого содержания влаги в почве. Вода, необходимая для растворения, проникает в гранулу удобрения путем капиллярного или транспорта паров, в результате вокруг гранулы удобрения формируется почти насыщенный раствор солей. Это приводит к созданию осмотического градиента между концентрированным раствором удобрения и почвенной влагой. Поскольку вода движется в зону удобрения, раствор удобрения движется в окружающую почву. Это движение воды внутрь и раствора удобрения наружу продолжает поддерживать практически насыщенный раствор до тех пор, пока не растворится вся гранула.
Даже после того, как исчерпывается резерв солей в грануле, этот осмотический градиент будет существовать до момента разбавления или реакции между компонентами удобрения и почвенным раствором, восстанавливая последний до его природного состава.
Препятствие второе. Изменения рН
Когда концентрированный раствор солей удобрения покидает гранулу и переходит в окружающую почву, он влияет на характеристики почвы, и в то же время, сам раствор удобрения изменяется под влиянием компонентов почвы. Более того, когда виртуально насыщенный раствор удобрения покидает гранулу и движется в ближайшую зону почвы, в этой зоне на поведение удобрения большее влияние оказывают свойства самого насыщенного раствора, нежели свойства почвы.
Прямым следствием взаимодействия удобрения с почвой является изменение рН почвы под влиянием насыщенного раствора удобрения. Однако, существует ограничение в точности предсказания влияния удобрения на рН почвы, если основываться только на его химическом составе, поскольку очень много факторов взаимодействуют при внесении удобрения в почву: например, вид растения, исходное значение рН почвы, остаточная известь, микробиологическая активность в почве и др.
Соли удобрений классифицируются на химически кислые, нейтральные или щелочные. Например, KCl или Ca(NO3)2 — химически нейтральные соли, моноаммонийфосфат NH4H2PO4 – химически кислая, а диаммонийфосфат (NH4)2HPO4 – химически щелочная. Однако, в случае с удобрениями, большую роль в остаточной реакции удобрения играют растения и почва.
Во-первых, для поддержания баланса зарядов на поверхности корней, при поглощении катионов растения должны либо выделять в ризосферу соответствующее количество других катионов, либо поглощать больше анионов.
Баланс зарядов на поверхности корня зависит в основном от интенсивности и характера поглощения макроэлементов, поскольку они потребляются растением в намного больших количествах, нежели микроэлементы. Среди макроэлементов, азот играет первую роль в балансе зарядов, поскольку он может поглощаться и как анион (NO3-), и как катион (NH4+), и поглощается в намного большем количестве, нежели другие ионы. Когда растения поглощают больше азота в виде нитрата, в ответ корни выделяют ОН- и НСО3- в почву для поддержания баланса заряда, что создает эффект, известный как физиологическая щелочность (основность). И наоборот, если корни поглощают больше азота в виде аммония (NH4+), они выделяют Н+ для поддержки баланса зарядов, что создает физиологическую кислотность.
А так как большинство элементов питания поглощается растениями в виде катионов (за исключением некоторых элементов, например, азота, бора или молибдена), то большинство удобрений являются физиологически кислыми.
Во-вторых, удобрения, содержащие аммоний, могут образовывать Н+ в почве при превращении аммония в нитраты под влиянием почвенных микроорганизмов (нитрификация).
Таким образом, химически нейтральная соль, например, Ca(NO3)2 оказывается физиологически щелочной, тогда как химически щелочная соль, например, (NH4)2HPO4 будет физиологически кислой.
В общих чертах, влияние азотных удобрений на изменения рН почвы зависит от формы азота. Так, удобрения, содержащие азот в форме аммония, в результате прохождения процесса нитрификации, оказывают подкисляющее действие на почву (если нет достаточного количества оснований, способных нейтрализовать эту кислотность).
Азотные удобрения, содержащие азот в виде нитратов в сочетании с основаниями (Na, Ca), после поглощения растениями азота будут снижать кислотность почвы (физиологические щелочные удобрения). Но происходит это, только если нитратный азот поглощается растением. Если же растения малы, или находятся в стрессе и не растут, нитраты мало влияют на рН субстрата.
Что же касается аммонийно-нитратных удобрений, то аммонийный азот создает приблизительно в три раза более сильное подкисляющее действие, нежели нитратный азот – подщелачивающее. Например, если удобрение содержит около 25% аммонийного азота и 75% нитратного, то реакция на рН почвы будет близка к нейтральной.
При внесении безводного аммиака в почву, он реагирует с почвенной водой и превращается в аммоний, который имеет щелочную реакцию и временно повышает рН почвы. Однако, по мере нитрификации аммония, почвенный раствор подкисляется. Эти две реакции (подщелачивания и подкисления) не сбалансированы полностью, но стремятся к балансу, что в результате оказывает на почву слабое подкисляющее действие.
Карбамид при внесении в почву под влиянием фермента уреазы превращается в бикарбонат аммония, чем вызывает временное подщелачивание почвенного раствора (т.к. бикарбонат-анион реагирует с почвенным Н+ с образованием H2CO3, диссоциирующего на CO2 и H2O, и на аммоний-катион), а в последствии подкисляет в результате нитрификации аммонийного азота. В сумме, карбамид оказывает только слабое подкисляющее действие на почву.
Фосфорные удобрения способны влиять на почвенную кислотность, преимущественно за счет высвобождения или связывания ионов Н+ в зависимости от рН почвы. Изменения рН имеют, как правило, локальный характер и более заметны при локальном внесении удобрений.
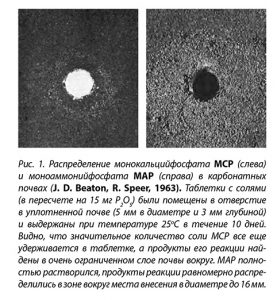
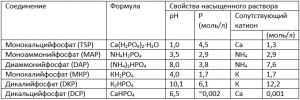
Из таблицы видно, что насыщенный раствор, образуемый группой водорастворимых фосфорных удобрений, имеет рН в диапазоне от 1,0 до 10,1 и содержит 1,7-6,1 моль/л фосфора. Концентрация сопутствующих элементов колеблется от 1,3 до 12,2 моль/л.
Таблица 1. Состав и свойства насыщенных растворов фосфорных соединений, обычно присутствующих в удобрениях (Источник: Sample et al., 1980)
Несмотря на низкое значение рН насыщенного раствора суперфосфата, он не имеет постоянного эффекта на реакцию почвы, поскольку в нем кислото- и щелочьобразующие элементы питания нейтрализуют друг друга, а кислотность обусловлена в первую очередь свободной кислотой (остающейся в процессе производства). Большинство результатов, полученных в длительных полевых экспериментах, показали, что суперфосфат либо немного уменьшает, либо вовсе не имеет влияния на рН почвы. Аммонизированный суперфосфат имеет слабокислую реакцию (как результат присутствия аммония), которая зависит от степени, до которой суперфосфат аммонизируют.
Влияние фосфатов на рН почвы зависит в большой степени от природной кислотности самой почвы. Так, для МАР (аммофос) в почвах с рН>7,2 ион дигидрофосфата Н2РО4- диссоциирует с образованием свободного Н+, который и оказывает подкисляющее влияние на таких почвах:
Н2РО4- → НРО42- + Н+.
В кислых почвах фосфор присутствует в виде Н2РО4- и подобных превращений не происходит, поэтому на почвах с рН