Mse-Online.Ru
Реакция почвы
Почва обладает определенной реакцией, которая проявляется при взаимодействии с водой или растворами солей. Реакция почвы может быть нейтральной, кислой или щелочной. Эти свойства почвы имеют чрезвычайно важное значение для роста и развития растений, так как каждый вид растений лучше всего развивается при определенной реакции почвы.
Кислотность почвы — одно из важных ее свойств, обусловленное определенной концентрацией водородных ионов. Источник кислотности почвы — органические кислоты, образующиеся при распаде растительных остатков и вымывающиеся в нижние горизонты. Среди этих кислот наиболее распространены перегнойные кислоты и прежде всего — креновые.
В зависимости от направления и развития почвообразовательного процесса в отдельных типах и разностях почв кислотность проявляется по-разному. Если в почвенном растворе имеются ионы кальция и противодействие повышению кислотности почвы высокое, вредное действие кислотности почвы уменьшается, а если раствор содержит ионы алюминия, железа и марганца, ее токсичность для растений и почвенных микроорганизмов увеличивается.
Высокая кислотность всегда отрицательно влияет на микробиологические процессы в почве и на развитие растений. Если реакция почвы очень кислая (подзолистые почвы), то в почвенном растворе кроме водорода находятся ионы алюминия, высокая концентрация которых также отрицательно влияет на развитие растений. Особенно чувствительны к кислой реакции клевер, пшеница, лен, свекла.
Кислая реакция почвы затрудняет усвоение растениями азота, кальция, магния и способствует поступлению в них алюминия и марганца. В растениях, которые растут на кислых почвах, задерживается превращение моносахаридов в дисахариды и другие сложные соединения, нарушаются процессы образования белков и обмена.
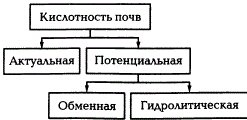
Различают актуальную, или активную, и потенциальную, или пассивную, кислотность почв.
Актуальная кислотность обусловливается наличием ионов водорода в почвенном растворе, а потенциальная — водородных ионов и ионов алюминия в почвенном поглощающем комплексе. Актуальную кислотность почвенного раствора обусловливают в основном растворимые органические кислоты, которые образуются в почве в результате биохимических процессов.
В ряде случаев отрицательное действие кислой реакции связано с подвижностью ионов алюминия, который токсичен для растений, особенно при низком рН.
Условным общим показателем кислотности почвы является кислотность почвенного раствора — рН, которая зависит от содержания в почве свободных кислот и обменных ионов водорода. Сельскохозяйственные растения лучше всего развиваются при рН от 5,5 до 7,5. Величина рН наиболее распространенных типов почв колеблется в пределах от 3 до 9, в зависимости от чего почвы делятся на такие группы: очень кислые — рН 3—4, кислые — рН 4—5, слабокислые — рН 5—6, нейтральные — рН 6—7, щелочные — рН 7—8, сильно щелочные — рН 8—9.
Почва с рН 6,5—7 практически нейтральна.
Потенциальную кислотность можно определить, если выделить из поглощающего комплекса поглощенные ионы водорода. В зависимости от того, какими солями определяют потенциальную кислотность, ее разделяют на обменную и гидролитическую.
Обменная кислотность обусловливается наличием в ППК водорода и алюминия, которые вытесняются из почвы под действием нейтральных солей. Обменную кислотность обозначают так же, как и активную, но с обязательным указанием, что это рН солевой вытяжки. Обменная кислотность сильно кислых почв равна 4,5, кислых — 4,6—5,5, слабокислых — 5,6—6, близких к нейтральным — 6,1—6,5, нейтральных — 7. Обменную кислотность можно также определять в миллиграмм — эквивалентах суммы водорода и алюминия на 100 г почвы.
Гидролитическая кислотность — это количество ионов водорода, которые вытесняются из почвы водным раствором солей слабых кислот и сильных щелочей. Обычно для этой цели применяют уксуснокислые соли — ацетат натрия или кальция.
Величина гидролитической кислотности в разных почвах бывает от 0,1 до 10 мг-экв и более на 100 г почвы. В обыкновенных черноземах гидролитической кислотности практически нет, реакция их нейтральная, тогда как в черноземах оподзоленных и серых лесных почвах она иногда достигает 3 мг-экв и более на 100 г почвы. Самая высокая гидролитическая кислотность в некоторых торфяных горизонтах болотных почв и их разностей. Обычно гидролитическая кислотность почвы больше, чем обменная. Она практически является общей кислотностью почвы, потому что при определении ее учитываются как активная, так и обменная формы.
Знание кислотности почвы имеет большое практическое значение для определения потребности почвы в известковании. Чаще всего пользуются данными гидролитической кислотности. Если она составляет 1—2 мг-экв, то нет потребности в известковании почв, а если почва имеет большую кислотность, то ее нужно обязательно известковать. Слабоподзолистые песчаные почвы известкуют даже при гидролитической кислотности менее 2 мг-экв на 100 г почвы.
При известковании почв кроме гидролитической кислотности учитывают степень насыщенности основаниями и актуальную кислотность. В известковании нуждаются все почвы с рН 8. Такая реакция неблагоприятная для большинства сельскохозяйственных культур.
Повышенная щелочность в почве не только вредна для развития растений, но и усиливает пептизацию коллоидов, вследствие чего резко ухудшаются физические свойства и водный режим почв.
В зависимости от содержания обменного натрия (в % к сумме поглощенных оснований) различают такие почвы: свыше 20 % — солонцы, 10—20 — солонцеватые, 5—10 — слабосолонцеватые, менее 5 % — несолонцеватые.
Почвы, в водном растворе которых есть растворимые соли натрия (в основном хлориды, сульфаты и карбонаты), называются солончаками. Обычно в составе таких почв есть также растворимые соли кальция и магния.
Источник
Гидролитическая кислотность.
Реакция почвы имеет большое значение для развития растений и почвенных микроорганизмов, оказывает влияние на скорость протекания биологических и физиологических процессов.
Она создается наличием ионов H + в почвенном растворе и ППК (почвенно-поглощающем комплексе). Почвенная кислотность бывает: актуальной (активная) и потенциальной (скрытая). Потенциальная делится на обменную и гидролитическую.
Гидролитическая кислотность (Нг) почвы образуется при действии гидролитически щелочной соли (CH3COONa – уксуснокислый натрий) на почвенный поглощающий комплекс. Выщелоченные и оподзоленные черноземы имеют гидролитическую кислотность. Определение данной кислотности важно при решении задач, связанных с применением удобрений, известкованием, фосфоритованием почв и другими агрохимическими приемами. Вредна ли Нг для растений? Если в почве присутствует ещё и обменная кислотность, то да – вредна, а если обменная кислотность отсутствует, то нет и почвы известковать не надо.
8.Ёмкость поглощения и состав поглощенных катионов. Буфферность почв и степень насыщенности почв основаниями.
Сумма поглощенных оснований (S) показывает сколько катионов в поглощенном состоянии содержит почва и она зависит от рН, количества и качества коллоидных фракций почвы.
Т=S+Hг (сумма поглощенных оснований +гидролитическая кислотность)
Т-ёмкость поглощения почвы.
Большим Т обладают глинистые почвы, меньшим -песчаные.
Почвы, содержащие в ППК Ca, Mg, K, Na –насыщенные основаниями.
Почвы, содержащие Al 3+ , H + – ненасыщенные (кислые, дерновоподзолистые). От состава поглощенных катионов зависит свойства почвы и условия роста растений.
Степень насыщенности почв основаниям (V) определяют по формуле:
V=S/T*100%
Величина V важный показатель для характеристики поглотительной способности почв и кислотности. Ее (V) определяют для установления очередности известкования.
По этому показателю почвы делятся на 3 гр.:
1-V 70 почва не известкуется.
Буферность – способность почвы противостоять изменению реакции почвенного раствора в сторону подкисления или подщелачивания. Она зависит от количествава и качества органического вещества, т.к. карбоксильные группы противостоят подщелачиванию, а аминогруппы — подкислению. Также буферная способность зависит от содержания и состояния ППК, т.е.от (S).
Химическая мелиорации почв. Значение известкования кислых почв. Известковые материалы.
Мелиорация-это прием, основанный на внесении в почву извести и гипса, при этом изменяется состав поглощенных катионов, главным образом путем введения Са в ППК. Действие извести на свойства почвы:
— нейтрализует почвенную кислотность
-устраняет токсичное действиеAl,Fe,Mg,переводя их в нерастворимую форму;
— Ca,внесенный с известью коагулирует почвенные коллоиды при этом улучшается структура почвы, водопрочность почвенных агрегатов
— почва обогащается кальцием, что хорошо сказывается на корневой системе.
-улучшается жизнедеятельность клубеньковых и свободноживущих бактерий.
-усиливается минерализация органического вещества и процессы нитрификации.
Известь вносят для устранения почвенной кислотности. Ее можно устранить гашенной известью, углекислым кальцием, которые не растворимы в воде. При внесении полной дозы извести устраняется актуальная и обменная кислотности. Известковые материалы делят на 3 группы:
1.твердые, которые требуют размола или обжига (известняки, содержащиеие CaO 55-56%; известняки доломитизированные CaO 42-55% MgO 9,4%; доломиты CaO32-34%; MgO 18-20%)
— ключевая известь CaCO3-90-98%
— гожа CaCO3 80-95%
3.Отходы промышленности:сланцевая зола;дефекат-отход сах.заводов.;шлаки-доменные и мартеновские.
Источник
Кислотность почв
Кислотно-щелочная характеристика, или реакция, — это способность почв проявлять свойства кислот и щелочей при взаимодействии с водой или растворами солей. Мерой реакции почв является соотношение в почвенном растворе водородных (Н + ) и гидроксильных (ОН — ) ионов. Реакция почв характеризуется величиной pH — отрицательным логарифмом активности водородных ионов в растворах. Почвы могут иметь кислую (pH 7) реакцию.
Различают два вида почвенной кислотности: актуальную и потенциальную, которая в свою очередь подразделяется на обменную и гидролитическую.
Виды кислотности почв
Актуальной кислотностью называется кислотность почвенного раствора. Она измеряется при взаимодействии почвы с дистиллированной водой (pHH2O). Актуальная кислотность зависит от наличия в почвенном растворе свободных органических и минеральных кислот (главным образом, угольной кислоты). Актуальная кислотность в почвах проявляется в диапазоне pH от 3 до 7.
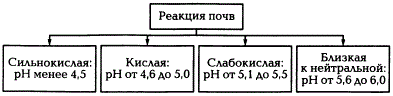
Обменная кислотность обусловлена наличием в ППК обменных водорода и алюминия и определяется путем вытеснения ионов Н + и Аl 3+ раствором нейтральной соли КСl. Степень кислотности оценивают по величине pH солевой вытяжки. Обменная кислотность всегда больше актуальной. В почвах с ППК, насыщенны основаниями, обменная кислотность не определяется. Наиболее сильно она выражена в подзолистых почвах и краснозёмах. Существует четыре градации потенциальной кислотности почв, характеризуемой рНКСl.
Градации кислотности почв
Гидролитическая кислотность определяется путем воздействия на почву гидролитически щелочной соли. При взаимодействии почвы с солью происходит более полное вытеснение из ППК обменных водорода и алюминия. Для определения гидролитической кислотности принято использовать 1,0 н. раствор CH3COONa. Он выражается в мг-экв на 100 г почвы.
По величине гидролитической кислотности (Н) находят необходимую для известкования почвы дозу извести и рассчитываю степень насыщенности почвы основаниями (V, %):
где S — сумма поглощенных оснований.
Почвы, обладающие кислотностью, распространены очень широко в бореальном поясе, а также в условиях влажных субтропиков и тропиков.
В Российской Федерации в конце XX в. кислые почвы занимал 51 млн га сельскохозяйственных угодий, в том числе 43 % всей пашни. Среди них преобладают сильно- и среднекислые почвы (рНКСl менее 5,0), площадь которых составляла 28 млн га. Во многих странах площади, занятые кислыми почвами, увеличиваются, и растет степень их кислотности. Причин тому несколько. Одна из них — внесение минеральных, часто физиологически кислых удобрений, не сопровождаемое необходимым известкованием.
Для многих, особенно промышленных, регионов характерно выпадение кислых и даже сильнокислых дождевых осадков с pH примерно 4,0—4,5, содержащих серную и частично азотную кис-лоты. Кислые дожди служат дополнительным фактором ускорения развития кислотности почв. В Нечерноземной зоне РФ потери СаCO3 в результате антропогенного подкисления почв достигают 400—450 кг/га в год.
Негативное влияние повышенной кислотности на растения обусловлено несколькими причинами, среди которых наибольшее значение имеют следующие:
- недостаток Са 2+ — необходимого для растений элемента питания;
- повышенная концентрация ионов Аl 3+ , Мn 2+ , Н + ;
- изменение доступности растениям макро — и микроэлементов питания;
- изменение физических свойств почвы.
От величины pH зависят подвижность и доступность растениям практически всех элементов питания. Усвояемость фосфора максимальна при pH = 6,5, снижаясь как в более кислой, так и в щелочной среде. Только в сильнощелочных почвах при pH около 9 и выше растворимость фосфатов вновь возрастает.
В кислых почвах повышается растворимость соединений железа, марганца, алюминия, бора, меди, цинка. При избытке этих элементов продуктивность растений снижается. В то же время высокая кислотность понижает доступность такого важного микроэлемента, как молибден.
Оптимальный интервал pH связан не только с растворимостью почвенных компонентов, но и с физиологическими особенностями возделываемых культур. Для одних растений оптимум pH лежит в интервале 4,0 — 5,0 (чайный куст, клюква), для других — от 6,0 до 8,0 (вишня, груша, орех грецкий, слива, яблоня). Для снижения поденной кислотности в качестве химических мелиорантов используют различные материалы. Наиболее употребительны осадочные породы, состоящие преимущественно из кальцита, доломита СаМn(СO3)2, доломитизированные известняки, мергели. Кроме того, применяют известковые туфы и различные промышленные отходы: дефекат (отход свеклосахарного производства), другие шлаки. В большинстве мелиорантов действующим веществом является СаСО3.
С химической точки зрения карбонат кальция является лучшим средством для снижения почвенной кислотности.
При внесении карбоната кальция в кислую почву происходят реакции:
В результате этих реакций создаются наиболее благоприятные условия: почвенный поглощающий комплекс насыщается кальцием, а в почвенном растворе образуется слабая угольная кислота.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник