Актуальная активная и потенциальная кислотность почв. Изменение почвенной реакции. Известкование кислых почв
Различают актуальную (активную) и потенциальную кислотность почв в зависимости от того, при каком взаимодействии она проявляется и измеряется.
Актуальная кислотность почвы обусловлена наличием водородных ионов (протонов) в почвенном растворе, активность которых зависит от свойств (ионной силы) раствора, влияющих на коэффициент активности иона. Актуальная кислотность почвы измеряется при взаимодействии почвы с дистиллированной водой [водный рН, рНн2о, рН (Н20)] при разбавлении 1:2,5 либо в пасте. Иногда рН почвы измеряют непосредственно в почве при естественной влажности, но для этого она должна быть достаточно увлажненной и гомогенной для обеспечения надежного контакта с измерительным электродом. Можно актуальную кислотность почвы измерять и колориметрически или путем титрования.
Потенциальная кислотность — способность почвы при взаимодействии с растворами солей проявлять себя как слабая кислота. Потенциальная кислотность определяется свойствами твердой фазы почвы, обусловливающей появление дополнительного количества протонов в растворе при взаимодействиях с удобрениями или химикатами.
Кислая реакция солевых вытяжек из почв объясняется появлением в растворе ионов водорода (гидроксония Н30 + ) в результате вытеснения из почвенного поглощающего комплекса, а также взаимодействия с водой молекулярных кислот и гидратиро- ванных катионов. Гидратированные катионы при этом можно рассматривать как кислоты (Бренстед — Лоури). Наиболее сильные кислотные свойства в воде проявляют двух- и особенно трехзарядные катионы металлов
В зависимости от характера взаимодействующего с почвой раствора различают две формы потенциальной кислотности почв — обменную и гидролитическую, характеризующиеся как последовательные этапы выделения в раствор дополнительных количеств протонов из твердой фазы.
Обменная кислотность обнаруживается при взаимодействии с почвой растворов нейтральных солей. При этом происходит эквивалентный обмен катиона нейтральной соли на ионы водорода, алюминия и другие, находящиеся в поглощающем комплексе. Обычно для определения обменной кислотности почв используют 1 н. раствор КС1 (рН около 6,0).
Природа обменной кислотности зависит от состава и свойств почвенных коллоидов. Кислотность органических почвенных коллоидов (гумусовые кислоты) обусловлена главным образом обменным водородом, причем непосредственным источником обменного водорода служат органические кислоты, включая гумусовые, и угольная кислота. При взаимодействии с коллоидами водород этих кислот внедряется в их диффузный слой, занимая место оснований, которые выщелачиваются или выпадают в осадок
Кислотность минеральных коллоидов связана с наличием в почвенном поглощающем комплексе обменных ионов водорода, алюминия или железа. Источником обменных алюминия и железа служат ионы кристаллической решетки глинистых минералов и гидроксидов, мобилизуемые органическими кислотами или присутствующие в почвенном растворе и также внедряющиеся в диффузный слой почвенных коллоидов.
При взаимодействии кислой почвы с раствором хлорида калия в результате обмена калия на водород в растворе появляется соляная кислота, а при обмене на алюминий — хлорид алюминия (III)
Образующаяся в растворе кислота оттитровывается щелочью (кислотность выражается в мг-экв/100 г) или определяется по рН раствора, который в данном случае характеризуется как солевой рН,рНКС1, рН(КС1) По значениям рН можно ориентировочно определить роль различных ионов в образовании кислотности При рН меньше 4,0 кислотность обусловлена главным образом обменным водородом, при рН от 4,0 до 5,5 — обменным алюминием
В кислых почвах (подзолистые, серые лесные, красноземы) солевой рН всегда меньше, чем водный рН, поскольку в этих почвах имеется обменный водород и (или) алюминий Для насыщенных основаниями почв солевой рН не определяется
Гидролитическая кислотность обнаруживается при воздействии на почву раствора гидролитически щелочной соли сильного основания и слабой кислоты, при котором происходит более полное вытеснение поглощенных водорода и других кислотных ионов Для определения гидролитической кислотности обычно используют 1 и раствор CH3COONa с рН 8,2 При взаимодействии уксуснокислого натрия с почвой могут происходить реакции в зависимости от содержания в ней алюминия или водорода, аналогичные приведенным выше
Количество образующейся уксусной кислоты, определяемое титрованием, характеризует гидролитическую кислотность почвы
При наличии в почве обменного алюминия образующийся в результате обменной реакции уксуснокислый алюминий распадается на гидроксид алюминия и уксусную кислоту
Так как нейтральная соль вытесняет лишь часть поглощенного водорода, а гидролитически щелочная соль — почти весь, то гидролитическая кислотность обычно больше обменной Иногда гидролитическая кислотность оказывается меньше обменной за счет поглощения почвой анионов уксусной кислоты и вытеснения ионов ОН , в результате чего уменьшается кислотность вытяжек.
Наличие потенциальной кислотности характерно для почв, обедненных основаниями (Са2+, Mg2+ и др.). Чем больше почва обеднена основаниями, тем резче проявляет она кислотные свойства.
В природе распространение кислых почв связано с определенными условиями почвообразования (подзолистые, бурые лесные, красноземы, желтоземы). Большое значение в образовании почв с той или иной реакцией имеет характер почвообразуюгцей породы. Подзолистые почвы, бедные основаниями, в основном приурочены к выщелоченным, бескарбонатным породам. Характер почвообразовательного процесса откладывает существенный отпечаток на формирование реакции почв. В одних случаях этот процесс приводит к потере оснований и подкислению (подзолистый процесс), в других — наблюдается постепенное обогащение почвы основаниями (дерновый процесс). Большое значение в формировании кислых почв имеют кл и магические условия. Промывной характер водного режима приводит к выносу солей из почвы, способствует выходу в раствор поглощенных С а2 , Mg2+ в обмен на водородные ионы и их последующему выщелачиванию. Растительность также оказывает влияние на характер почвенной реакции. Хвойные леса и сфагнум способствуют усилению кислотности благодаря кислым свойствам их органических остатков; лиственные леса и травянистая растительность благоприятствуют накоплению оснований.
Сельскохозяйственная деятельность человека вызывает изменение почвенной реакции. Само отчуждение урожаев с полей приводит к постепенному обеднению почв элементами, входящими в состав растений, в том числе и основаниями. Длительная обработка почвы в условиях зоны подзолистых почв способствует обеднению ее Са2+ и Mg2+. Снизить рН почвы может и внесение физиологически кислых минеральных удобрений.
Кислая реакция почв неблагоприятна для большинства культурных растений и полезных микроорганизмов. Кислые почвы обладают плохими физическими свойствами. Из-за недостатка оснований органическое вещество в этих почвах не закрепляется, почвы обеднены питательными веществами. Степень отрицательного влияния кислой реакции почв на растения зависит от того, какой элемент является причиной почвенной кислотности — водород или алюминий. Алюминий оказывает на растения более сильное токсическое действие, чем водород. Так, при повышении содержания обменного алюминия до 10—12 мг/100 г наблюдается выпадение клевера в посевах. Опытами Н. С. Авдонина показано, что наличие в кислых почвах обменного алюминия служит причиной гибели посевов озимых зерновых культур при перезимовке.
Доля участия в почвенном поглощающем комплексе обменных катионов водорода и алюминия, определяемых как обменная или гидролитическая кислотность, характеризует ненасыщенность почв основаниями
Степень насыщенности почв основаниями — это количество обменных оснований (обычно Ca2 + + Mg2 + ), выраженные в процентах от емкости поглощения
K=S/Е- 100=S/(S+#> • 100, (40)
где V — степень насыщенности основаниями, %, S — сумма обменных оснований, мг-экв/100 г, Е — емкость поглощения, мг- экв/100 г, Н— гидролитическая кислотность, мг-экв/100 г
Таким образом, ненасыщенность почв основаниями характеризуется разностью между емкостью поглощения при избранном значении рН и содержанием в почве обменных оснований
Основным методом повышения продуктивности кислых почв, снижения их кислотности служит известкование
При внесении извести СаС03 при наличии избытка углекислоты переходит в растворимый Са(НС03)2, который взаимодействует с почвой по следующей схеме
]2Н + + Са(НС03)2 —> [ППК2 ] Са2++ 2Н20 + 2С02
Почвы с высокой степенью насыщенности не нуждаются в известковании Путем сопоставления степени насыщенности почв с отзывчивостью на известкование в полевых опытах установлена следующая примерная шкала
Обычно доза извести рассчитывается по гидролитической кислотности пахотного слоя почвы
При плотности почвы 1,3 г/см3 ее масса в 20-сантиметровом пахотном слое на 1 га составляет 2600 т При этом каждый 1 мг-экв гидролитической кислотности на 100 г почвы требует для нейтрализации 1,3 т СаС03 на 1 га Однако обычно используется не полная доза извести, рассчитанная по гидролитической кислотности, а лишь какая-то часть ее, определяемая в соответствии со свойствами выращиваемых культур
Дозу СаС03 для известкования кислых почв определяют и по обменной кислотности, показателем которой служит солевой рН, в соответствии со следующими критериями, приведенными в табл 37
Таблица 37. Дозы извести в зависимости от рН солевой суспензии и гранулометрического состава почвы (в т/га)
Гранулометрический рН солевой суспензии
4,5 и ниже 4,6 4,8 5,0 5,2 5,4-5,5
Супеси и легкие суглинки 4,0 3,5 3,0 2,5 2,0 2,0
Средние и тяжелые суглинки 6,0 5,5 5,0 4,5 4,0 3,5
Источник
Активная кислотность почвы
Способность почвы подкислять растворы нейтральных солей и воды называют кислотностью. Форм кислотности может быть две – потенциальная и активная.
Кислотность почвенного раствора называют активной кислотностью. В растворе количество ионов водорода увеличивается, если кислоту растворить в воде. Символ рН используют для обозначения концентрации этих ионов, чтобы упростить расчеты. Это отрицательный логарифм концентрации. Почвенный раствор может быть кислотным из-за нескольких источников. Прежде всего, это образующиеся в результате жизнедеятельности растений и микроорганизмов минеральные и органические кислоты. Речь идет о серной, азотной, яблочной, молочной, щавелевой и других кислотах. Крайне редко можно встретить в почве сильные кислоты, так как с катионами почвенных коллоидов идет постоянный обмен. В итоге образуются соли магния, кальция и прочих.
В определенной степени при этом остаются свободными малодиссоциирующие слабые органические кислоты, однако в почве их количество незначительно. Угольная кислота присутствует в почве в большом количестве. Она образуется во время окислительных процессов и является продуктом дыхания живых организмов. Кислотность почвенного раствора в значительной степени зависит именно от нее.
Разложение органических остатков вызывает образование фульвокислоты. Она также является важным источником кислотности почвы. Минеральные удобрения тоже могут повышать кислотность почвы. Благодаря им добиваются нужных показателей на пашнях, засеиваемых требовательными к кислотности культурами.
Источник
Показатель pH почвы (как определить кислотность почвы)
Большинство растений предпочитают слабокислые и нейтральные почвы. Но если грунт сильнокислый или щелочной, выращивать на нем даже неприхотливые растения сложно. Для определения кислой, нейтральной или щелочной среды почвы используют показатель pH.
Содержание
Показатель pH — специальный показатель, отражающий кислотно-щелочной баланс почвы. В этом материале даны понятия что такое показатель pH, какие типы почвы (от слабокислой до сильнощелочной) соответствуют численным значениям показателя рН, а также способы для его определения или измерения.
ЧТО такое показатель pH почвы
Кислотность показывает концентрацию ионов водорода, определяющих кислотно-щелочной баланс грунта. Для этого есть показатель pH. Показатель, отражающий кислотно-щелочной баланс почвы, раствора или другой среды. Измеряется в единицах от 0 до 14 (см таблицу):
| Значение показателя pH | Характеристика |
| 0 … 6,9 | среда кислая (преобладают кислоты) |
| 7,0 | среда нейтральная (кислоты и щелочи нейтрализуют друг друга). |
| 7,1 … 14 | среда щелочная (преобладают щелочи). |
| Примечание: а) чем больше pH: тем меньше кислотность почвы; тем больше щелочность почвы. б) чем меньше pH: тем больше кислотность почвы; тем меньше щелочность почвы. |
Показатель pH почвы (его численное значение) чаще всего колеблется в диапазоне 3,5-8,5.
Типы почвогрунтов, в зависимости от показателя pH принято разделять на следующие типы (см. таблицу):
| Значение показателя pH | Тип почвы |
| менее 4 | сильнокислая |
| 4 … 5 | среднекислая |
| 5 … 6 | слабокислая |
| 6 … 7 | нейтральная |
| 7 … 8 | слабощелочная |
| 8 … 8,5 | среднещелочная |
| более 8,5 | сильнощелочная |
Также принято различать два типа кислотности — актуальную кислотность (отражает реальное состояние, сколько сейчас в почве есть ионов водорода) и потенциальную кислотность (потенциально возможное состояние):
- АКТУАЛЬНАЯ определяет присутствие в почве ионов водорода: чем их больше, тем выше кислотность (соответственно, тем меньше значение pH).
- ПОТЕНЦИАЛЬНАЯ определяет присутствие в почве обменно поглощенных ионов водорода и других частиц – марганца, железа, алюминия.
Всем садоводам и огородникам следует ориентироваться ТОЛЬКО на актуальную кислотность, которая измеряется химическими индикаторами, приборами и другими способами. Далее рассмотрим как определить показатель pH почвы.
КАК определить показатель pH почвы (кислотность почвы)
Способов определения множество – это и «народные» (с использованием уксуса или лакмусовой бумаги), и современные (с применением электронных приборов pH-метров/ кислотомеров).
Самые распространенные способы определения кислотности почвы:
- Лакмусовой бумагой;
- Измерительные приборы pH-метры;
- Визуальный способ (по растениям-маркерам);
- С помощью уксуса;
- Заказ исследование почвы в лаборатории.
а) Лакмусовая бумага
Показатель pH почвы определяется по цвету бумаги. Лакмусовая бумага есть в продаже в любом садовом центре.

б) Измерение pH-метром (кислотомером)
Для определения кислотности разработаны и внедрены в производство целый ряд pH-метров (кислотомеров) – специальных портативных приборов, позволяющих определять не только кислотность, но и другие ключевые показатели почвы – влажность, температуру, освещённость и пр.
pH-метр — это прибор для измерения водородного показателя, характеризующего активность ионов водорода в растворах/средах (почва, вода, пищевая продукция и сырье, объекты производственных системах, в том числе в агрессивных средах). Действие pH-метра основано на измерении величины ЭДС электродной системы, которая пропорциональна активности ионов водорода в растворе — pH (водородному показателю).
Для использования в ЛПХ и в сельскохозяйственном производстве выпускается широкий ряд простых в применении электронных или электронно-механических pH-метров. Популярность их из года в год растет. Это самый точный и актуальный на сегодня способ определения кислотности почвы.

в) Визуальный способ
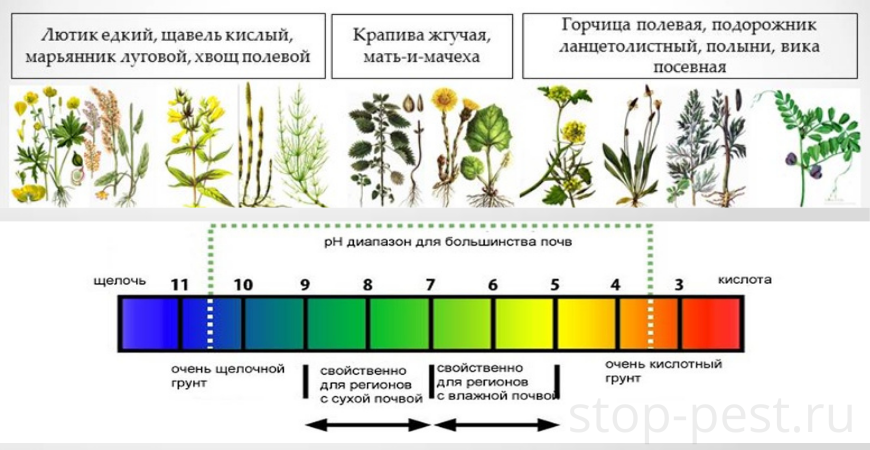
В данном случае речь идет по определению кислотности почвы по растениям – маркерам. Например, если на участке хорошо растет щавель и хвощ, то почва кислая, а если мак и вьюнок – щелочная.
| Значение pH | Тип почвы | Растения-маркеры |
| менее 4 | сильнокислая | растений нет, на верхнем слое бархатистый зеленый налет |
| 4 … 5 | среднекислая | подорожник, дикий щавель, мята дикая, хвощ, фиалка и др. |
| 5 … 6 | слабокислая | папоротник, ромашка, пырей, одуванчик, сныть обыкновенная, клевер, мать-и-мачеха и др. |
| 6 … 7 | нейтральная | мокрица, лебеда, пастушья сумка, |
| более 7 | щелочная | мак, вьюнок, дрема белая |
г) С помощью уксуса
В плоскую емкость помещается небольшое количество почвогрунта. Затем заливается 6% раствором уксуса. По реакции определяем кислотность почвы:
- реакции нет, то почва кислая;
- реакция слабая (мало пузырьков) — почва слабокислая или близкая к норме;
- реакция бурная — значит, щелочная среда.
д) Заказать исследование почвы в лаборатории
Раскисление почвы
Раскисление почвы – единственный способ поднять ее рН до нужной отметки (т. е. до 5,0 и выше). Раскисление почвы процесс не сложный, но требует определенных знаний. Процесс не быстрый, около полугода. Осень самое благоприятное время, чтобы к весне кислотно-щелочной баланс почвы был на оптимальном уровне.
Для раскисления используют следующие способы/материалы:
Источник

