Современный подход к культивированию микроорганизмов и культур клеток
Большинство научных исследований в области биологии и медицины проводятся не на живых организмах, а «в пробирке». Клеточные культуры и культуры микроорганизмов являются наиболее простым и удобным модельным объектом, позволяющим как тестировать на них воздействие извне, так и исправлять ошибки внутри клетки. Благодаря исследованиям в области клеточного редактирования постепенно становится возможным лечение многих генетических заболеваний. Но каким образом мы можем добиться культуры, максимально соответствующей требованиям к модели для сложных экспериментов? Рассмотрим наиболее популярные современные способы выращивания микроорганизмов и культур клеток.
Общее понимание культивирования
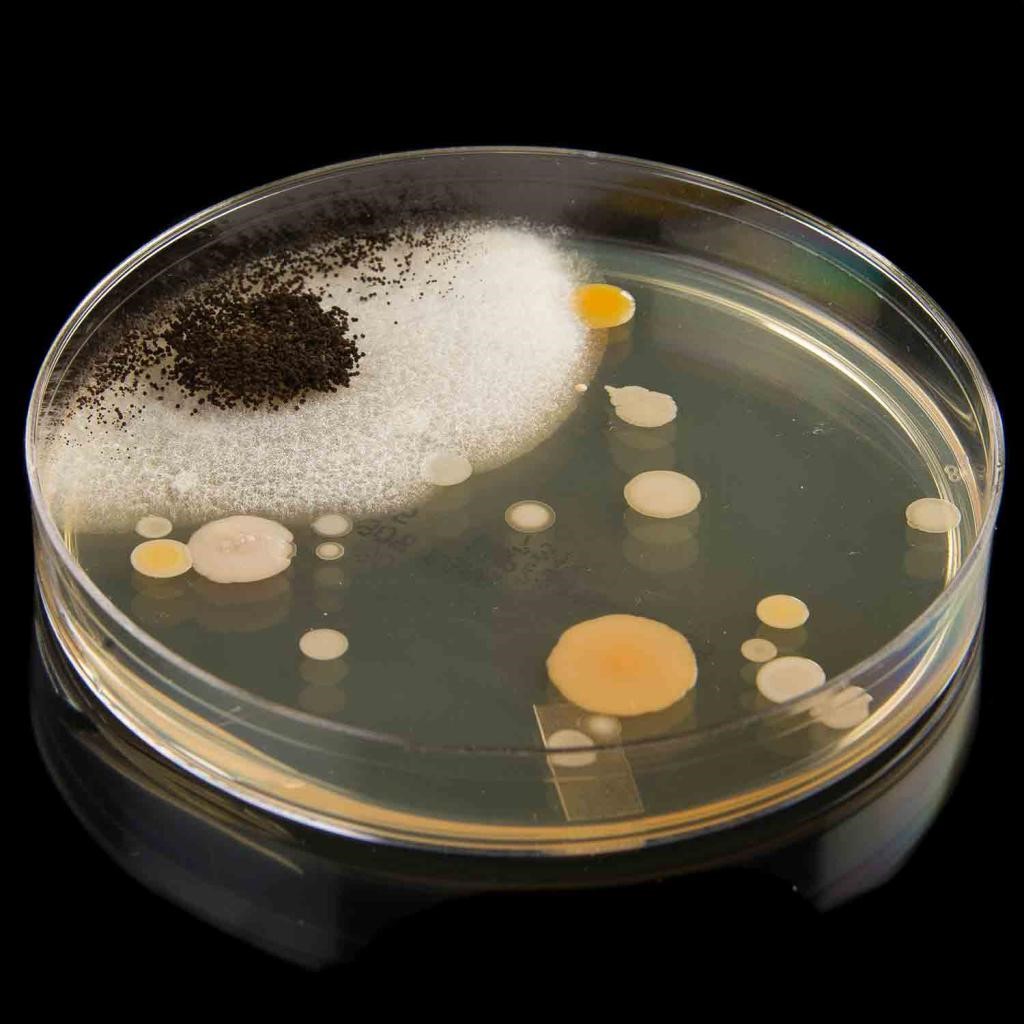
Культивирование как микроорганизмов, так и отдельных клеток – это выращивание изъятого из определенной среды материала в лабораторных условиях. Выращенная таким образом подборка единообразных микробов или клеток уже может называться культурой.
Для того, чтобы выращивание прошло успешно, требуется наличие определенного оборудования, а также соблюдение условий, необходимых для роста и созревания культуры. Стандартно для культивирования используются:
- Питательная среда, на которой будущая культура должна расти.
- Факторы роста – питательные вещества, используемые клетками.
- Посуда, включающая в себя стерильные чашки Петри, инструменты для переноса клеток на среду и др.
- Дополнительное оборудование: термостаты, аппараты для ферментации и другие.
Также в процессе культивирования от лаборатории требуется соблюдение условий роста для каждой конкретной культуры. Ввиду того, что как клетки, так и микробы, требуют для себя условий, приближенных к естественным, в лаборатории должны поддерживаться различные условия роста при наличии разных культур. Основные условия: приемлемая для культур температура, влажность, давление, постоянная подача кислорода (для аэробных бактерий) или исключение доступа к кислороду (для анаэробных). (Рекомендуем статью: «Флуоресцентная микроскопия»)
Факторы роста
Факторами роста называют все питательные вещества, которые требуются бактериям и клеткам для оптимального роста и развития. В случае если сама среда не обладает достаточным количеством нужных элементов, их добавляют извне. При этом количество строго регулируется в зависимости от требований к конечной культуре.
К наиболее часто использующимся в современном лабораторном культивировании факторам роста относятся:
- Аминокислоты. Отдельным микроорганизмам или группам клеток требуются дополнительные аминокислоты извне. При этом требоваться может только одна кислота, например, лейцин и аргинин для стрептококков.
- Пуриновые или пиримидиновые основания. Также используются и их производные (аденин, гуанин и др.).
- Витамины. Они требуются для того, чтобы поддерживать работу коферментов, участвующих в метаболизме как клеток, так и бактерий.
В зависимости от типа культивируемых клеток или бактерий, фактор роста может как входить в состав питательной среды, так и вноситься извне.
Питательные среды и требования к ним
Питательная среда – это пространство, в котором находится необходимая группа клеток или бактерий. Среды бывают очень разными, в том числе и узкоспециализированными, для роста наиболее привередливых микроорганизмов. Однако существуют и общие требования, предъявляемые ко всем средам без исключения:
- Питательность. Среда должна содержать все необходимые вещества, которые используются бактериями для роста и не могут быть синтезированы ими без среды.
- Нужный уровень pH. Это требуется для регулирования проницаемости мембраны клетки и, как следствие, уровень питательных веществ, попадающих внутрь.
- Уровень осмотического давления, равный уровню давления в культивируемой клетке.
- Оптимальный для конкретной бактерии уровень влажности.
- Окислительно-восстановительные качества. Наибольшие различия требований по данной характеристике существуют при культивировании аэробов и анаэробов.
- Единый состав среды. Каждая конкретная среда должна иметь одинаковое количество веществ, чтобы не было вариативности в результатах культивирования.
При этом питательные среды могут значительно различаться по всем остальным характеристикам. Они могут быть как натуральными, так и синтезированными искусственно, а также жидкими, полужидкими или плотными.
Условия роста
Рост микроорганизмов и клеток невозможен без соблюдения определенных условий, таких как температура, влажность, давление, свет и аэрация (насыщение кислородом). Существуют микроорганизмы, которые имеют диаметрально противоположные требования по условиям роста. Для решения проблемы условий при культивировании различных клеток или микроорганизмов используется специальная аппаратура с камерами, внутри которых поддерживается нужный уровень температуры, света или давления. В одном таком устройстве, но в разных камерах, может быть одновременно несколько чашек Петри с материалом, имеющим различные требования по условиям роста. (Рекомендуем статью: «Инновационные технологии для поиска и разработки новых лекарств»)
Стерилизация посуды, сред и окружения
Одним из наиболее важных требований к процессу культивирования, является отсутствие загрязнений на оборудовании, при помощи которого происходит выращивание. Этого добиваются, проводя мероприятия по стерилизации. Стерилизация может проводиться несколькими способами, наиболее известные и используемые в современных лабораториях:
- Прокаливание. Экспресс-метод устранения микробиологического загрязнения через нагрев, может выполняться на спиртовке. Однако данный метод не может быть использован с чем-то, кроме игл и петель для переноса материала.
- Кипячение. Данный метод широко используется для устранения микробов, но споры бактерий он не устраняет.
- Сухожаровая стерилизация. Проводится в сушильном шкафу, наиболее часто используется для лабораторной посуды.
- Автоклавирование под давлением. Один из самых популярных и универсальных методов, однако многие материалы и среды разрушаются при использовании автоклавов.
Основным моментом в современном культивировании клеток и микроорганизмов, всегда будет являться неуниверсальность методик. Из-за большого разнообразия объектов культивирования, всегда будет необходимость подбирать наилучшие условия для конкретного объекта.
Источник
Приспособления и посуда для посевов микроорганизмов
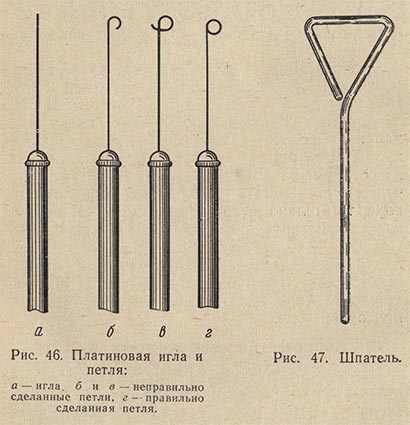
При посевах консервов на стерильность пользуются стеклянными трубками диаметром 0,5-0,6 см и длиной 35-40 см. При других работах по выделению микроорганизмов используют платиновые петли, иглы, шпатели (рис. 46 и 47). Вместо платиновой проволоки для изготовления игл и петель можно использовать хромоникелевую проволоку диаметром 0,5 мм. Проволока длиной около 7-8 см вставляется в специальный держатель или впаивается — в стеклянную палочку длиной 20-22 см. Свободный конец проволоки для иглы остается прямым. Для того чтобы получить петлю, конец иглы загибается, получается кружок диаметром 1,5-2 мм.
Для равномерного распределения посевного материала на плотной питательной среде изготовляют специальные шпатели из стеклянных палочек толщиной 4-5 мм и длиной около 30 см. Один конец такой палочки сгибают над пламенем горелки под прямым углом или в виде треугольника.
Для заражения сред жидким материалом и отбора проб жидкостей используются различные химические пипетки, стеклянные трубочки и пастеровские пипетки. Пастеровская пипетка представляет собой трубочку, один конец которой оттянут в капилляр длиной 10-12 см. Конец капилляра запаян. Пипетки и стеклянные трубочки перед стерилизацией закрывают ватой с того конца, который берут в рот. Длина такой ватной пробки должна быть 3 см. Ватные пробки, закрывающие пипетки, не должны быть очень плотными, но и не должны свободно двигаться в них. Нельзя, чтобы волокна ваты торчали из трубок и пипеток, так как это не даст возможности плотно зажать отверстия пипеток пальцем. Для регулирования быстроты вытекания жидкости концы трубок и пипеток со стороны ватной пробки зажимают указательным пальцем и приоткрывают лишь настолько, чтобы вытекание происходило медленно.
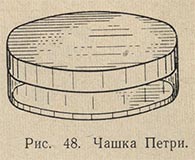
Для выращивания микроорганизмов на жидких питательных средах применяют бактериологические пробирки (без ранта, длиной 16 см и диаметром 16 мм). Для твердых питательных сред используются плоские двойные чашки Петри, состоящие из двух половинок разного диаметра (рис. 48). В половинку с меньшим диаметром вносится питательная среда. Другая половинка, большего диаметра, служит крышкой.
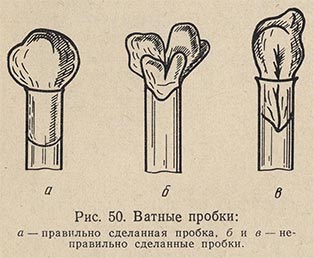
Приготовленные питательные среды для стерилизации разливают в пробирки, колбы, флаконы и закрывают их ватными пробками. Ватные пробки служат фильтром для воздуха и предохраняют среды от высыхания. Они должны быть достаточно плотными с равномерным распределением волокон и в то же время, не должны сильно задерживать газообмен между культурой и наружным воздухом. Слишком рыхлые пробки, через которые воздух беспрепятственно проходит в сосуд и пробки, едва закрывающие отверстие сосуда, совершенно непригодны. Непригодны и слишком плотные пробки, затрудняющие аэрацию. Длина пробки для пробирки должна быть до 4 см. Для колбочек пробки делаются соответствующего диаметра и примерно такой же длины. В сосуд пробка помещается наполовину ее высоты.
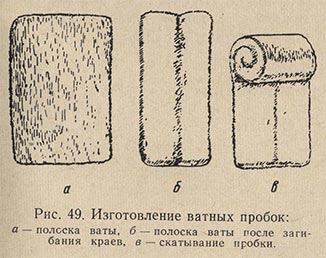
Для приготовления ватных пробок берут плоский кусок ваты длиной 50-60 см, аккуратно раскладывают его на столе и, смачивая поверхность ваты водой, скатывают полоску от себя валиком (рис. 49). Вату следует распределять равномерно и хорошо укатывать по размеру диаметра сосуда. Затем валик подсушивают и режут острым ножом на отрезки длиной 4 см. Каждый отрезок обертывают кусочком марли в один слой, скрепляя концы марли сверху ниткой (рис. 50).
Мойка бактериологической посуды. Бактериологическую посуду, бывшую в употреблении, кипятят в течение часа в воде с добавлением мыла и моющего средства «Прогресс». На 10 л воды берется полкуска хозяйственного мыла и 3-4 столовые ложки моющего средства. Можно использовать только одно мыло, но тогда его нужно брать больше. После кипячения дают воде остыть до 50-60 °С, посуду вынимают, тщательно прополаскивают в проточной водопроводной воде и ополаскивают дистиллированной водой.
Посуду с культурами перед мытьем предварительно стерилизуют в автоклаве при 120 °С в течение получаса, затем удаляет содержимое и моют, как указано выше. Иногда вместо стерилизации указанную посуду на 2-3 ч помещают в 5%-ный раствор соляной кислоты. Если посуда отмывается с трудом, ее следует обрабатывать в течение получаса хромовой смесью (на 1 л воды 50 г сухого двухромовокислого калия и 100 мл технической серной кислоты), затем тщательно промыть в воде с помощью ерша. Вместо хромовой смеси используют и 5-10%-ный раствор технической соляной кислоты — загружают в него на некоторое время посуду, а затем тщательно промывают.
Новую посуду кипятят в 1-2%-ном растворе соляной кислоты для нейтрализации избытка щелочи, возможно содержащейся в стекле. Затем тщательно прополаскивают в водопроводной и дистиллированной воде. Вымытую посуду сушат в сушильном шкафу. Для обесцвечивания несмывающейся краски употребляют 3%-ный раствор хлорной извести.
Посуду, применяемую для питательных сред, нельзя использовать ни для каких других целей, в том числе и для хранения дезинфицирующих веществ. Отмыть последние в дальнейшем почти невозможно. Примесь же дезинфицирующих веществ делает питательную среду совершенно непригодной для выращивания микробов.
Источник
Какая посуда используется для выращивания микроорганизмов
В микробиологических лабораториях, кроме обычной лабораторной посуды (цилиндры, колбы, склянки для растворения и хранения реактивов, химические пробирки и т. п.), используется специальная: бактериологические, серологические пробирки, пипетки, чашки Петри, колбы и т. д.
Существует несколько типов пробирок:
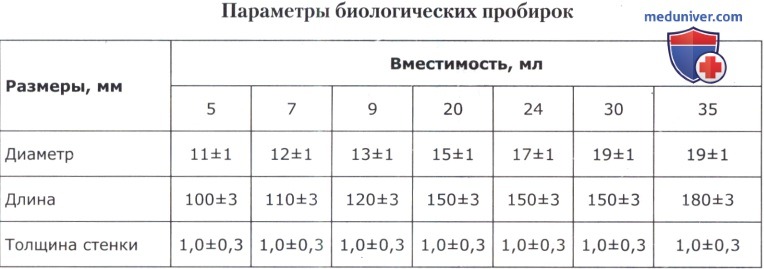
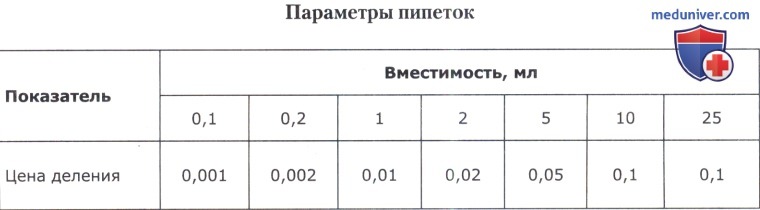
1. Биологические пробирки — с круглым дном, неразвернутым краем (без ранта); их размеры приведены в таблице ниже.
2. Центрифужные пробирки —отличаются от биологических тем, что сужены книзу. Существует несколько разновидностей центрифужных пробирок:
а) пробирка высотой 95 мм и диаметром 17 мм;
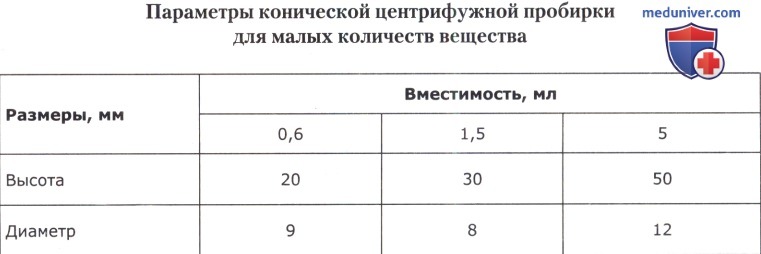
б) пробирка для малых количеств вещества коническая;
в) пробирка для малых количеств вещества с оттянутым концом:
высота всей пробирки: 40-50 мм
высота нижней (узкой) части: 20-80 мм
диаметр верхней части: 6-8 мм
диаметр нижней части: 1-3 мм
3. Прецинитационные пробирки — очень узкие: внутренний диаметр — 2-3мм, длина — 90-400 мм.
Все пробирки изготавливаются из прозрачного бесцветного стекла.
Для выращивания микроорганизмов на плотных питательных средах используют стеклянные чашки Петри. Они должны быть из прозрачного бесцветного стекла, не имеющего камней, пузырей и свилей. Высота чашки— 20-30 мм, диаметр — от 60 до 200 мм.
Для выращивания микроорганизмов на плотных и в жидких питательных средах, а также для работы с культурой ткани применяют плоские колбы или посевные матрасы.
Для точного отмеривания определенных объемов жидкости служат пипетки. Они представляют собой трубки из прозрачного бесцветного стекла, не имеющие на глаз кривизны (ГОСТ 1770-74). Пипетки бывают разных размеров, а следовательно, разной вместимости.
Кроме измерительных (градуированных) пипеток широко применяются пипетки для отмеривания определенных объемов жидкости — так называемые пастеровские пипетки и пипетки Мора. Пастеровские пипетки представляют собой стеклянные трубки диаметром 5-7 мм, у которых один конец оттянут над пламенем горелки в виде капилляра, а пипетки Мора имеют одну отметку с расширением.
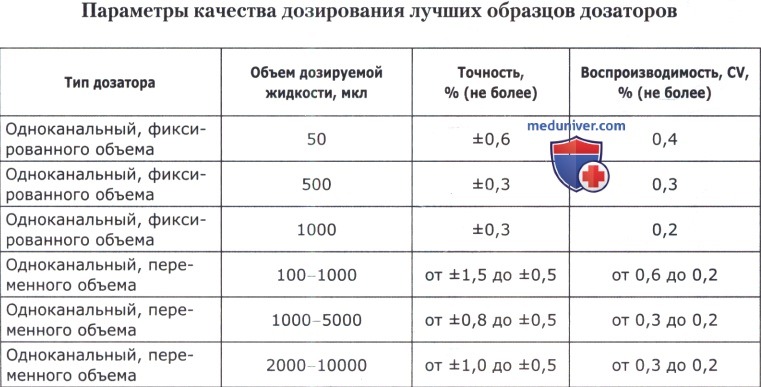
Для точного отбора жидкости в лаборатории помимо обычных пипеток могут применяться механические пипетки, или пипеточные дозаторы: дозаторы переменного, фиксированного объема, устройства для дозирования больших объемов, электронные дозаторы и флаконы-деспенсеры переменного объема дозирования.
При необходимости все время дозировать один и тот же объем используют механические пипетки-дозаторы фиксированного объема, позволяющие одномоментно дозировать только 50 или 100 либо 1000 мкл и т. д. Если требуется периодически изменять объем дозирования, пользуются электронными или механическими дозаторами переменного объема (от 50 до 100 мкл, от 100 до 1000 мкл и т. д.). Типы дозаторов приведены в таблице ниже.
В комплекте с дозатором поставляется набор для его сборки/разборки, мелкого ремонта, калибровки и смазки поршневой системы. Обычная калибровка дозаторов осуществляется в лаборатории при помощи весов и в соответствии с инструкцией производителя.
Для работы с пипеточными дозаторами необходимо использовать оригинальные наконечники (упакованы в пакеты, коробки) или специальные штативы. Наконечники, размещенные в штативах, наиболее удобны для работы в бактериологической лаборатории, так как при использовании штатива ручные операции по насадке наконечника на дозатор сводятся к минимуму. Некоторые фирмы производят наконечники нескольких типоразмеров для различных дозирующих устройств (QSP, США; LP, Италия; Ratiolab, Германия и др.), а также универсальные наконечники, посадочная часть которых изготовлена таким образом, что они подходят для большинства типов дозаторов и дозирующих станций (AHN Biotechnology, Германия и др.). В наконечник для дозатора может быть вмонтирован гидрофобный мембранный фильтр с целью защиты его внутреннего механизма (также непосредственно в основание посадочного конуса поршневой системы дозатора, как правило, помещается защитный аэрозольный фильтр для тех же целей).
Для снятия наконечника с дозатора используется специальное встроенное в дозатор устройство-толкатель, которое позволяет сбросить использованный наконечник, не прикасаясь к нему руками. Это крайне необходимо при работе с инфицированными материалами и агрессивными средами. Неоспоримым преимуществом пинеток-дозаторов является обеспечение максимальной биологической и химической защиты персонала лаборатории, сведение к минимуму их контакта с инфицированным материалом.
В электронных дозаторах для забора, сброса и дозирования жидкости имеется встроенный электродвигатель, создающий разряжение. Такой дозатор-насос снабжен аккумулятором и требует периодической подзарядки от электросети через зарядный штатив или сетевой адаптер (электронный дозатор может работать автономно в интенсивном режиме в течение нескольких часов, после чего его необходимо подзарядить). В отличие от механического дозатора, при работе с которым необходимо большим пальцем руки постоянно нажимать на поршень, что требует достаточно большого усилия (до 2,5 кг и более), управление электронным дозатором осуществляется простым нажатием соответствующих кнопок на рукоятке (усилие — до 100 г).
Для одномоментного дозирования больших объемов жидкостей (50 мл и более) можно использовать, наряду со стеклянными, аналогичные градуированные пластиковые пробирки, мерные цилиндры и стаканы. При дозировании жидкостей обычными (объем от 1 до 100 мл) стеклянными или пластиковыми пипетками традиционную резиновую грушу можно заменить электронными бюретками-тираторами, а также специальными электронными устройствами-насосами. Эти устройства имеют встроенный электронасос и позволяют производить взятие и сброс жидкости с регулируемой скоростью. В них размещается гидрофобный фильтр для предотвращения заброса жидкости в дозатор. Можно также использовать модели дозаторов с ручным механическим приводом.
Для порционного (по 50 мкл, 100 мкл, 1 мл и т. д.) дозирования больших объемов жидкости без периодического ее забора из емкости следует использовать шаговый дозатор-степпер (мультидиспенсер) (рис. 2.5); или программируемый электронный дозатор, который можно эксплуатировать в качестве степпера. Флаконом-диспенсером нужно пользоваться при порционном дозировании жидкостей непосредственно из бутылей.
Для получения качественных результатов при работе с дозаторами необходимо изучить инструкцию по работе с дозатором конкретного типа. Дозатор следует держать в вертикальном положении, взятие жидкости и дозирование при помощи механических устройств нужно проводить плавно без рывков. При взятии жидкости наконечник не следует опускать в нее слишком глубоко. Перед всасыванием жидкости нужно промыть наконечник этой жидкостью 2-5 раз путем заполнения/опорожнения. Это особенно важно при дозировании вязких жидкостей, а также жидкостей, имеющих температуру, отличную от температуры окружающей среды.
При большом числе проб и реагентов для быстрого и точного дозирования растворов в пробирки или стандартные планшеты (тест-панели) можно использовать специальные дозирующие станции (например, дозирующие станции серии Microlab швейцарской фирмы «Hamilton» или станции серии Flexispense австрийской фирмы «ASYS Hitech» и др.).
Дозаторы производят из материалов, устойчивых к коррозии и агрессивным веществам, которые выдерживают автоклавирование без повреждений и потерь точности.
Вся остальная посуда, используемая в микробиологических лабораториях, — это обычная общелабораторная посуда.
Для посева микроорганизмов на твердые питательные среды используют стеклянный шпатель, один конец которого согнут (шпатель Дригальского). Он предназначен для нанесения (распределения, втирания) микробиологического образца на плотную среду (агар). Для посева микроорганизмов, кроме шпателей, пользуются бактериологической петлей или иглой.
Бактериологические петли и иглы изготовляют из тонкой платиновой или никель-хромовой проволоки, которую закрепляют в металлическом или пластмассовом держателе. Диаметр бактериологической петли — 4-5 мм. Используют также одноразовые стерильные шпатели и петли из полистирола.
Стеклянная лабораторная посуда может быть заменена пластиковой. Когда особенно жестко ставится вопрос о контроле качества проводимых исследований, следует ориентироваться на использование пластиковой посуды и расходных материалов преимущественно однократного применения. Нужно стремиться к тому, чтобы все принадлежности, так или иначе контактирующие с биоматериалом и реактивами, предназначенными для анализа биоматериала на наличие микроорганизмов, были изначально стерильными и одноразовыми.
В микробиологических лабораториях пользуются широким ассортиментом одноразовой стерильной пластиковой посуды, поставляемой производителем в герметичной полиэтиленовой упаковке, устойчивой к внешним воздействиям, в индивидуальной упаковке. Это разнообразные пробирки (с пробками, крышками и т. п.), чашки Петри с крышками (в т.ч. двух-, трех- и многосекционными), разнообразными тест-планшетами, пастеровские и обычные пипетки, микробиологические петли и иглы, шпатели, стерильные емкости с различными оригинальными приспособлениями для взятия биоматериала, емкости с транспортными средами, чашками и пробирками с готовыми к употреблению питательными средами, а также комбинированными миниатюрными тест-системами для выявления и идентификации широкого спектра микробов и определения их чувствительности к антимикробным препаратам.
Пластиковая лабораторная посуда и принадлежности изготавливаются, как правило, из полипропилена, полиэтилена (высокого и низкого давления) и поли-стирена(полистирола).
Полипропилен (обозначение: ПП/РР) при комнатной температуре в высокой степени устойчив практически ко всем используемым в лаборатории реактивам (альдегидам, спиртам, щелочам/гидроксидам, маслам, фенолу, неорганическим и органическим кислотам, солям и растворам солей), выдерживает без деформации нагревание до 135-145 °С, хорошо стерилизуется автоклавированием. Из него изготавливают штативы, емкости для сбора и транспортировки проб, наконечники для дозаторов, различные пробирки, пробки и др.
Полиэтилен (обозначение: ПЭ/РЕ) при комнатной температуре чувствителен ко многим органическим растворителям, устойчив к сильным кислотам и щелочам. Автоклавировать можно только изделия из ПЭ низкого давления. Из ПЭ изготавливают транспортировочные пакеты для продукции и отходов, флаконы, штативы, крышки для пробирок и т. п.
Полистирен/полистирол (обозначение: ПС/PS) обладает сравнительно небольшой химической устойчивостью, при комнатной температуре чувствителен к фенолу, хлороформу и другим органическим растворителям. Изделия из ПС автоклавированием не стерилизуются. Из него изготавливают, как правило, продукцию с повышенными оптическими характеристиками: чашки Петри, кюветы (в т. ч. для фотометров), планшеты-панели, пробирки и др.
Стерилизовать большинство изделий из пластика (только из ПП, ПЭ низкого давления) многократного применения в условиях лаборатории следует автоклавированием при температуре 121 °С, «холодной стерилизацией» (например, при помощи окиси этилена), ионизирующим излучением (при наличии соответствующего оборудования и только в условиях центральных стерилизационных отделений). Сухожаровую стерилизацию применять нельзя.
Для изделий в герметичных полиэтиленовых (или полипропиленовых) упаковках срок сохранения стерильности — до 3 лет, в упаковках других видов — до 1 года. Срок стерильности может быть увеличен на 1 год на конкретный вид продукции после истечения уже установленного срока и проведения повторного бактериологического анализа ранее отобранных образцов. В настоящее время отечественными производителями разрабатываются для серийного выпуска установки радиационной стерилизации изделий медицинского назначения непосредственно в ЛПУ.

За рубежом достаточно большой ассортимент продукции производится в асептических условиях по так называемой асептической технологии, не требующей конечной стерилизации.
Из пластмасс (преимущественно из полипропилена) изготавливаются также приспособления многократного применения — штативы, капельницы, бутыли, ванночки, которые используют в случаях, когда не требуется соблюдения особых условий стерильности при обращении с реагентами или же при отсутствии прямого контакта с ними.
Специализированные принадлежности из пластика. Особо стоит отметить специальные комбинированные системы однократного применения, помещенные в пластиковые емкости. Их можно подразделить на 3 группы:
1. Системы для взятия и транспортировки биоматериала. Они состоят из пластиковой емкости или пробирки либо контейнера с приспособлением для забора биоматериала (лопатка, палочка, тампон и т. п.) или без приспособлений; в емкости может также находиться стерильный физиологический раствор или иная жидкость-разбавитель. Такие системы следует использовать для взятия материалов, если образцы предполагается доставить в бактериологическую лабораторию в течение 2-4 ч и если не предъявляется специальных требований к сохранности микрофлоры биоматериала.
2. Системы для взятия и транспортировки биоматериала с сохранением жизнеспособности большинства микроорганизмов, в нем находящихся. Они аналогичны системам, относящимся к группе 1, но в них обязательно присутствует полужидкая, жидкая или плотная транспортная питательная среда или среда обогащения. Такие системы (транспортные коллекторы) позволяют хранить — транспортировать образцы в течение нескольких суток. Чаще всего в качестве транспортных сред используются среды Стюарта, Амиес и Кэри Блэйр. Наибольшее распространение у нас в стране получили системы фирм «Сорап» (Италия/ США), «Deltalab/Eurotubo» (Испания), «Becton Dickinson» (США) и «HiMedia» (Индия).
3. Системы для определения свойств микроорганизмов после выделения чистой культуры. Это обычные или секционированные чашки Петри либо пробирки с уже внесенными в них готовыми к употреблению питательными средами, тест-панели микротестов для рутинной идентификации микроорганизмов и определения их чувствительности к антибиотикам после выделения чистой культуры и т. п.
Утилизация одноразовой пластиковой посуды имеет ряд существенных преимуществ перед традиционным обеззараживанием посуды многократного применения (в т. ч. пластмассовой), сопряженным с использованием достаточно трудоемких, материалоемких и энергоемких методов, таких как автоклавирование при температуре 120 ± 2 °С (давление 0,11 МПа или 1 атм) в течение 60 мин и длительное замачивание в дезинфицирующих растворах (например, в 3% растворе хлорамина или 6% растворе перекиси водорода в течение 1 сут.). Наиболее эффективным и безопасным способом утилизации использованной пластиковой посуды является сжигание.
Редактор: Искандер Милевски. Дата публикации: 29.04.2019
Источник