Mse-Online.Ru
Реакция почвы
Почва обладает определенной реакцией, которая проявляется при взаимодействии с водой или растворами солей. Реакция почвы может быть нейтральной, кислой или щелочной. Эти свойства почвы имеют чрезвычайно важное значение для роста и развития растений, так как каждый вид растений лучше всего развивается при определенной реакции почвы.
Кислотность почвы — одно из важных ее свойств, обусловленное определенной концентрацией водородных ионов. Источник кислотности почвы — органические кислоты, образующиеся при распаде растительных остатков и вымывающиеся в нижние горизонты. Среди этих кислот наиболее распространены перегнойные кислоты и прежде всего — креновые.
В зависимости от направления и развития почвообразовательного процесса в отдельных типах и разностях почв кислотность проявляется по-разному. Если в почвенном растворе имеются ионы кальция и противодействие повышению кислотности почвы высокое, вредное действие кислотности почвы уменьшается, а если раствор содержит ионы алюминия, железа и марганца, ее токсичность для растений и почвенных микроорганизмов увеличивается.
Высокая кислотность всегда отрицательно влияет на микробиологические процессы в почве и на развитие растений. Если реакция почвы очень кислая (подзолистые почвы), то в почвенном растворе кроме водорода находятся ионы алюминия, высокая концентрация которых также отрицательно влияет на развитие растений. Особенно чувствительны к кислой реакции клевер, пшеница, лен, свекла.
Кислая реакция почвы затрудняет усвоение растениями азота, кальция, магния и способствует поступлению в них алюминия и марганца. В растениях, которые растут на кислых почвах, задерживается превращение моносахаридов в дисахариды и другие сложные соединения, нарушаются процессы образования белков и обмена.
Различают актуальную, или активную, и потенциальную, или пассивную, кислотность почв.
Актуальная кислотность обусловливается наличием ионов водорода в почвенном растворе, а потенциальная — водородных ионов и ионов алюминия в почвенном поглощающем комплексе. Актуальную кислотность почвенного раствора обусловливают в основном растворимые органические кислоты, которые образуются в почве в результате биохимических процессов.
В ряде случаев отрицательное действие кислой реакции связано с подвижностью ионов алюминия, который токсичен для растений, особенно при низком рН.
Условным общим показателем кислотности почвы является кислотность почвенного раствора — рН, которая зависит от содержания в почве свободных кислот и обменных ионов водорода. Сельскохозяйственные растения лучше всего развиваются при рН от 5,5 до 7,5. Величина рН наиболее распространенных типов почв колеблется в пределах от 3 до 9, в зависимости от чего почвы делятся на такие группы: очень кислые — рН 3—4, кислые — рН 4—5, слабокислые — рН 5—6, нейтральные — рН 6—7, щелочные — рН 7—8, сильно щелочные — рН 8—9.
Почва с рН 6,5—7 практически нейтральна.
Потенциальную кислотность можно определить, если выделить из поглощающего комплекса поглощенные ионы водорода. В зависимости от того, какими солями определяют потенциальную кислотность, ее разделяют на обменную и гидролитическую.
Обменная кислотность обусловливается наличием в ППК водорода и алюминия, которые вытесняются из почвы под действием нейтральных солей. Обменную кислотность обозначают так же, как и активную, но с обязательным указанием, что это рН солевой вытяжки. Обменная кислотность сильно кислых почв равна 4,5, кислых — 4,6—5,5, слабокислых — 5,6—6, близких к нейтральным — 6,1—6,5, нейтральных — 7. Обменную кислотность можно также определять в миллиграмм — эквивалентах суммы водорода и алюминия на 100 г почвы.
Гидролитическая кислотность — это количество ионов водорода, которые вытесняются из почвы водным раствором солей слабых кислот и сильных щелочей. Обычно для этой цели применяют уксуснокислые соли — ацетат натрия или кальция.
Величина гидролитической кислотности в разных почвах бывает от 0,1 до 10 мг-экв и более на 100 г почвы. В обыкновенных черноземах гидролитической кислотности практически нет, реакция их нейтральная, тогда как в черноземах оподзоленных и серых лесных почвах она иногда достигает 3 мг-экв и более на 100 г почвы. Самая высокая гидролитическая кислотность в некоторых торфяных горизонтах болотных почв и их разностей. Обычно гидролитическая кислотность почвы больше, чем обменная. Она практически является общей кислотностью почвы, потому что при определении ее учитываются как активная, так и обменная формы.
Знание кислотности почвы имеет большое практическое значение для определения потребности почвы в известковании. Чаще всего пользуются данными гидролитической кислотности. Если она составляет 1—2 мг-экв, то нет потребности в известковании почв, а если почва имеет большую кислотность, то ее нужно обязательно известковать. Слабоподзолистые песчаные почвы известкуют даже при гидролитической кислотности менее 2 мг-экв на 100 г почвы.
При известковании почв кроме гидролитической кислотности учитывают степень насыщенности основаниями и актуальную кислотность. В известковании нуждаются все почвы с рН 8. Такая реакция неблагоприятная для большинства сельскохозяйственных культур.
Повышенная щелочность в почве не только вредна для развития растений, но и усиливает пептизацию коллоидов, вследствие чего резко ухудшаются физические свойства и водный режим почв.
В зависимости от содержания обменного натрия (в % к сумме поглощенных оснований) различают такие почвы: свыше 20 % — солонцы, 10—20 — солонцеватые, 5—10 — слабосолонцеватые, менее 5 % — несолонцеватые.
Почвы, в водном растворе которых есть растворимые соли натрия (в основном хлориды, сульфаты и карбонаты), называются солончаками. Обычно в составе таких почв есть также растворимые соли кальция и магния.
Источник
Показатель pH почвы (как определить кислотность почвы)
Большинство растений предпочитают слабокислые и нейтральные почвы. Но если грунт сильнокислый или щелочной, выращивать на нем даже неприхотливые растения сложно. Для определения кислой, нейтральной или щелочной среды почвы используют показатель pH.
Содержание
Показатель pH — специальный показатель, отражающий кислотно-щелочной баланс почвы. В этом материале даны понятия что такое показатель pH, какие типы почвы (от слабокислой до сильнощелочной) соответствуют численным значениям показателя рН, а также способы для его определения или измерения.
ЧТО такое показатель pH почвы
Кислотность показывает концентрацию ионов водорода, определяющих кислотно-щелочной баланс грунта. Для этого есть показатель pH. Показатель, отражающий кислотно-щелочной баланс почвы, раствора или другой среды. Измеряется в единицах от 0 до 14 (см таблицу):
| Значение показателя pH | Характеристика |
| 0 … 6,9 | среда кислая (преобладают кислоты) |
| 7,0 | среда нейтральная (кислоты и щелочи нейтрализуют друг друга). |
| 7,1 … 14 | среда щелочная (преобладают щелочи). |
| Примечание: а) чем больше pH: тем меньше кислотность почвы; тем больше щелочность почвы. б) чем меньше pH: тем больше кислотность почвы; тем меньше щелочность почвы. |
Показатель pH почвы (его численное значение) чаще всего колеблется в диапазоне 3,5-8,5.
Типы почвогрунтов, в зависимости от показателя pH принято разделять на следующие типы (см. таблицу):
| Значение показателя pH | Тип почвы |
| менее 4 | сильнокислая |
| 4 … 5 | среднекислая |
| 5 … 6 | слабокислая |
| 6 … 7 | нейтральная |
| 7 … 8 | слабощелочная |
| 8 … 8,5 | среднещелочная |
| более 8,5 | сильнощелочная |
Также принято различать два типа кислотности — актуальную кислотность (отражает реальное состояние, сколько сейчас в почве есть ионов водорода) и потенциальную кислотность (потенциально возможное состояние):
- АКТУАЛЬНАЯ определяет присутствие в почве ионов водорода: чем их больше, тем выше кислотность (соответственно, тем меньше значение pH).
- ПОТЕНЦИАЛЬНАЯ определяет присутствие в почве обменно поглощенных ионов водорода и других частиц – марганца, железа, алюминия.
Всем садоводам и огородникам следует ориентироваться ТОЛЬКО на актуальную кислотность, которая измеряется химическими индикаторами, приборами и другими способами. Далее рассмотрим как определить показатель pH почвы.
КАК определить показатель pH почвы (кислотность почвы)
Способов определения множество – это и «народные» (с использованием уксуса или лакмусовой бумаги), и современные (с применением электронных приборов pH-метров/ кислотомеров).
Самые распространенные способы определения кислотности почвы:
- Лакмусовой бумагой;
- Измерительные приборы pH-метры;
- Визуальный способ (по растениям-маркерам);
- С помощью уксуса;
- Заказ исследование почвы в лаборатории.
а) Лакмусовая бумага
Показатель pH почвы определяется по цвету бумаги. Лакмусовая бумага есть в продаже в любом садовом центре.

б) Измерение pH-метром (кислотомером)
Для определения кислотности разработаны и внедрены в производство целый ряд pH-метров (кислотомеров) – специальных портативных приборов, позволяющих определять не только кислотность, но и другие ключевые показатели почвы – влажность, температуру, освещённость и пр.
pH-метр — это прибор для измерения водородного показателя, характеризующего активность ионов водорода в растворах/средах (почва, вода, пищевая продукция и сырье, объекты производственных системах, в том числе в агрессивных средах). Действие pH-метра основано на измерении величины ЭДС электродной системы, которая пропорциональна активности ионов водорода в растворе — pH (водородному показателю).
Для использования в ЛПХ и в сельскохозяйственном производстве выпускается широкий ряд простых в применении электронных или электронно-механических pH-метров. Популярность их из года в год растет. Это самый точный и актуальный на сегодня способ определения кислотности почвы.

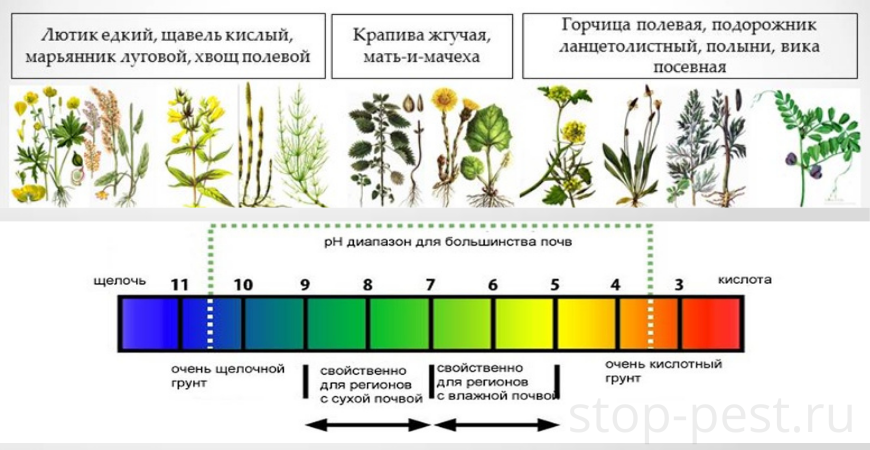
в) Визуальный способ
В данном случае речь идет по определению кислотности почвы по растениям – маркерам. Например, если на участке хорошо растет щавель и хвощ, то почва кислая, а если мак и вьюнок – щелочная.
| Значение pH | Тип почвы | Растения-маркеры |
| менее 4 | сильнокислая | растений нет, на верхнем слое бархатистый зеленый налет |
| 4 … 5 | среднекислая | подорожник, дикий щавель, мята дикая, хвощ, фиалка и др. |
| 5 … 6 | слабокислая | папоротник, ромашка, пырей, одуванчик, сныть обыкновенная, клевер, мать-и-мачеха и др. |
| 6 … 7 | нейтральная | мокрица, лебеда, пастушья сумка, |
| более 7 | щелочная | мак, вьюнок, дрема белая |
г) С помощью уксуса
В плоскую емкость помещается небольшое количество почвогрунта. Затем заливается 6% раствором уксуса. По реакции определяем кислотность почвы:
- реакции нет, то почва кислая;
- реакция слабая (мало пузырьков) — почва слабокислая или близкая к норме;
- реакция бурная — значит, щелочная среда.
д) Заказать исследование почвы в лаборатории
Раскисление почвы
Раскисление почвы – единственный способ поднять ее рН до нужной отметки (т. е. до 5,0 и выше). Раскисление почвы процесс не сложный, но требует определенных знаний. Процесс не быстрый, около полугода. Осень самое благоприятное время, чтобы к весне кислотно-щелочной баланс почвы был на оптимальном уровне.
Для раскисления используют следующие способы/материалы:
Источник
Сельское хозяйство | UniversityAgro.ru
Агрономия, земледелие, сельское хозяйство
Популярные статьи
Кислотность почвы
Кислотность почвы — свойство почвы, обусловленное наличием ионов водорода в почвенном растворе и обменных ионов водорода и алюминия в поглощающем комплексе почвы.
Интервал pH 5,5-7 соответствует наиболее агрономически благоприятной структуре почвы, высокому качеству гумуса и оптимальному водному режиму.
Реакция среды почвенного раствора
Реакция среды почвенного раствора — соотношение концентрации Н + и OH — ионов почвенного раствора, выраженное в виде pH водной или солевой вытяжки. Удобрения, как правило, изменяют реакцию почвенного раствора.
Реакция почвы оказывает влияние на питательный режим почв, рост, развитие и урожайность растений, деятельность микроорганизмов почвы, трансформацию форм питательных элементов удобрений и почвы, агрофизические, агрохимические, физико-химические и биологические свойства почв. Удобрения и мелиоранты позволяют регулировать реакцию почв в желаемую для возделываемых культур сторону.
Реакция почвенного раствора определяется концентрацией ионов водорода (Н + ) и гидроксид-иона (OH — ). В чистой воде с нейтральной реакцией, концентрация ионов водорода совпадает с концентрацией гидроксид-иона и равна 1⋅10 7 моль/л. При добавлении 1 ммоль соляной и азотной кислоты к 1 л воды, которые полностью диссоциируют в водном растворе, концентрация ионов водорода составит 1 ммоль Н + , или 1⋅10 3 моль/дм 3 . Концентрацию ионов водорода выражают через показатель pH, равный:
где CH + — концентрация ионов водорода в растворе, моль/дм 3 .
В растворе с нейтральной реакцией концентрация ионов водорода равна 0,0000001 = 1 · 10 -7 моль/дм 3 , или pH = 7.
По реакции среды (рН) почвы деляться на:
Реакция почвенных растворов может колебаться в широких пределах от pH = 3-3,5, характерная для сфагновых торфов и лесных подстилок сфагновых лесов до pH = 10-11 у солонцов.
Для большинства возделываемых сельскохозяйственных культур благоприятны почвы с нейтральной или близкой к нейтральной реакцией, однако значительные площади сельскохозяйственных угодий характеризуются неблагоприятной реакцией.
Источник
