Mse-Online.Ru
Реакция почвы
Почва обладает определенной реакцией, которая проявляется при взаимодействии с водой или растворами солей. Реакция почвы может быть нейтральной, кислой или щелочной. Эти свойства почвы имеют чрезвычайно важное значение для роста и развития растений, так как каждый вид растений лучше всего развивается при определенной реакции почвы.
Кислотность почвы — одно из важных ее свойств, обусловленное определенной концентрацией водородных ионов. Источник кислотности почвы — органические кислоты, образующиеся при распаде растительных остатков и вымывающиеся в нижние горизонты. Среди этих кислот наиболее распространены перегнойные кислоты и прежде всего — креновые.
В зависимости от направления и развития почвообразовательного процесса в отдельных типах и разностях почв кислотность проявляется по-разному. Если в почвенном растворе имеются ионы кальция и противодействие повышению кислотности почвы высокое, вредное действие кислотности почвы уменьшается, а если раствор содержит ионы алюминия, железа и марганца, ее токсичность для растений и почвенных микроорганизмов увеличивается.
Высокая кислотность всегда отрицательно влияет на микробиологические процессы в почве и на развитие растений. Если реакция почвы очень кислая (подзолистые почвы), то в почвенном растворе кроме водорода находятся ионы алюминия, высокая концентрация которых также отрицательно влияет на развитие растений. Особенно чувствительны к кислой реакции клевер, пшеница, лен, свекла.
Кислая реакция почвы затрудняет усвоение растениями азота, кальция, магния и способствует поступлению в них алюминия и марганца. В растениях, которые растут на кислых почвах, задерживается превращение моносахаридов в дисахариды и другие сложные соединения, нарушаются процессы образования белков и обмена.
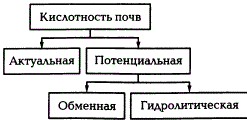
Различают актуальную, или активную, и потенциальную, или пассивную, кислотность почв.
Актуальная кислотность обусловливается наличием ионов водорода в почвенном растворе, а потенциальная — водородных ионов и ионов алюминия в почвенном поглощающем комплексе. Актуальную кислотность почвенного раствора обусловливают в основном растворимые органические кислоты, которые образуются в почве в результате биохимических процессов.
В ряде случаев отрицательное действие кислой реакции связано с подвижностью ионов алюминия, который токсичен для растений, особенно при низком рН.
Условным общим показателем кислотности почвы является кислотность почвенного раствора — рН, которая зависит от содержания в почве свободных кислот и обменных ионов водорода. Сельскохозяйственные растения лучше всего развиваются при рН от 5,5 до 7,5. Величина рН наиболее распространенных типов почв колеблется в пределах от 3 до 9, в зависимости от чего почвы делятся на такие группы: очень кислые — рН 3—4, кислые — рН 4—5, слабокислые — рН 5—6, нейтральные — рН 6—7, щелочные — рН 7—8, сильно щелочные — рН 8—9.
Почва с рН 6,5—7 практически нейтральна.
Потенциальную кислотность можно определить, если выделить из поглощающего комплекса поглощенные ионы водорода. В зависимости от того, какими солями определяют потенциальную кислотность, ее разделяют на обменную и гидролитическую.
Обменная кислотность обусловливается наличием в ППК водорода и алюминия, которые вытесняются из почвы под действием нейтральных солей. Обменную кислотность обозначают так же, как и активную, но с обязательным указанием, что это рН солевой вытяжки. Обменная кислотность сильно кислых почв равна 4,5, кислых — 4,6—5,5, слабокислых — 5,6—6, близких к нейтральным — 6,1—6,5, нейтральных — 7. Обменную кислотность можно также определять в миллиграмм — эквивалентах суммы водорода и алюминия на 100 г почвы.
Гидролитическая кислотность — это количество ионов водорода, которые вытесняются из почвы водным раствором солей слабых кислот и сильных щелочей. Обычно для этой цели применяют уксуснокислые соли — ацетат натрия или кальция.
Величина гидролитической кислотности в разных почвах бывает от 0,1 до 10 мг-экв и более на 100 г почвы. В обыкновенных черноземах гидролитической кислотности практически нет, реакция их нейтральная, тогда как в черноземах оподзоленных и серых лесных почвах она иногда достигает 3 мг-экв и более на 100 г почвы. Самая высокая гидролитическая кислотность в некоторых торфяных горизонтах болотных почв и их разностей. Обычно гидролитическая кислотность почвы больше, чем обменная. Она практически является общей кислотностью почвы, потому что при определении ее учитываются как активная, так и обменная формы.
Знание кислотности почвы имеет большое практическое значение для определения потребности почвы в известковании. Чаще всего пользуются данными гидролитической кислотности. Если она составляет 1—2 мг-экв, то нет потребности в известковании почв, а если почва имеет большую кислотность, то ее нужно обязательно известковать. Слабоподзолистые песчаные почвы известкуют даже при гидролитической кислотности менее 2 мг-экв на 100 г почвы.
При известковании почв кроме гидролитической кислотности учитывают степень насыщенности основаниями и актуальную кислотность. В известковании нуждаются все почвы с рН 8. Такая реакция неблагоприятная для большинства сельскохозяйственных культур.
Повышенная щелочность в почве не только вредна для развития растений, но и усиливает пептизацию коллоидов, вследствие чего резко ухудшаются физические свойства и водный режим почв.
В зависимости от содержания обменного натрия (в % к сумме поглощенных оснований) различают такие почвы: свыше 20 % — солонцы, 10—20 — солонцеватые, 5—10 — слабосолонцеватые, менее 5 % — несолонцеватые.
Почвы, в водном растворе которых есть растворимые соли натрия (в основном хлориды, сульфаты и карбонаты), называются солончаками. Обычно в составе таких почв есть также растворимые соли кальция и магния.
Источник
Кислотность почв
Кислотно-щелочная характеристика, или реакция, — это способность почв проявлять свойства кислот и щелочей при взаимодействии с водой или растворами солей. Мерой реакции почв является соотношение в почвенном растворе водородных (Н + ) и гидроксильных (ОН — ) ионов. Реакция почв характеризуется величиной pH — отрицательным логарифмом активности водородных ионов в растворах. Почвы могут иметь кислую (pH 7) реакцию.
Различают два вида почвенной кислотности: актуальную и потенциальную, которая в свою очередь подразделяется на обменную и гидролитическую.
Виды кислотности почв
Актуальной кислотностью называется кислотность почвенного раствора. Она измеряется при взаимодействии почвы с дистиллированной водой (pHH2O). Актуальная кислотность зависит от наличия в почвенном растворе свободных органических и минеральных кислот (главным образом, угольной кислоты). Актуальная кислотность в почвах проявляется в диапазоне pH от 3 до 7.
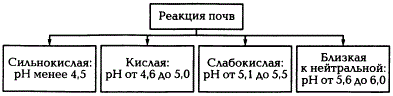
Обменная кислотность обусловлена наличием в ППК обменных водорода и алюминия и определяется путем вытеснения ионов Н + и Аl 3+ раствором нейтральной соли КСl. Степень кислотности оценивают по величине pH солевой вытяжки. Обменная кислотность всегда больше актуальной. В почвах с ППК, насыщенны основаниями, обменная кислотность не определяется. Наиболее сильно она выражена в подзолистых почвах и краснозёмах. Существует четыре градации потенциальной кислотности почв, характеризуемой рНКСl.
Градации кислотности почв
Гидролитическая кислотность определяется путем воздействия на почву гидролитически щелочной соли. При взаимодействии почвы с солью происходит более полное вытеснение из ППК обменных водорода и алюминия. Для определения гидролитической кислотности принято использовать 1,0 н. раствор CH3COONa. Он выражается в мг-экв на 100 г почвы.
По величине гидролитической кислотности (Н) находят необходимую для известкования почвы дозу извести и рассчитываю степень насыщенности почвы основаниями (V, %):
где S — сумма поглощенных оснований.
Почвы, обладающие кислотностью, распространены очень широко в бореальном поясе, а также в условиях влажных субтропиков и тропиков.
В Российской Федерации в конце XX в. кислые почвы занимал 51 млн га сельскохозяйственных угодий, в том числе 43 % всей пашни. Среди них преобладают сильно- и среднекислые почвы (рНКСl менее 5,0), площадь которых составляла 28 млн га. Во многих странах площади, занятые кислыми почвами, увеличиваются, и растет степень их кислотности. Причин тому несколько. Одна из них — внесение минеральных, часто физиологически кислых удобрений, не сопровождаемое необходимым известкованием.
Для многих, особенно промышленных, регионов характерно выпадение кислых и даже сильнокислых дождевых осадков с pH примерно 4,0—4,5, содержащих серную и частично азотную кис-лоты. Кислые дожди служат дополнительным фактором ускорения развития кислотности почв. В Нечерноземной зоне РФ потери СаCO3 в результате антропогенного подкисления почв достигают 400—450 кг/га в год.
Негативное влияние повышенной кислотности на растения обусловлено несколькими причинами, среди которых наибольшее значение имеют следующие:
- недостаток Са 2+ — необходимого для растений элемента питания;
- повышенная концентрация ионов Аl 3+ , Мn 2+ , Н + ;
- изменение доступности растениям макро — и микроэлементов питания;
- изменение физических свойств почвы.
От величины pH зависят подвижность и доступность растениям практически всех элементов питания. Усвояемость фосфора максимальна при pH = 6,5, снижаясь как в более кислой, так и в щелочной среде. Только в сильнощелочных почвах при pH около 9 и выше растворимость фосфатов вновь возрастает.
В кислых почвах повышается растворимость соединений железа, марганца, алюминия, бора, меди, цинка. При избытке этих элементов продуктивность растений снижается. В то же время высокая кислотность понижает доступность такого важного микроэлемента, как молибден.
Оптимальный интервал pH связан не только с растворимостью почвенных компонентов, но и с физиологическими особенностями возделываемых культур. Для одних растений оптимум pH лежит в интервале 4,0 — 5,0 (чайный куст, клюква), для других — от 6,0 до 8,0 (вишня, груша, орех грецкий, слива, яблоня). Для снижения поденной кислотности в качестве химических мелиорантов используют различные материалы. Наиболее употребительны осадочные породы, состоящие преимущественно из кальцита, доломита СаМn(СO3)2, доломитизированные известняки, мергели. Кроме того, применяют известковые туфы и различные промышленные отходы: дефекат (отход свеклосахарного производства), другие шлаки. В большинстве мелиорантов действующим веществом является СаСО3.
С химической точки зрения карбонат кальция является лучшим средством для снижения почвенной кислотности.
При внесении карбоната кальция в кислую почву происходят реакции:
В результате этих реакций создаются наиболее благоприятные условия: почвенный поглощающий комплекс насыщается кальцием, а в почвенном растворе образуется слабая угольная кислота.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник
Кислотность почв



Характерным свойством почвы является ее реакция. Она проявляется при взаимодействии почвы с водой или растворами солей и определяется соотношением свободных ионов Н+ и OH- в почвенном растворе.
Концентрация свободных ионов Н+ выражается величиной рН, представляющей отрицательный логарифм концентрации ионов водорода;
рН 7 характеризует нейтральную реакцию,
Реакция почвенного раствора в различных почвах колеблется от рН 3,5 до 8—9 и выше.
Наиболее кислую реакцию имеют болотные почвы верховых торфяников.
Кислой реакцией почвенного раствора характеризуются подзолистые и дерново-подзолистые почвы (рН 4—6).
Черноземы имеют реакцию, близкую к нейтральной.
Наиболее щелочная реакция у солончаков, особенно содовых (рН 8—9 и выше).
Сельскохозяйственные растения предъявляют разные требования к реакции почвы. Наиболее благоприятна слабокислая или слабощелочная реакция; отрицательно сказываются на развитии растений сильнокислая и особенно сильнощелочная реакция почвенного раствора.
С реакцией почвенного раствора тесно связана жизнедеятельность почвенной микрофлоры. В кислой среде преобладает грибная микрофлора, в нейтральной и слабощелочной — бактериальная.
С реакцией почвенного раствора связаны процессы превращения компонентов минеральной и органической частей почв:
растворение веществ, образование осадков, диссоциация, возникновение и устойчивость комплексных соединений, а следовательно, и миграция и аккумуляция веществ в почвенном профиле.
Нейтральная реакция характерна для почв, не содержащих карбонатов, ППК которых полностью насыщен кальцием и магнием. Эта реакция наиболее благоприятна для развития большинства культурных растений и бактерий. Кислая реакция является следствием развития в почве кислотности, щелочная реакция — следствие щелочности почвы.
Кислотность почвы— способность почвы подкислять воду и растворы нейтральных солей. Различают актуальную и потенциальную кислотность,
которая подразделяется на обменную и гидролитическую.
Актуальная кислотность — кислотность почвенного раствора, обусловленная повышенной концентрацией ионов водорода по сравнению с ионами гидроксила. Она определяется наличием в нем водорастворимых кислот — щавелевой, лимонной, фульвокислот, гидролитически кислыхсолей, прежде всего угольной кислоты.
Потенциальная кислотность характерна для твердой фазы почвы. Между актуальной и потенциальной кислотностью в почве сохраняется подвижное равновесие, но доминирующее значение во всех почвах имеет кислотность твердой фазы почвы.
Актуальная кислотность почвенного раствора зависит от наличия в нем свободных кислот, кислых солей и степени их диссоциации. В почвенном растворе свободные минеральные кислоты в заметных количествах встречаются очень редко. В целинных болотных и подзолистых почвах с высоким содержанием в почвенном растворе органических кислот роль их в создании концентрации водородных ионов
возрастает. В большинстве почв актуальная кислотность обусловлена угольной кислотой и ее кислыми солями.
Потенциальная кислотность (кислотность твердой фазы) имеет сложную природу. Ее носителем являются обменные катионы Н+ и А1 3+ почвенных коллоидов.
В зависимости от характера вытеснения различают две формы потенциальной кислотности—обменную и гидролитическую.
Обменная кислотность проявляется при обработке почвы раствором нейтральной соли.
Образующаяся в результате взаимодействия солевого раствора с почвой и гидролитического расщепления А1С1з соляная кислота характеризует обменную кислотность. Обменная кислотность наиболее ярко выражена в подзолистых и красноземных почвах (рН 3—4). В почвах со слабокислой, нейтральной и особенно щелочной реакцией она не проявляется.
Величина обменной кислотности выражается в миллиграмм-эквивалентах Н+ и А1 3+ , количество которых определяется методом титрования, или величиной рН солевой вытяжки, полученной при обработке почвы раствором нейтральной соли.
По величине pHKCl различают следующие градации кислой реакции:
сильнокислая рН 
При обработке почвы раствором нейтральной соли вытесняются не все поглощенные ионы водорода.
Более полно выявляется потенциальная кислотность при обработке почвы раствором гидролитически щелочной соли, например CH3COONa.
При обработке почвы раствором такой соли вследствие щелочной реакции среды происходит более полное вытеснение поглощенного водорода.
Количество образующейся уксусной кислоты, определяемое титрованием, характеризует величину гидролитической кислотности. Она обычно больше обменной, так как при обработке почвы раствором гидролитически щелочной соли вытесняется, помимо подвижных ионов, и менее подвижная часть поглощенных ионов водорода.
Гидролитическая кислотность может рассматриваться как суммарная кислотность почвы, состоящая из актуальной и потенциальной кислотности.
Величину гидролитической кислотности (гк) выражают также в миллиграмм-эквивалентах Н+ на 100 г почвы и обозначают символом Н.
Кислотность почвы является резко отрицательным свойством почвы, так как она угнетает развитие большинства культурных растений, усиливает разрушение минералов почвы, вызывая оподзоливание последней. Кроме того, катионы алюминия в почвенном растворе токсичны для растений.
Для устранения кислотности проводят известкование почвы, при котором происходит замещение поглощенного водорода на кальций.
Бикарбонат кальция, образующийся при взаимодействии извести с углекислотой почвенного раствора, нейтрализует также свободные органические и минеральные кислоты почвы. Уменьшению кислотности и созданию благоприятных соотношений поглощенных катионов способствует систематическое применение навоза, торфокомпостов в сочетании с агротехническими приемами окультуривания почв.
Количество извести, которое необходимо внести в почву, зависит от степени кислотности и механического состава почвы и исчисляется тоннами на гектар.
По нуждаемости в известковании почвы разделяются в зависимости от величины рНКСl на сильно- (рН 5,5).
Для почв с рН 4,6—5,5 необходимо также учитывать и степень насыщенности основаниями по следующей градации: 80 — не нуждаются в известковании.
Щелочность почв.Различают актуальную и потенциальную щелочность.
Актуальная щелочность обусловливается наличием в почвенном растворе гидролитически щелочных солей (Na2CO3, NaHCO3, Са(НСО3)2 и др.).
При определении актуальной щелочности различают общую щелочность, щелочность от нормальных карбонатов и от бикарбонатов.
Щелочность почвенного раствора характеризуется в миллиграмм-эквивалентах кислоты, необходимой для нейтрализации ионов ОН раствора, обусловленных ионами НСО3 (щелочность бикарбонатов), СОз
(щелочность нормальных карбонатов) или их суммой (общая щелочность) .
Величину щелочности также выражают показателем рН почвенного раствора или водной вытяжки, выделяя слабощелочную (рН 7,2—7,5), щелочную (рН 7,6—8,5) и сильнощелочную (рН>8,5) реакции.
Щелочность также является крайне неблагоприятным свойством почвы, так как угнетает развитие растений и микроорганизмов, усиливает пептизацию почвенных коллоидов и резко ухудшает физические свойства почвы.
Избыточную щелочность устраняют гипсованием почвы:
Вследствие изменения реакции почвенного раствора после известкования и гипсования почв урожай сельскохозяйственных культур значительно повышается.
Норму гипса определяют в зависимости от содержания в почве обменного натрия.
Источник