Культура тканей растения
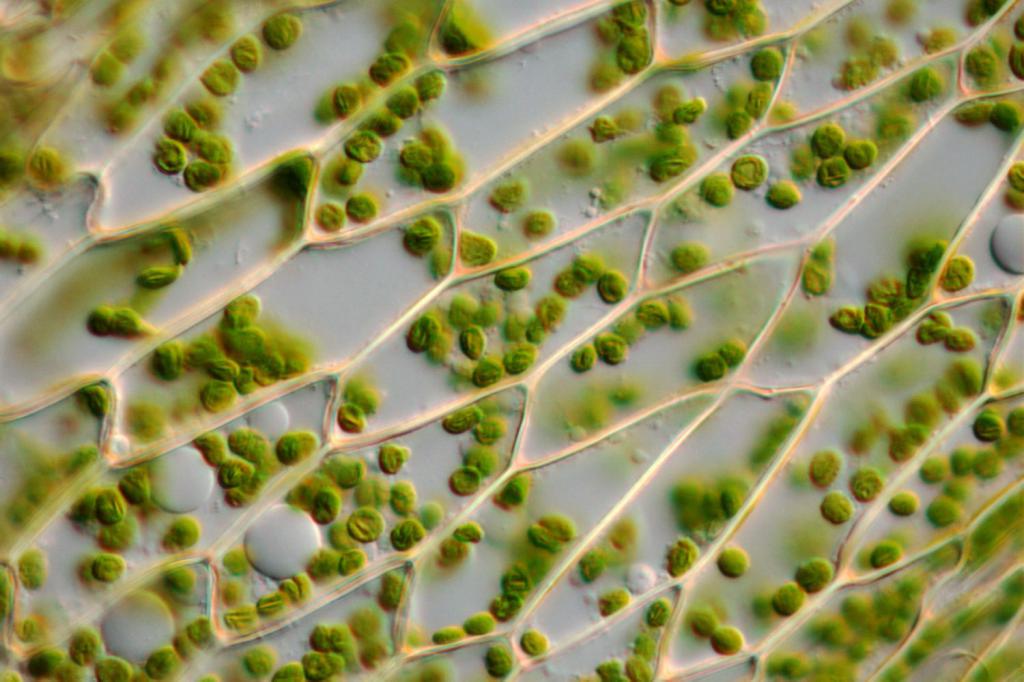
КУЛЬТУРА ТКАНЕЙ РАСТЕНИЯ — способность растительных клеток размножаться на искусственных питательных средах. Основана на выращивании в длительной пересадочной культура тканей растений в виде недифференцированной каллусной массы в стерильных условиях. В природе каллусообразование встречается в основном как реакция на повреждение растения, когда на месте раны образуется нарост, а в культуре ткани все растительные клетки превращаются в каллусные. Каллусы растений легко образуются на эксплантатах из различных органов: отрезков стебля, листа, корня, проростков семян, фрагментов паренхимы ткани клубня, органов цветка, плодов, зародышей и т. д.
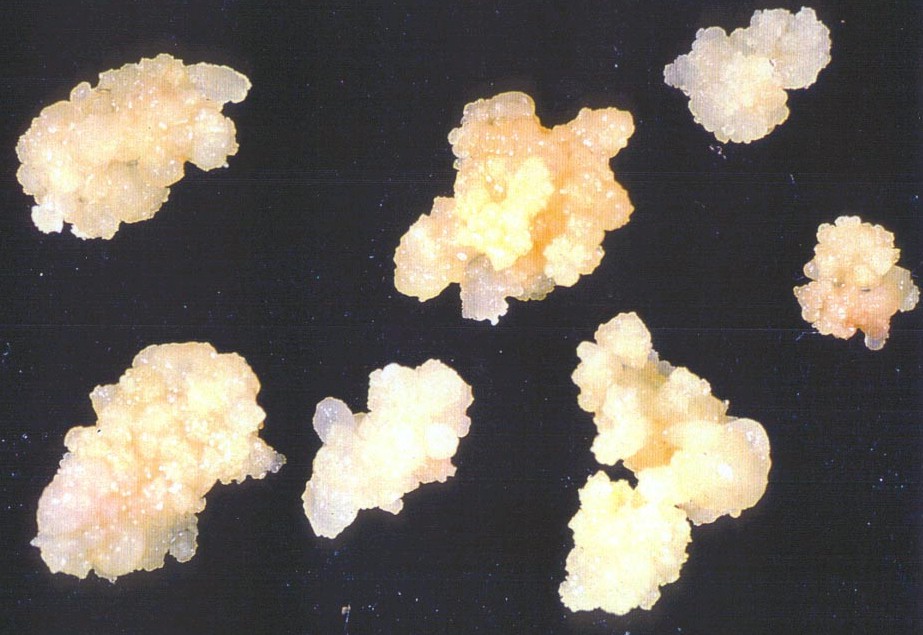
При помещении эксплантатов на питательную среду паренхимные клетки дедифференцируются, переходят к делению, образуя однородную недифференцированную биомассу, получившую название каллуса. В асептических условиях каллус отделяют и помещают на поверхность агаризованной питательной среды для дальнейшего роста. В результате получают культуру каллусной ткани, которую можно поддерживать неограниченно долго, периодически разделяя ее на трансплантаты и пересаживая на свежую питательную среду.
Одна из важных особенностей культура тканей растений — сохранение способности к синтезу вторичных веществ, свойственных данному виду, — алкалоидов, гликозидов, эфирных масел, стероидов и др. Эта особенность определяет практическую ценность культура тканей растений в области выращивания биомассы клеток как принципиально нового вида лекарственного сырья. В настоящее время технологии, основанные на культивировании тканей высших растений для получения редких и дорогостоящих веществ, включены в биотехнологические программы, создаваемые в России и во многих странах мира (см. Биотехнология).
Использование технологий, основанных на промышленном выращивании культур тканей продуцентов в качестве лекарственного сырья, имеет ряд преимуществ перед традиционными способами получения сырья. Однако использование такого сырья в фармации экономически выгодно только для продуктов, рыночная стоимость которых достаточно велика на международном рынке.
Культуру тканей растений в настоящее время выращивают главным образом двумя способами: поверхностным — на агаризованных питательных средах или различных гелеобразующих подложках и в жидкой питательной среде. В жидкой питательной среде каллус легко распадается на отдельные агрегаты клеток и дает начало суспензионной культуре. Известны два способа культивирования тканей в жидкой питательной среде: а) накопительное и б) непрерывное.
Важный фактор создания эффективной биотехнологической системы — подбор питательной среды, обеспечивающей потребности культуры ткани продуцента в химических компонентах, необходимых для оптимального биосинтеза целевого продукта. Обязательными компонентами питательных сред служат смеси минеральных солей (макро- и микроэлементов), фитогормоны, выступающие как факторы регуляции процессов клеточного деления и дифференциации, и, поскольку питание культур тканей гетеротрофно, источник углерода вводится в состав среды в виде сахарозы. Получение автотрофных культур тканей — пока задача будущего. При приготовлении питательных сред в качестве подложки используют агар-агар, образующий с водой гель. В последнее время в качестве подложки для культуры тканей растений испытывают и другие гелеобраующие вещества: силикагели, биогели, полиакриламидные гели, пенополиуретан и др.
Культура тканей растения служит источником значительной генетической изменчивости, которую называют сомаклональной. Благодаря этой особенности культуру ткани стали интенсивно использовать в генетико-селекционных исследованиях для улучшения свойств растений. Сомаклональная изменчивость представляет основу для получения клеточных линий и штаммов с высокой биосинтетической способностью. Для увеличения спектра изменчивости используют мутагенез и селекцию на клеточном уровне наиболее продуктивных клеточных линий. Получение мутантных клеточных линий в самом ближайшем будущем будет дополнено методами создания продуктивных штаммов путем гибридизации соматических клеток и генетической инженерии (см. Биотехнология).
В СССР развитие метода культуры тканей лекарственных растений связано с именем Р. Г. Бутенко. С 1967 г. по инициативе И. В. Грушвицкого в создана первая лаборатория культуры тканей лекарственных растений в Ленинградском химико-фармацевтическом институте.
Источник
Метод культуры тканей: сущность и применение
Метод культуры тканей служит одним из главных инструментов современных биотехнологий, позволяя решать практические проблемы физиологии, биохимии и генетики растений. Искусственное выращивание материала проводится с соблюдением определенных условий: стерилизации, температурного режима и с выдержкой в специальной питательной среде.
Сущность
Метод культуры тканей представляет собой их длительное сохранение и/или искусственное выращивание в лабораторных условиях на питательной среде. Эта технология позволяет создать биологическую модель для изучения различных процессов в клетках, существующих вне организма растений, человека и животных.
В основе размножения культуры тканей растений лежит свойство тотипотентности – способности клеток развиваться до целого организма. У животных это реализуется только в оплодотворенных яйцеклетках (за исключением некоторых видов кишечнополостных).
История развития
Первые попытки культивирования растительных тканей предпринимались немецкими учеными на рубеже XIX-XX вв. Несмотря на то, что они оказались неудачными, был сформулирован ряд идей, которые подтвердились в дальнейшем.
В 1922 г. В. Роббинс и В.Котте, независимо друг от друга, смогли вырастить кончики корней кукурузы и томатов на искусственной питательной среде. Детальная проработка техники культуры клеток и тканей началась в 30-е гг. XX в. Р. Готре и Ф. Уайт доказали, что при периодической пересадке тканевых культур в свежую питательную среду они могут расти неограниченно долго.
К 1959 г. в лабораторных условиях выращивалось уже 142 вида растений. Во второй половине XX в. началось также использование диспергированных (разобщенных) клеток.
Типы исследуемого материала
Различают 2 основных вида культур тканей растений:
- Получаемые без разрушения и сохраняющие характерные особенности, присущие живому организму.
- Извлекаемые в результате расщепления (химического, ферментативного или механического) из первичной ткани. Могут формироваться из одной или нескольких клеточных культур.
По способу выращивания выделяют следующие методы:
- на «кормящем слое», при котором вещество, стимулирующее рост тканей, выделяют делящиеся клетки того же вида растений;
- с использованием ткани-«няньки», которая находится рядом с культивируемыми клетками;
- применение питательной среды от обособленной делящейся клеточной группы;
- выращивание отдельных единичных клеток в микрокапле, насыщенной по составу.
Культивирование из отдельных клеток сопряжено с определенными трудностями. Для того чтобы искусственно «заставить» их делиться, они должны получать сигнал от соседних, активно функционирующих клеток.
Одним из основных видов тканей для физиологических исследований служат каллусные, возникающие при неблагоприятных внешних факторах (обычно при механическом травмировании). Они обладают способностью к утрате специфических характеристик, присущих исходной ткани. В результате клетки каллуса начинают активно делиться и образуются части растения.
Необходимые условия
Успешность метода культуры тканей и клеток зависит от следующих факторов:
- Соблюдение стерильности. Для проведения пересадок применяются специальные боксы с подачей очищенного воздуха, оснащенные ультрафиолетовыми лампами. Асептической обработке должны подвергаться инструменты и материалы, одежда и руки персонала.
- Использование специально подобранных питательных сред, содержащих источники углерода и энергии (обычно сахароза и глюкоза), микро- и макроэлементы, регуляторы роста (ауксины, цитокинины), витамины (тиамин, рибофлавин, аскорбиновая и пантотеновая кислота и другие).
- Соблюдение температурного (18-30° С), светового режима и влажности (60-70 %). Большинство каллусных культур тканей выращивают при рассеянном свете, так как они не содержат хлоропластов, но для некоторых растений требуется подсветка.
В качестве питательных сред в настоящее время применяют готовые коммерческие составы (Мурасиге и Скуга, Гамборга и Эвелега, Уайта, Као и Михайлюка и другие).
Достоинства и недостатки
Преимуществами метода культуры клеток и тканей являются:
- хорошая воспроизводимость полученных результатов;
- регулирование межклеточных взаимодействий;
- небольшой расход реагентов;
- генетическая однородность клеточных линий;
- возможность механизации процесса выращивания;
- контроль над условиями содержания клеток;
- низкотемпературное хранение живых культур.
К недостатком данной биотехнологии относят:
- необходимость соблюдения строгих условий асептики;
- нестабильность свойств клеток и возможность их нежелательного смешения;
- дороговизна химических реагентов;
- неполная равноценность культивируемых тканей и клеток в живом организме.
Применение
Метод культуры тканей используется для проведения исследований:
- процессов внутри клеток (синтез ДНК, РНК и белков, обмен веществ и влияние на него с помощью лекарственных препаратов);
- межклеточных реакций (прохождение веществ через клеточные мембраны, работа комплекса гормон-рецептор, способность клеток слипаться друг с другом, формирование гистологических структур);
- взаимодействия с окружающей средой (поглощение питательных веществ, заражение инфекциями, процессы зарождения и развития опухолей и другие);
- результатов генетических манипуляций с клетками.
Перспективными направлениями биологии и фармакологии, при развитии которых используется данная технология, являются:
- получение эффективных гербицидов, регуляторов роста для агрономических культур, биологически активных соединений для применения в производстве лекарственных препаратов (алкалоиды, стероиды и другие);
- направленный мутагенез, выведение новых гибридов, преодоление постгамной несовместимости;
- клональное размножение, которое позволяет получить большое количество генетически идентичных растений;
- выведение вирусоустойчивых и безвирусных растений;
- криоконсервация генофонда;
- реконструкция тканей, создание источников стволовых клеток (тканевая инженерия).
Источник
Культура тканей растений
Культура растительной ткани представляет собой набор методов, используемых для поддержания или выращивания растительных клеток, тканей или органов в стерильных условиях на питательной культуральной среде известного состава. Он широко используется для получения клонов растений методом, известным как микроразмножение . Различные методы культивирования тканей растений могут иметь определенные преимущества по сравнению с традиционными методами размножения, в том числе:
- Производство точных копий растений, которые дают особенно хорошие цветы, плоды или другие желательные качества.
- Для быстрого получения зрелых растений.
- Производство нескольких растений при отсутствии семян или необходимых опылителей для получения семян.
- Регенерация целых растений из генетически модифицированных растительных клеток.
- Производство растений в стерильных контейнерах, что позволяет их перемещать, что значительно снижает вероятность передачи болезней, вредителей и патогенов.
- Выращивание растений из семян, которые в противном случае имеют очень низкие шансы на прорастание и рост, например, орхидей и непентов .
- Для очистки определенных растений от вирусных и других инфекций и для быстрого размножения этих растений в качестве «очищенного стада» для садоводства и сельского хозяйства.
Культура тканей растений основана на том факте, что многие клетки растений обладают способностью регенерировать целое растение ( тотипотентность ). Единичные клетки, клетки растений без клеточных стенок ( протопласты ), кусочки листьев, стеблей или корней часто можно использовать для создания нового растения на питательной среде с учетом необходимых питательных веществ и гормонов растений .
Содержание
Методы [ править ]
Подготовка растительной ткани для тканевой культуры выполняется в асептических условиях в воздухе, отфильтрованном HEPA, обеспечиваемом камерой с ламинарным потоком . После этого ткань выращивают в стерильных контейнерах, таких как чашки Петри или колбы, в камере выращивания с контролируемой температурой и интенсивностью света. Живые растительные материалы из окружающей среды естественным образом загрязнены на своей поверхности (а иногда и внутри) микроорганизмами , поэтому их поверхности стерилизуют в химических растворах (обычно спирте и гипохлорите натрия или кальция ) [1] перед подходящими образцами (известными как эксплантаты).) принимаются. Затем стерильные эксплантаты обычно помещают на поверхность стерильной твердой культуральной среды, но иногда их помещают непосредственно в стерильную жидкую среду, особенно когда требуются культуры суспензий клеток. Твердые и жидкие среды обычно состоят из неорганических солей плюс несколько органических питательных веществ, витаминов и гормонов растений. Твердые среды готовят из жидких сред с добавлением гелеобразующего агента, обычно очищенного агара.
Состав среды, особенно растительные гормоны и источник азота (нитрат по сравнению с солями аммония или аминокислотами), оказывают сильное влияние на морфологию тканей, которые растут из исходного эксплантата. Например, избыток ауксина часто приводит к разрастанию корней, а избыток цитокинина может давать побеги . Баланс ауксина и цитокинина часто вызывает неорганизованный рост клеток или каллус., но морфология нароста будет зависеть от вида растения, а также от состава среды. По мере роста культур кусочки обычно отрезают и пересеивают на новую среду, чтобы обеспечить рост или изменение морфологии культуры. Навыки и опыт специалиста по культуре тканей важны для решения, какие части культивировать, а какие выбросить.
По мере прорастания побегов из культуры их можно срезать и укоренять с помощью ауксина для получения проростков, которые, когда они созреют, могут быть перенесены в почву для дальнейшего роста в теплице как обычные растения. [2]
Пути регенерации [ править ]
Специфические различия в регенерационном потенциале разных органов и эксплантов имеют разные объяснения. Существенные факторы включают различия в стадии клеток в клеточном цикле , доступность или способность транспортировать эндогенные регуляторы роста и метаболические возможности клеток. Наиболее часто используемые тканевые эксплантаты — это меристематические концы растений, такие как кончик стебля, кончик пазушных почек и кончик корня. Эти ткани обладают высокой скоростью деления клеток и либо концентрируют, либо производят необходимые регулирующие рост вещества, включая ауксины и цитокинины.
Эффективность регенерации побегов в культуре тканей обычно является количественным признаком, который часто варьируется между видами растений и внутри одного вида растений среди подвидов, разновидностей, культурных сортов или экотипов . Следовательно, регенерация тканевой культуры может стать сложной, особенно когда необходимо разработать множество процедур регенерации для разных генотипов одного и того же вида.
Три общих пути регенерации культуры тканей растений — это размножение из уже существующих меристем (культура побегов или узловая культура), органогенез и незиготический эмбриогенез .
Размножение побегов или узловых сегментов обычно выполняется в четыре этапа для массового производства проростков посредством вегетативного размножения in vitro, но органогенез — это распространенный метод микроразмножения, который включает регенерацию тканей придаточных органов или пазушных почек, прямо или косвенно из эксплантатов. Незиготный эмбриогенез — заслуживающий внимания путь развития, который очень сравним с таковым у зиготических эмбрионов, и это важный путь для производства сомаклональных вариантов, развития искусственных семян и синтеза метаболитов. Из-за одноклеточного происхождения незиготных зародышей они предпочтительны в нескольких системах регенерации для микроразмножения, манипуляции с плоидностью, переноса генов и производства синтетических семян. Тем не менее, регенерация тканей с помощью органогенеза также оказалось полезным для изучения регуляторных механизмов развития растений.
Выбор эксплантата [ править ]
Ткань, полученная из культивируемого растения, называется эксплантатом.
Эксплантаты могут быть взяты из многих различных частей растения, включая части побегов, листьев, стеблей, цветов, корней, отдельных недифференцированных клеток, а также из многих типов зрелых клеток, при условии, что они все еще содержат живую цитоплазму и ядра и способны де дифференцироваться. и возобновить деление клеток. Это дало начало концепции тотипотентности растительных клеток. [3] [4] Однако это не верно для всех клеток или для всех растений. [5] У многих видов эксплантаты разных органов различаются по скорости роста и регенерации, а некоторые вообще не растут. Выбор материала эксплантата также определяет, являются ли проростки, полученные с помощью культуры ткани, гаплоидными или диплоидными.. Кроме того, при использовании неподходящих эксплантов увеличивается риск микробного заражения.
Первый метод, включающий меристемы и индукцию множественных побегов, является предпочтительным методом для индустрии микроразмножения, поскольку риски сомаклональной изменчивости (генетическая изменчивость, индуцированная в культуре ткани) минимальны по сравнению с двумя другими методами. Соматический эмбриогенез — это метод, у которого есть потенциал в несколько раз выше по скорости размножения, и его можно использовать в системах жидких культур, таких как биореакторы.
Некоторые эксплантаты, такие как кончик корня , трудно изолировать, и они загрязнены почвенной микрофлорой, что становится проблематичным в процессе культивирования тканей. Определенная микрофлора почвы может образовывать тесные ассоциации с корневой системой или даже расти внутри корня. Частицы почвы, прикрепленные к корням, трудно удалить, не повредив корни, что может привести к атаке микробов. Эта ассоциированная микрофлора обычно разрастается в среде для культивирования ткани до того, как произойдет значительный рост растительной ткани.
Некоторые культивируемые ткани медленно растут. Для них будет два варианта: (i) Оптимизация питательной среды; (ii) Выращивание высокочувствительных тканей или разновидностей. [6] Некроз может испортить культивируемые ткани. Как правило, сорта растений различаются по восприимчивости к некрозу культур тканей. Таким образом, с этим можно справиться путем культивирования высокочувствительных сортов (или тканей). [6]
Воздушные (надземные) эксплантаты также богаты нежелательной микрофлорой. Однако их легче удалить из эксплантата осторожным промыванием, а оставшуюся часть обычно можно убить стерилизацией поверхности. Большая часть поверхностной микрофлоры не образует плотных ассоциаций с тканями растений . Такие ассоциации обычно можно обнаружить при визуальном осмотре в виде мозаики, обесцвечивания или локализованного некроза на поверхности эксплантата.
Альтернативой для получения незагрязненных эксплантатов является взятие эксплантов из сеянцев, выращенных в асептических условиях из семян, стерилизованных с поверхности. Твердая поверхность семян менее проницаема для проникновения агрессивных поверхностных стерилизующих агентов, таких как гипохлорит , поэтому приемлемые условия стерилизации, используемые для семян, могут быть гораздо более жесткими, чем для вегетативных тканей.
Растения, культивируемые тканью, являются клонами . Если исходное материнское растение, используемое для получения первых эксплантатов, восприимчиво к патогену или условиям окружающей среды, вся культура будет подвержена той же проблеме. И наоборот, любые положительные черты также останутся в рамках этой линии.
Приложения [ править ]
Культура тканей растений широко используется в растениеводстве, лесоводстве и садоводстве. Приложения включают:
- Коммерческое производство растений, используемых в качестве горшечных растений, ландшафтов и цветоводов, при котором используются меристемы и культура побегов для получения большого количества идентичных особей.
- Для сохранения редких или исчезающих видов растений. [7]
- Селекционер может использовать культуру ткани к клеткам экрана , а не для растений выгодных символов, например гербицидом сопротивления / толерантности.
- Масштабный рост растительных клеток в жидкой культуре в биореакторах для производства ценных соединений, таких как вторичные метаболиты растительного происхождения и рекомбинантные белки, используемые в качестве биофармацевтических препаратов . [8]
- Для скрещивания отдаленно родственных видов путем слияния протопластов и регенерации нового гибрида .
- Быстро изучить молекулярные основы физиологических, биохимических и репродуктивных механизмов растений, например, отбор растений, устойчивых к стрессу, in vitro. [9]
- Для перекрестного опыления отдаленно родственных видов и затем культивирования тканей полученного эмбриона, который в противном случае обычно погиб бы (Спасение эмбрионов).
- Для хромосом удвоения и индукции полиплоидии , [10] , например , двойные гаплоиды, тетраплоиды и другие формы полиплоидов . Обычно это достигается применением антимитотических средств, таких как колхицин или оризалин .
- В качестве ткани для трансформации с последующим либо краткосрочным тестированием генетических конструкций, либо регенерацией трансгенных растений.
- Определенные методы, такие как культивирование верхушек меристемы, можно использовать для получения чистого растительного материала из зараженного материала, такого как сахарный тростник [11], картофель и многие виды мягких фруктов.
- Может быть получено производство идентичных стерильных гибридных видов.
- Крупномасштабное производство искусственных семян посредством соматического эмбриогенеза [12]
- Синтетические семена — соматический эмбрион инкапсулируется искусственным эндоспермом и искусственной оболочкой семян.
Лаборатории [ править ]
Хотя некоторые производители и питомники имеют свои собственные лаборатории по размножению растений методом тканевых культур, ряд независимых лабораторий предоставляют услуги по размножению на заказ. В разделе «Обмен информацией о культурах тканей растений» перечислены многие коммерческие лаборатории по культуре тканей. Поскольку культивирование тканей растений — очень трудоемкий процесс, это будет важным фактором при определении того, какие растения будут коммерчески жизнеспособными для размножения в лаборатории.
Источник