Методы культивирования вирусов



Для выращивания клеточных культур используют питательные среды сложного состава, включающие источники энергии, минеральные вещества, аминокислоты, витамины и другие
 |
факторы роста. Клетки чрезвычайно чувствительны к изменению рН среды. Для контроля рН в среды добавляют индикатор. Большинство клеточных:, культур растет в виде монослоя (пласта, состоящего из одного слоя клетк), прочно прикрепляясь к поверхности контейнера для культивирования — пробирки, пластикового планшета или матрас) (флакон 4-гранной формы). Некоторые типы клеток способы расти также в суспензии.
Приготовление первичной культты клеток включает несколько последовательных этапов: измельчение ткани, разъединение клеток путем трипспозиции отмывание полученной однородной суспензии изолированных клеток от трипсина с последующим суспендированием клеток в питательной среде, обеспечивающей их рост (например, среде 199 с добавлением телячьей сыворотки крови). При оседании клетки довольно прочно прикрепляются к стенке пробирки или флакона, по которой распространяются в виде Монослоя. После получения монослоя жизнеспособной культуры клеток ее заражают материалом, содержащим вирусы. Упомянутые микробы проникают внутрь клеток, где и размножаются. В культурах клеток удается культивировать большинство вирусов, вызывающих заболевания человека.
Внутриклеточные паразиты оказывают цитопатическое действие (ЦПД) на клетки, в которых происходит их репродукция. ЦПД может проявляться деструкцией (лизисом) зараженных клеток, изменением их морфологии (изменением размеров и формы самой клетки, появлением вакуолей или включений, представляющих собой внутриклеточные скопления вирусов, образованием ощцития) и нарушением их функций.
Куриные эмбрионы. Куриные эмбрионы по сравнению с культурами клеток значительно реже бывают контаминированы вирусами, а также обладают сравнительно высокой жизнеспособностью и устойчивостью к различным воздействиям. Они пригодны для некоторых вирусов, патогенных для человека.
Для получения чистых культур риккетсий, хламидий и ряда вирусов в диагностических целях, а. также для приготовления разнообразных препаратов (вакцины, диагностикумы) используют 8—12-дневные куриные эмбрионы. К недостаткам данного метода относятся невозможность обнаружения исследуемого микроорганизма без предварительного вскрытия эмбриона, а также наличие большого количеству белков и других соединений, затрудняющих последующую очистку возбудителя при изготовлении различных препаратор
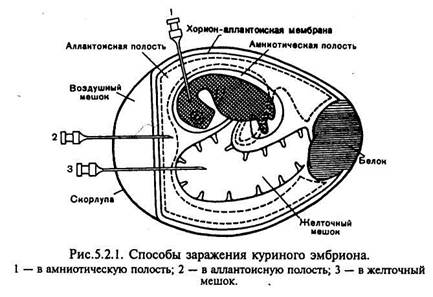
Для заражения куриных эмбрионов исследуемый материал вводят в аллантоисную и амниотическую полости, на хорион-аллантоисную оболочку или в желточный мешок куриного эмбриона (рис.). Для заражения в аллантоисную полость в скорлупе над воздушной камерой (границы ее заранее обводят карандашом при просвечивании яйца) проделывают небольшое отверстие с помощью ножниц, скальпеля или специального буравчика. Шприцем вводят 0,1—0,2 мл вируссодержащего материала на глубину 2—3 мм ниже границы воздушной камеры. Отверстие в скорлупе заливают расплавленным парафином. Вскрытие зараженных эмбрионов производят в сроки максимального накопления вируса (через 48—72 ч инкубации при 37 °С). После обработки спиртом и 2 % раствором йода скорлупу рассекают ножницами немного выше очерченной карандашом границы воздушной камеры, наклоняя яйцо так, чтобы избежать попадания скорлупы в полость. Скорлупу отбрасывают, осторожно снимают ее оболочку и рассматривают хорион-аллантоисную оболочку вокруг места заражения, отмечая наличие или отсутствие очагов поражения — геморрагии, бляшек и др. Затем пастеровской пипеткой прокалывают хорион-аллантоисную оболочку в участке, свободном от сосудов, и отсасывают аллантоисную жидкость. После этого извлекают хорион-аллантоисную оболочку, дважды промывают ее изотоническим раствором хлорида натрия, помещают в чашку Петри и отмечают на черном фоне наличие специфических поражений.
Лабораторные животные. Видовая чувствительность животных, их возраст определяют репродуктивную способность вирусов. Во многих случаях только новорожденные животные чувствительны к тому или иному вирусу (например, мыши-сосунки к вирусам Коксаки). Преимущество метода культивирования облигатных внутриклеточных паразитов в организме лабораторных животных перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре клеток или эмбрионе. К его недостаткам относятся высокая вероятность контаминации организма подопытных животных посторонними вирусами и микоплазмами, а также необходимость последующего заражения культуры клеток для получения чистой культуры данного вируса, что увеличивает сроки исследования.

Методы индикации вирусов. Для демонстрации присутствия вируса в клеточной культуре используют несколько методов.
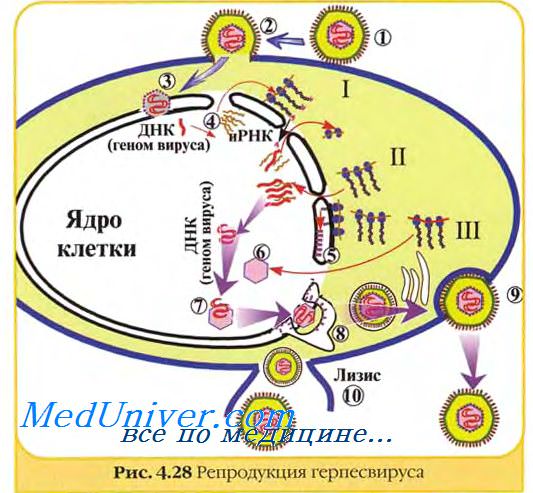
I. О размножении (репродукции) вирусов в культуре клеток судят по цитопаттескому действию (ЦПД), которое может быть обнаружено микроскопически по морфологическим изменениям клеток.
а) Часть таких клеток погибает и отслаивается от стенок пробирки. б)Вирусные частицы, освобождающиеся при разрушении одних клеток, инфицируют другие, которые через некоторое время также погибают. В результате вместо сплошного клеточного монослоя остаются лишь отдельные клеточные островки.
Характер ЦПД, вызванного разными вирусами, неодинаков. При репродукции одних вирусов (парамиксовиру-сы, герпесвирусы) наблюдается слияние клеток с образованием синцития, других (энтеровирусы, реовирусы) — сморщивание и деструкция клеток, третьих (аденовирусы) — агрегация клеток. ЦПД вирусов оценивают в динамике, просматривая культуру клеток под микроскопом в разные сроки после ее заражения вируссодержащим материалом. Некоторые вирусы (энтеровирусы, герпесвирусы) вызывают ЦПД в течение 1—2 сут, другие — в более поздние сроки (на 4^-6-й день). Характер ЦПД используют как для обнаружения вирусов (индикации), так и ориентировочной идентификации, т.е. определения их видовой принадлежности.
Некоторые вирусы можно обнаружить и идентифицировать по включениям, которые они образуют в ядре или цитоплазме зараженных клеток. Форма включений различна, а размеры колеблются от 0,25 до 25 мкм. Они представляют собой места скопления вирусных частиц и могут быть выявлены в препаратах, приготовленных из зараженной ткани и окрашенных флюорохромами. В последнем случае используют люминесцентную микроскопию.
Для исследования морфологии контаминированных клеток используют специальный инвертированный микроскоп, у которого осветитель располагается сверху, а объективы — снизу от предметного столика. С помощью такого прибора можно оценивать морфологию клеток, растущих в виде монослоя на поверхности контейнера для культивирования. Морфологические изменения клеток выявляют при микроскопическом исследовании культуры с помощью объектива 8х или 40х. При сравнении клеточного монослоя, инфицированного вирусом, с незараженными клетками в контрольной пробе отмечают полное или островковое разрушение пласта клеток либо другие изменения, которые характеризуют ЦПД вируса. Для более детального изучения ЦПД в контейнер для культивирования помещают покровное стекло, на котором образуется монослой. В дальнейшем стекло извлекают, зараженные клетки фиксируют и готовят микроскопический препарат, который окрашивают флюорохромами и т.д.) и изучают иммерсионным методом.
ЦПД вирусов можно также продемонстрировать с помощью «цветной пробы»: метаболически активные клетки культуры в ходе жизнедеятельности выделяют кислые продукты, что вызывает изменение цвета индикатора, присутствующего в культуральной среде. При репродукции вируса клетки утрачивают способность к метаболизму и погибают, поэтому окраска среды с течением времени не меняется.
II. Реакцию гемадсорбции применяют для индикации гемаг-глютинирующих вирусов. Реакция основана на способности поверхности клеток, в которых репродуцируются такие вирусы, адсорбировать эритроциты. Для постановки реакции гемадсорбции в культуру клеток, зараженных вирусами, добавляют взвесь эритроцитов и после некоторого времени контакта клетки промывают изотоническим раствором хлорида натрия. На поверхности пораженных вирусами клеток остаются прилипшие эритроциты.
III. Реакцию гемагглютинации (РГА) применяют для обнаружения гемагглютинирующих вирусов в культуральной жидкости зараженной культуры клеток либо хорионаллантоисной или амниотической жидкости куриного эмбриона. Гемагглютинацию — «склеивание» эритроцитов разных видов животных (кур, гусей, морских свинок) — вызывают вирусы, содержащие в оболочке гемагглютинин.Для постановки реакции гемагглютинации к исследуемому материалу добавляют взвесь эритроцитов. В присутствии вирусов происходит агглютинация эритроцитов.
После вскрытия куриного эмбриона аллантоисную жидкость отсасывают и разливают по 0,5 мл в пробирки или лунки плексигласовой пластины (для контроля берут 0,5 мл такой же жидкости незараженного эмбриона). Затем добавляют по 0,2 мл 1 % суспензии отмытых куриных эритроцитов и выдерживают при комнатной температуре. Результаты реакции учитывают через 40 мин после оседания эритроцитов: (++++) — выраженная гемагглютинация — тонкая пленка склеившихся эритроцитов на дне пробирки, имеющая вид зонтика, (+++) — наличие просветов в пленке, (++) — наличие пленки с фестончатыми краями из склеившихся эритроцитов, (+) — хлопьевидный осадок эритроцитов, окруженный зоной комочков агглютинированных эритроцитов, (—) — резко очерченный осадок эритроцитов, неотличимый от контроля. Наличие гемагглютинации в опытных пробирках при ее отсутствии в контрольных указывает на содержание вируса в исследуемой жидкости. Для определения титра РГА ставят реакцию с разведениями вируссодержащей жидкости 10″ 1 , 10
3 и т.д. За титр РГА принимают максимальное разведение, при котором наблюдается гемагглютинация (++). Титр РГА характеризует активность вируса и используется при постановке РТГА.
Для количественного обнаружения вирусных частиц используют методы титрования.Титр вируса можно определить в реакции гемагглютинации с 10-кратными разведениями культуральной среды, или материала из куриного эмбриона, или по ЦПД в культуре клеток. В последнем случае клетки культуры заражают 10-кратными разведениями материала, содержащего вирус. После 6—7-дневной инкубации их просматривают на наличие ЦПД. За титр вируса принимают наибольшее разведение, которое вызывает ЦПД в 50 % зараженных культур. Титр вируса выражают количеством цитопатических (инфекционных) доз (ИД5о)
—Более точным количественным методом учета отдельных вирусных частиц является метод бляшек. Культуру клеток заражают вирусом и покрывают тонким слоем агара. После инкубирования посевов в течение нескольких суток на поверхности агара появляются просветленные участки определенной формы (бляшки), представляющие собой участки погибших клеток в сплошном монослое культуры клеток. Каждая бляшка образуется при размножении одной вирусной частицы и хорошо заметна в виде круглого светлого участка на красном фоне клеток, прижизненно окрашенных нейтральным красным. Титр вируса, установленный этим методом, выражают числом бляшкообразующих единиц (БОЕ) в 1 мл. Размеры, морфология и сроки появления бляшек различаются не только у разных видов вирусов, но и у отдельных штаммов одного и того же вида. Перечисленные признаки используют для селекции штаммов и получения так называемых чистых линий вирусов.
Источник
Культуры клеток для выращивания вирусов
В течение многих лет разрабатывались методы выращивания небольших количеств клеток животных в лабораторных условиях. Однако наладить массовое культивирование таких клеток оказалось не простой задачей. Способ выращивания, характер используемой среды, методы управления и контроля в значительной степени зависят от типа выращиваемых клеток. Все культивируемые клетки первоначально получают от животных путем механической или ферментативной дезагрегации нормальных или малигинизированных тканей либо с помощью перфузии in vivo.
Тканевые эксплантаты или клетки, помещенные в подходящую среду, развиваются в первичные культуры с «нормальным» (диплоидным) или «ненормальным» (трансформированным или происходящим из опухоли) карио-типом. Классификация культивируемых клеток представляет определенные трудности. Различают первичные культуры клеток и клеточные линии. В производстве вакцин используют, главным образом, три типа клеток; первичные; диплоидные клеточные линии; непрерывные (постоянные) клеточные линии. Первичная культура — это культура, происходящая от клеток тканей или органов, взятых непосредственно из организма.
Культура считается первичной до тех пор, пока ее не субкультивируют, после чего она становится клеточной линией.
Первичные культуры обычно получают трипсинизацией тканей куриных эмбрионов или тканей (чаще всего почек), взятых от других видов здоровых животных. Возраст используемых эмбрионов может значительно различаться и влиять на выход и жизнеспособность клеток. Для более полного контроля доноров ткани их следует брать из SPF-хозяйств.
Первичные культуры клеток почек зеленых мартышек обычно используют для приготовления полиовирусной вакцины. Поскольку обезьяны являются очень дорогим объектом для увеличения выхода клеток почки дезагрегируют методом перфузионной трипсинизации in vivo, а затем первичную культуру выращивают на микроносителях. Для изготовления других медицинских вакцин широко применяют первичную культуру клеток почки кроликов, телят и других животных. Для изготовления вакцин, используемых в ветеринарной медицине, чаще всего применяют первичные культуры клеток куриных эмбрионов и почек естественного хозяина или восприимчивых животных.
Первичные культуры в зависимости от типа ткани и условий выращивания значительно различаются. Некоторые из них погибают через несколько дней после посева, тогда как другие могут длительно сохраняться в культуре без заметных морфологических и биохимических изменений. С момента приготовления первичной культуры до остановки роста клеток и гибели культуры после серийных пересевов проходит от нескольких недель до нескольких месяцев. Клетки эмбрионального происхождения при культивировании обычно сохраняют жизнеспособность более продолжительное время.
Линия клеток — первичная культура, со времени получения субкультуры клеточные линии могут иметь ограниченный срок жизни in vitro (например, диплоидные фибробласты человека и животных), а могут размножаться in vitro неограниченно долго. В последнем случае их называют постоянными, стабильными или непрерывными клеточными линиями.
Линия диплоидных клеток — клеточная линия, в которой, по крайней мере, 75% клеток обладает кариотипом нормальных клеток исходного вида. Следует отметить, что диплоидный набор хромосом не обязательно эквивалентен диплоидному кариотипу, поскольку существуют ситуации, при которых клетка может терять один тип хромосом и приобретать другой. Следовательно, кариотип клетки изменился, а диплоидный набор хромосом сохранился. Такие клетки следует считать «псевдодиплоидными». Диплоидные культуры фибробластов человека могут пассироваться многократно. Такие культуры часто называют штаммами. Некоторые из них могут сохранять диплоидный статус в течение 80 и даже более популяционных делений.
В связи с трудностями получения соответствующих количеств первичных культур клеток почки зеленой мартышки (по причине стоимости) и преимуществами использования предварительно изученных клеточных культур для производства вакцины против полиомиелита и других вакцин были лицензированы диплоидные линии клеток WI-38 и MRC-5. Существуют сомнения в том, что ростовые свойства и продуктивность диплоидных клеток варьируют. Даже хорошо охарактеризованные диплоидные линии клеток ведут себя неодинаково при работе с ними различных исследователей.
Штамм клеток — популяция однородных клеток (по одному или нескольким маркерам), сохраняющая специфические свойства в течение ограниченного периода культивирования. Штамм клеток может происходить из первичной культуры либо от линии клеток, получающих специфические свойства путем селекции или клонирования.
Линия гетероплоидных клеток. Этот термин означает, что клеточная линия имеет менее 75% клеток с диплоидным набором хромосом. Этот термин не означает, что клетки являются злокачественными или способны расти до бесконечности.
Источник