Приложение N 3. Методика проверки питательных сред на их пригодность для культивирования менингококка
к распоряжению КЗ и ЦГСЭН
Методика
проверки питательных сред
на их пригодность для культивирования менингококка
Проверке подлежат все виды питательных сред, используемые в лаборатории для:
— определения его биологических свойств;
— хранения выделенных штаммов;
Проверка питательных сред осуществляется количественным и качественным методами.
1. Проверка 20% сывороточного агара, предназначенного для выращивания менингококка.
Осуществляется количественным методом с применением суточной свежевыделенной культуры (не более трех генераций на 0,2% полужидком агаре), т.е. обладающей высокой избирательностью и не утратившей своей прихотливости в процессе лабораторного культивирования. Лучше использовать эталонные штаммы менингококка, которые выписываются из Государственного НИИ стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича. В случае использования высушенного эталонного штамма, ампула с сухой культурой стерильно вскрывается, ее содержимое суспензируется в 1 мл. стерильного физиологического раствора, предварительно подогретого в термостате при 37 С и 8-10 капель полученной взвеси засевается на чашку с 20% сывороточным агаром для проверки чистоты культуры. Если суточная культура менингококка оказалась чистой (окраска по Граму в модификации Калины), ее используют для проверки пригодности питательных сред.
По оптическому стандарту мутности 10 ЕД. готовят взвесь культуры, содержащей один млрд. микробных клеток в 1 мл. Затем в подогретом физиологическом растворе взвесь менингококка титруют по схеме.
| N пробирки | I | II | III | IV | V | VI |
| Физиологический раствор в мл. | 4,5 | 4,5 | 4,5 | 4,5 | 4,5 | 4,5 |
| 1 млрд. взвесь суточной менингококковой культуры в мл. | 0,5 -> | 0,5 -> | 0,5 -> | 0,5 -> | 0,5 -> | 0,5 -> |
| Полученное разведение | -1 10 | -2 10 | -3 10 | -4 10 | -5 10 | -6 10 |
| Количество микробных клеток (живых и мертвых) в 1 мл. | 100 млн. | 10 млн. | 1 млн. | 100 тыс. | 10 тыс. | 1 тыс. |
| Объем высеваемого на чашку материала в мл. | 0,1 | 0,1 | 0,1 | |||
| Количество высеваемых клеток (условно) | 10.000 | 1000 | 100 | |||
| Вероятное число Колоний, которое должно вырасти на чашке при достаточной годности питательной среды | >1000 | >100 | 5-10 (>10) |
Все разведения делаются отдельными стерильными пипетками. При этом каждой новой стерильной пипеткой делается перемешивание взвеси (не менее 5 раз), перенос 0,1 мл взвеси в следующую пробирку без погружения в физиологический раствор и сбрасывание. Из трех последних разведении делаются высевы по 0,1 мл. взвеси на 3 чашки с 20% сывороточным агаром без добавления антибиотика, на 3 чашки 20% сывороточного агара с добавлением антибиотика для подавления роста грам-положительной флоры (ристомицин или линкомицин) и на 3 чашки с агаром без добавления сыворотки. Опыт считается поставленным правильно при следующих положениях:
— на чашках с агаром без добавления сыворотки роста менингококка быть не должно (проверка избирательного отношения менингококка к питательным средам);
— на чашках с 20% сывороточном агаром в зависимости от разведения должно вырасти от 10-20 до 1000-2000 колоний;
— на чашках с 20% сывороточным агаром с добавлением антибиотика рост менингококка не должен угнетаться и в зависимости от разведения должно вырасти от 10-20 до 1000-2000 колоний;
— культура считается правильно разведенной, если количество выросших колоний соответствует разведениям: 1:10, 1:100 и т.д.
Оценка качества среды
Исходя из того, что в агаровом смыве большая часть клеток к 24 часам с момента постановки опыта мертва, удовлетворительными будут результаты при росте на чашках 20-30% микробов от оптического стандарта. Таким образом, пригодными для культивирования менингококка будут те среды, на которых при засеве 0,1 мл. взвеси вырастает:
Количественному контролю подлежит каждая новая серия агара, используемого в качестве основы для сывороточного и каждая новая серия нормальной лошадиной сыворотки.
II. Проверка пригодности сред, предназначенных для изучения
биохимических свойств менингококка.
Для изучения биохимических свойств менингококка используются плотные питательные среды с 1% одного из сахаров (глюкоза, мальтоза, левулеза или фруктоза, сахароза и лактоза), с 20% нормальной лошадиной сыворотки и с индикатором фенол-рот.
Проверка проводится качественным методом.
Следует использовать следующие непатогенные нейссерии, которые отбираются в процессе работы по бактериологической диагностике менингококковой или гнойно-воспалительных инфекций и стандартную культуру менингококка:
— N.sicca или N.perflava-ферментирующие сахара: глюкозу, мальтозу, левулезу и сахарозу;
— N.flavescens-не ферментирующую сахара: глюкозу, мальтозу, левулезу, сахарозу и лактозу;
При посеве нейссерии плотные питательные среды, в которых происходит сбраживание углевода, должны давать отчетливое пожелтение. В тех случаях, когда углевод не сбраживается, среда окрашивается в малиновый цвет, за счет расщепления сыворотки и образования щелочных продуктов.
III. Проверка питательных сред, предназначенных для изучения
прихотливости менингококков и способности образовывать полисахарид
на агаре с 5% сахарозы
Прихотливость менингококка изучается на питательных средах:
— содержащих 0,2% желчи;
— не содержащих 20% нормальной лошадиной сыворотки.
Способность образовывать полисахарид- на плотном питательном агаре с 20% нормальной лошадиной сыворотки и с 5% сахарозы без индикатора.
Анологично п. II в процессе работы отбираются нейссерии, которые растут в присутствии 0,2% желчи (N.sicca или N.perflava), на бессывороточном агаре и образуют полисахарид на 5% сывороточном агаре. Эти нейссерии и стандартная культура менингококка используются при оценке пригодности питательных сред. Метод контроля — качественный.
IV. Проверка пригодности 0,2% полужидкого агара, предназначенного для
хранения штаммов менингококка и непатогенных нейссерии.
Проверка пригодности проводится качественным методом. Посев менингококка осуществляется множественными укольчиками бактериологической петлей в верхнюю часть столбика агара. Через 18 часов должен быть хорошо заметный рост культуры в виде кольца по всей поверхности агара. Менингококк должен оставаться жизнеспособным в 0,2% полужидком агаре под вазелиновым маслом не менее, чем месяц со дня посева.
Качественному контролю по п.п.II, III, IV подвергается каждая варка питательной среды.
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
Источник
Менингококк среда для выращивания
Глава 16. Менингококки
Род Neisseria включает два вида микробов, патогенных для человека: N. meningitidis и N. gonorrhoeae. Neisseria meningitidis были выделены из цереброспинальной жидкости больного Вексельбаумом (1887).
Морфология. Менингококки — это парные кокки, состоящие из двух бобовидных кокков, лежащих вогнутыми сторонами друг к другу, наружные стенки у них выпуклые (см. рис.4). Размер каждого кокка 0,6-0,8 × 1,2-1,5 мкм. Они полиморфны. Менингококки неподвижны, не имеют спор, образуют капсулу. Грамотрицательны. В чистых культурах располагаются тетрадами и в виде отдельных кокков без определенного порядка, а в мазках, приготовленных из спинномозговой жидкости, чаще располагаются попарно. В гнойном материале находятся внутри лейкоцита.
Культивирование. Менингококки — аэробы. Они требовательны к питательным средам, размножаются только на средах, содержащих нативный белок (сыворотку, кровь). Растут при температуре 36-37° С (при 25° С рост прекращается), рН среды 7,4-7,6. Для их размножения необходима влажная среда и повышенное количество углекислоты (фактор, стимулирующий их рост). Посев следует производить на свежеприготовленную среду.
На плотных питательных средах менингококки образуют небольшие 2-3 мм в диаметре, нежные, полупрозрачные, голубоватые, вязкие колонии. В бульоне с сывороткой менингококки дают легкую муть и небольшой осадок. Свежевыделенные штаммы в S-форме. Старые культуры могут диссоциировать, образовывать шероховатые R-формы колоний.
Ферментативные свойства. Биохимически менингококки мало активны. Они расщепляют глюкозу и мальтозу с образованием кислоты. Протеолитические свойства у них не выражены (не створаживают молоко, желатин не разжижают).
Патогенность менингококков обусловливается наличием капсулы, которая препятствует фагоцитозу, пи лей, способствующих прикреплению микроба к поверхности эпителиальных клеток, и образованием ферментов: гиалуронидазы и нейраминидазы.
Токсинообразование. При разрушении бактериальных клеток высвобождается сильный термоустойчивый эндотоксин, который является липополисахаридом клеточной стенки. При заболевании он обнаруживается в крови и в спинномозговой жидкости больных. Тяжесть заболевания часто зависит от количества накопившегося токсина.
Антигенная структура. По полисахаридному (капсульному) антигену менингококки разделяют на серогруппы: А, В, С, D, X, Y U-135 29E (всего девять серогрупп).
Согласно международной классификации основными группами являются А, В и С. Менингококки группы А часто вызывают генерализованные процессы и имеют наибольшее эпидемиологическое значение. Менингококки групп В и С вызывают спорадические заболевания. Остальные серогруппы мало изучены.
Устойчивость к факторам окружающей среды. Менингококки малоустойчивы. Температура 70° С губит их через 2-3 мин, 55° С — через 5 мин. В отличие от других кокков этой группы они плохо переносят низкую температуру, особенно чувствительны к температурным колебаниям.
Обычные концентрации дезинфицирующих растворов губят их быстро.
Восприимчивость животных. В естественных условиях животные не чувствительны к менингококкам. Но при субдуральном введении менингококков обезьянам можно вызвать у них заболевание.
Внутрибрюшинное заражение морских свинок и белых мышей вызывает их гибель за счет действия эндотоксина.
Источники инфекции. Больной человек и бактерионоситель.
Пути передачи. Основной путь воздушно-капельный.
Заболевания у человека:
3) цереброспинальный эпидемический менингит.
Патогенез. Попав на слизистую оболочку носоглотки, менингококки могут там локализоваться, обусловив носительство или вызвать острый назофарингит. Если они проникают в лимфатические сосуды, кровь и генерализуются, то вызывают глубокие изменения в паренхиматозных органах за счет действия эндотоксина. Развивается менингококкцемия. При проникновении менингококков в мозговые оболочки возникает гнойное воспаление — менингит. При менингококковом менингите спинномозговая жидкость мутная (в отличие от туберкулезного менингита). При спинномозговой пункции жидкость вытекает струей вследствие повышенного внутричерепного давления. Менингеальные явления характеризуются головной болью, ригидностью затылка, рвотой и т. д. Менингитом чаще болеют дети. У взрослых чаще заражение ограничивается носительством или назофарингитом.
Иммунитет. Постинфекционный иммунитет напряженный, он обусловливается опсонинами, комплементсвязывающими и бактериоцидными антителами. От интенсивности образования антител к полисахаридным и белковым антигенам зависит течение заболевания.
Профилактика. Сводится к раннему выявлению носителей, изоляции заболевших назофарингитом. Больные подлежат госпитализации.
Специфическая профилактика. Разработана химическая вакцина, состоящая из полисахаридов серогрупп А и С. Для экстренной профилактики используется иммуноглобулин.
Лечение. Антибактериальные препараты — пенициллин, левомицетин, ампициллин.
Контрольные вопросы
1. Каковы морфологические свойства менингококков?
2. На каких средах выращивают менингококки и какие условия необходимы для их размножения?
3. Какова биохимическая активность менингококков и их устойчивость во внешней среде?
4. Какие заболевания вызывают менингококки?
5. По какому антигену делят менингококки на серогруппы?
Микробиологическое исследование
Цель исследования: выявление менингококка и определение его серогруппы.
1. Спинномозговая жидкость.
2. Отделяемое слизистой оболочки носоглотки.
Способы сбора материала
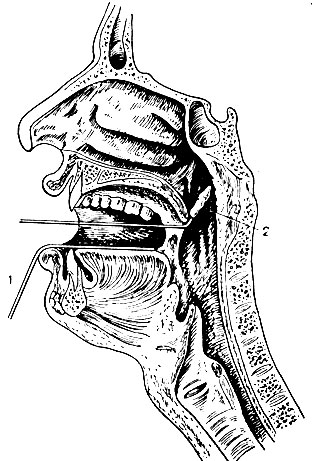
Рис. 39. Взятие слизи из носоглотки для исследования на менингококки. 1 — шпатель; 2 — тампон для взятия материала
Ход исследования
Производят учет результатов (табл. 27)
Таблица 27. Дифференциация менингококков от непатогенных нейссерий
Примечание. + рост (положительная проба); — отсутствие роста; к — кислота.
Определение группы менингококка. После получения чистой культуры менингококка проводят серологическое определение группы. Для этого используют коммерческие агглютинирующие и преципитирующие сыворотки.
На предметное стекло наносят по одной капле неразведенных агглютинирующих сывороток групп А, В, С и др., каплю изотонического раствора натрия хлорида (контроль). К каждой капле прибавляют одну петлю выделенной культуры. Наличие агглютинации в одной из капель определяет группу выделенной культуры.
Для выявления серогрупп можно ставить реакцию преципитации в геле (см. главу 32).
В настоящее время с диагностической целью используют серологические методы диагностики: сыворотку обследуемых лиц исследуют в РНГА с менингококковым эритроцитарным диагностикумом А, С и других серогрупп.
1. Какой материал служит для выявления менингококков при заболевании менингитом?
2. Как транспортируют исследуемый материал?
3. Что прибавляют к собранному материалу для подавления роста грамположительных кокков?
4. От каких микроорганизмов необходимо дифференцировать менингококки, какие методы исследования проводят для дифференциации?
5. Какую реакцию ставят для определения серогруппы менингококков?
1. Подготовьте тампон, изогните его под углом 135° и возьмите друг у друга слизь из носоглотки. Посейте ее на агар с сывороткой.
2. Изучите под микроскопом мазок из культуры менингококка и зарисуйте его.
Агар с сывороткой (см. главу 7).
Среда с линкомицином. К 80 мл расплавленного и остуженного до температуры 50° С 2% агара добавляют 20 мл лошадиной или бычьей сыворотки, 0,5-0,7 мл раствора линкомицина в рабочем разведении (рабочее разведение 0,001 мг на 1 мл среды). После перемешивания среду разливают в чашки Петри. Раствор линкомицина готовят на стерильной воде и сохраняют в холодильнике.
Источник