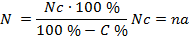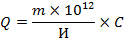Микробиологический метод анализа почвы
4.1. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
МЕТОДЫ МИКРОБИОЛОГИЧЕСКОГО КОНТРОЛЯ ПОЧВЫ
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ сотрудниками: Федерального научного центра гигиены им. Ф.Ф.Эрисмана (Трухиной Г.М., Мойсеенко Н.Н.), Федерального центра Госсанэпиднадзора Минздрава России (Брагина И.В., Кривопалова Н.С., Белобородова O.К., Гончарук О.Д.), центра ГСЭН в Краснодарском крае (Калашников И.А., Щербина Л.И.).
2. УТВЕРЖДЕНЫ И ВВЕДЕНЫ В ДЕЙСТВИЕ Заместителем главного государственного санитарного врача Российской Федерации — Главным врачом Федерального центра Госсанэпиднадзора Минздрава России Е.Н.Беляевым 24.12.2004 г.
3. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения
Настоящий документ является методической базой для осуществления государственного санитарно-эпидемиологического надзора за санитарным состоянием почв населенных мест, сельскохозяйственных угодий, территорий курортных зон и отдельных учреждений. Документ предназначен для лабораторий учреждений Государственной санитарно-эпидемиологической службы Российской Федерации, а также лабораторий других организаций, аккредитованных в установленном порядке на право проведения указанных испытаний.
2. Нормативная ссылка
1.1. Почва, очистка населенных мест, бытовые и промышленные отходы, санитарная охрана почвы. Санитарно-эпидемиологические правила и нормы СанПиН 2.1.7.1287-03
1.2. ГОСТ 17.4.3.01-83. Общие требования к отбору проб почвы
1.3. ГОСТ 17.4.4.02-84. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа
1.4. МУ 2.1.7.730-99 Гигиеническая оценка качества почвы населённых мест
1.5. МУ по санитарно-микробиологическому анализу лечебных грязей N 143-9/316-17
1.6. МУК 4.2.1018-01 Санитарно-микробиологический анализ питьевой воды
3. Санитарно-бактериологические показатели почвы и их нормирование
Санитарное состояние почвы — совокупность физико-химических, биологических свойств почвы, определяющих качество и степень её безопасности в эпидемическом и гигиеническом отношении.
Состав микрофлоры почвы меняется в зависимости от ее глубины. В поверхностном слое почвы (0-10 см) количество микроорганизмов незначительно; это связано с губительным действием прямого солнечного света и низкой влажности почвы. Максимальное количество микроорганизмов обнаруживается на глубине 10-30 см. На глубине 1 м выявляются единичные клетки бактерий. Наиболее богата микроорганизмами культурная возделываемая почва (до 5 млрд клеток на 1 г почвы), наименее — почва, бедная влагой и органическими веществами (200 млн клеток в 1 г).
Оценка санитарного состояния почвы проводится по результатам анализов почв на объектах повышенного риска (детские сады, игровые площадки, зоны санитарной охраны и т.п.) и в санитарно-защитных зонах по санитарно-бактериологическим показателям, которые делятся на косвенные и прямые:
1) Косвенные характеризуют интенсивность биологической нагрузки на почву. Это — санитарно-показательные микроорганизмы: бактерии группы кишечной палочки (общие колиформные бактерии) и энтерококки. В крупных городах с высокой плотностью населения биологическая нагрузка на почву очень велика и как следствие, высоки индексы санитарно-показательных микроорганизмов, что наряду с санитарно-химическими показателями (динамика аммиака и нитратов, санитарное число), свидетельствует о неблагополучии и создании повышенного риска инфицирования. На свежее фекальное загрязнение почвы указывает наличие высокого индекса БГКП при низких титрах нитрификаторов, термофилов, а также относительно высокое содержание вегегативных форм С. perfringens. Обнаружение энтерококков всегда свидетельствует о свежем фекальном загрязнении, каковы бы ни были другие показатели.
2) Прямые санитарно-бактериологические показатели эпидемической опасности почвы — обнаружение возбудителей кишечных инфекций (патогенные энтеробактерии, энтеровирусы).
Результаты анализов оцениваются в соответствии с таблицей N 1.
Оценка степени эпидемической опасности почвы
Источник
I. Схема и санитарно-микробиологические показатели исследования почвы
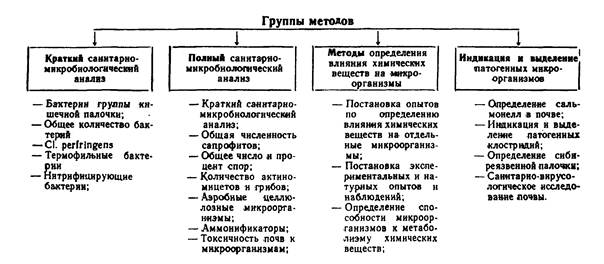
В настоящих методических указаниях приведен полный набор микробиологических показателей и методов их определения, использование которых позволяет дать комплексную санитарно-микробиологическую оценку почвенного покрова. Одни показатели (бактерии группы кишечных палочек, термофильные, нитрифицирующие, общее количество бактерий и Cl. perfringens) указывают на степень фекального загрязнения. Изучение состояния почвенного биоценоза по этим показателям и дополнительно по ряду групп и видов почвенной микрофлоры позволяет более глубоко определять изменения в почве, происходящие в результате бактериального, органического и химического загрязнений.
В соответствии с целями исследований в каждом конкретном случае можно использовать определенную группу показателей. В таблице 1 приведены 4 группы показателей. При проведении текущего санитарного надзора за состоянием почвы целесообразно ограничить исследования проведением краткого санитарно-микробиологического анализа, указывающего на наличие и степень фекального загрязнения почвы. По показателям, включенным в эту группу, можно определять и самоочищение почвы от энтеробактерий и органических веществ.
Схема санитарно-микробиологического исследования почвы
Исследование почвы по полному санитарно-микробиологическому анализу показано при осуществлении предупредительного санитарного надзора при выборе территорий для размещения населенных пунктов, отдельных объектов, ЗПО и др., а также при проведении научных исследований. Проведение анализа почвы по полной схеме позволяет получать наиболее полные данные о степени фекального и органического загрязнения и течения процессов самоочищения.
Определение влияния химических веществ на почвенный биоценоз предусматривает дополнительные исследования, позволяющие дать более быструю характеристику антибактериального действия химических соединений, а также их действия на активность почвенной микрофлоры.
В необходимых случаях, а также по эпидемическим показаниям можно проводить индикацию и выделение из почвы патогенных микроорганизмов, в распространении которых почва играет важную роль.
II. Оценка санитарного состояния почвы по микробиологическим показателям
Имеющиеся в литературе данные (1, 2, 3) и исследования, проведенные Молдавским НИИ гигиены и эпидемиологии, позволили разработать схему оценки санитарного состояния почвы по 4-м микробиологическим показателям (табл. 2).
Наличие кишечной палочки в титрах 0,9 и ниже свидетельствует о несомненном фекальном загрязнении почвы, притом свежем. Одновременно могут быть зарегистрированы низкие титры Cl. perfringens и нитрификаторов. Однако следует иметь в виду, что в первое время после имевшего место органического загрязнения нитрификаторов может быть мало — необходимо время, чтобы они успели размножиться.
В процессе самоочищения на разных этапах возникают различные количественные соотношения этих показателей. Наиболее быстро отмирает кишечная палочка, поэтому при сравнительно высоких ее титрах титры Cl. perfringens и нитрифицирующих бактерий низкие. Это показывает, что в почве интенсивно протекают процессы самоочищения как от патогенных микроорганизмов, так и от органического загрязнения.
Высокий титр (1,0 и выше) кишечной палочки при низких титрах остальных 3-х показателей характеризует почву как свободную от возбудителей кишечных инфекций, но в которой еще не закончились процессы распада и минерализации органических веществ.
Высокие титры всех показателей свидетельствуют о законченных процессах самоочищения и характеризуют почву как чистую, свободную от патогенных энтеробактерий и органических загрязнений.
Эти моменты имеют важное значение при определении не только фактического санитарного состояния почвы определенных территорий, но и для выяснения стадий течения процесса самоочищения, установления сроков полива, удобрения почвы навозом и т.д.
Схема оценки санитарного состояния почвы по микробиологическим показателям
Количество термофильных бактерий в грамме почвы
О загрязнении почвы навозом и компостами свидетельствует повышенное содержание в ней термофилов (более 1000 клеток в 1 г почвы).
Дополнительным показателем является общее количество бактерий в грамме почвы. Единого норматива этого показателя нет, так как количество бактерий в почвах разных типов и климатических районов сильно варьирует. Для подзолистых почв наличие 10 млн бактерий в грамме почвы и более указывает на фекальное загрязнение. Для других типов почв необходимо устанавливать конкретные нормативы этого показателя.
Приведенная выше схема позволяет оценивать санитарное состояние почвы в 2-х аспектах: загрязнения патогенными энтеробактериями и органическими веществами. Причем исследования, проведенные в ИОКГ им. А.Н. Сысина, Молдавском НИИ гигиены и эпидемиологии и в Киевском НИИ ОКГ им. А.Н. Марзеева, показали, что основной косвенный показатель — численность кишечных палочек — является надежным индикатором фекального загрязнения почвы и при загрязнении ее химическими веществами. Вышеизложенное позволяет рекомендовать эту схему для оценки санитарного состояния почвы независимо от того, загрязнена она химическими веществами или нет.
Косвенные микробиологические показатели не указывают на наличие или отсутствие в почве других возбудителей инфекционных заболеваний (столбняка, сибирской язвы, ботулизма), кишечника и других вирусов, патогенных для человека.
Для выделения или индикации этих патогенных микроорганизмов необходимо проводить специальные исследования с использованием лабораторных животных в крупных бактериологических лабораториях или научных учреждениях. Описание этих методик приводится ниже в соответствующих разделах Методических указаний.
В санитарно-бактериологических лабораториях районных санэпидстанций можно проводить исследование почв на присутствие тифопаратифозных и сальмонеллезных возбудителей. Необходимость в проведении таких анализов возникает при расследовании вспышек, при установлении источника заражения, а также при проведении противоэпидемических мероприятий.
III. Отбор проб и предварительная обработка почвенных образцов для анализа
Санитарное обследование, выбор точек отбора проб
Увеличение количества источников загрязнения почвы привело к необходимости увеличения объема работы по санитарной охране почвы. В настоящее время санитарному надзору подлежат не только территории населенных мест, но и за их пределами.
Основными объектами, территории которых подлежат контролю органов санитарного надзора с применением санитарно-микробиологических методов исследования и требующими проведения ряда мероприятий по предотвращению загрязнения почвы, являются: детские и лечебно-профилактические учреждения; сельские и неканализованные районы городских населенных пунктов; территории первого пояса зоны санитарной охраны источников хозяйственно-питьевого водоснабжения; зоны свалок, отвальных площадок; сельскохозяйственные поля, орошаемые водой из открытых водоемов, стоками животноводческих ферм и комплексов и удобряемые навозом; земледельческие поля орошения городскими и промышленными сточными водами, а также при внесении их осадков в качестве удобрения.
Обязательным предварительным этапом при санитарно-бактериологическом исследовании почвы является санитарное обследование. Суть его заключается в том, что санитарный врач на основании предварительно составленной карты санитарного обследования визуально и в результате опроса описывает изучаемую территорию, выбирает на ней точки взятия проб, участвует в отборе проб. В Приложении 1 дан примерный образец карты санитарного обследования земельного участка.
На основании результатов санитарного обследования территории и ее описания составляется схематический план земельного участка с нанесением источников загрязнения. Это позволяет правильно обосновать выбор точек отбора проб почвы.
На изучаемой территории при наличии одного источника загрязнения выделяют два участка, 25 м 2 каждый; один вблизи источника загрязнения (опытный), другой — вдали (контрольный). Контрольный выбирают с таким расчетом, чтобы он был заведомо незагрязненный и имел одинаковый почвенный состав с опытным.
Если на изучаемой территории имеется несколько источников загрязнения, то необходимо выделить несколько опытных участков около каждого, загрязняющего внешнюю среду, объекта. Если на территории нет видимых источников загрязнения, то необходимо выделить участки согласно элементам рельефа.
При санитарно-бактериологическом обследовании почвы значительных территорий определение количества точек для забора проб почвы производится согласно следующим рекомендациям. На каждые 100 га изучаемой территории при спокойном рельефе местности намечают к отбору проб почвы 6 — 7 участков площадью 25 м 2 . При выраженном рельефе количество отводимых участков увеличивается до 8 — 10.
Отбор образцов почвы
Пробы почвы отбираются на каждом из участков в его пяти точках по диагонали или по «конверту» (четыре точки по углам и одна в центре).
В том случае, если исследователя интересуют последствия непосредственного внесения химического вещества в почву, пробы отбираются поверхностно (0 — 1 см) стерильным инструментом (нож, шпатель) в количестве 0,3 — 0,5 кг в одной точке.
Если изучается воздействие химического вещества на микрофлору почвенного горизонта, то для отбора проб почвы пользуются следующей методикой. Каждая точка, в которой проводится отбор проб почвы, представляет собой центр выбранного для исследования 1 м 2 территории. Здесь выкапывается прикопка (шурф) размером в плане 0,3 м×0,3 м и глубиной 0,2 м. Поверхность одной из стенок шурфа очищают стерильным ножом. Затем из этой стенки вырезают почвенный образец, размер которого обусловлен заданной навеской. Так, если необходимо отобрать 200 г почвы, размер образца 20 см×3 см×3 см, 500 г — 20 см×5 см×3 см.
При изучении воздействия пестицидов и др. химических веществ на микрофлору и процессы самоочищения в более глубоких слоях почвы, для отбора проб почвы пользуются шурфом глубиной до 1 м. Пробы отбираются из стенки шурфа стерильным инструментом через каждые 10 см.
В тех случаях, когда исследователя интересует влияние химических веществ на микрофлору почвы и процессы самоочищения в более глубоких слоях почвы, не имеет большого смысла отбирать пробы почвы, а следует производить изучение грунтовых вод, отбираемых с помощью прибора Гончарука.
Отобранные образцы помещают в стерильную посуду и доставляют в лабораторию. При невозможности приступить к исследованию почвы немедленно, допускается хранение образца при температуре 4 — 5°, но не более 24 часов.
Подготовка и обработка почвы для анализа
Для приготовления среднего образца объемом 0,5 кг почву всех образцов одного участка высыпают на стерильный плотный лист бумаги, тщательно перемешивают стерильным шпателем, отбрасывают камни и прочие твердые предметы. Если проба почвы однородна, допускается тщательное перемешивание почвы в банке. Затем почву распределяют на листе ровным тонким слоем в форме квадрата.
Диагоналями почву делят на 4 треугольника. Почву из двух противоположных треугольников отбрасывают, а оставшуюся вновь перемешивают, опять распределяют тонким слоем и делят диагоналями и так до тех пор, пока не останется примерно 0,5 кг почвы.
Перед посевом почву диспергируют. С этой целью почву с соблюдением условий стерильности просевают через сито диаметром 3 мм. При просеивании сито покрывают сверху стерильной бумагой. Почву дисперсную можно не подвергать просеиванию. Почву торфяную, содержащую большое количество органических веществ, предварительно растирают в ступке. Неперегнившую растительную массу отбрасывают.
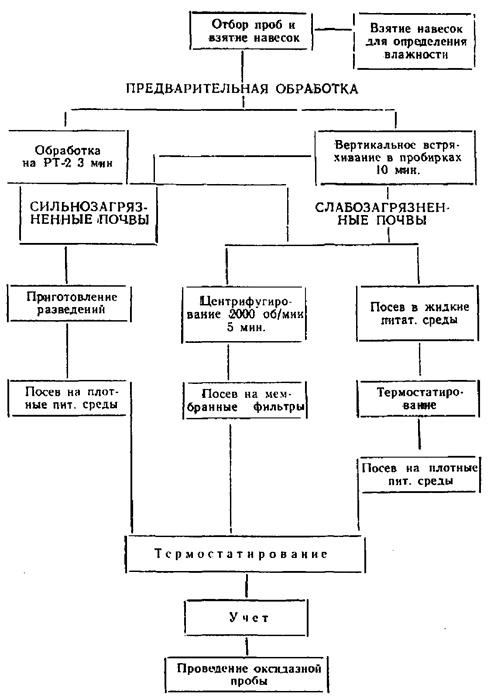
Образец почвы тщательно перемешивают и из него отбирают навески, величины которых выбираются исходя из предполагаемой степени загрязнения почвы и планируемых определений. Для учета почвенных микроорганизмов и энтеровирусов достаточно навески от 1 до 10 г, для санитарно-показательных микроорганизмов от 1 до 30 г, для патогенных энтеробактерий (50 — 55,5 г). Первое разведение навески почвы (1:10) делают в стерильной посуде, добавляя стерильную водопроводную воду в соотношении 1:10 к весу почвы (например: 1 г почвы разводят в 10 мл стерильной водопроводной воды, 10 г почвы — в 100 мл воды и т.д.). После приготовления навески применяют соответствующую предварительную обработку почвы в зависимости от типа и вида учитываемого микроорганизма. Основная цель, которую преследуют проводя предварительную обработку почвы, заключается в том, чтобы извлечь клетки микроорганизмов из почвенных агрегатов, что достигается разрушением последних и десорбцией микроорганизмов с поверхности почвенных частиц.
Основными приемами предварительной обработки почвы являются: 1) 10-минутное вертикальное встряхивание почвенной суспензии первого разведения в пробирках с резиновыми пробками — при навеске почвы 1 г; 2) 3-минутная обработка почвенной суспензии первого разведения на мешалке механического диспергатора (размельчитель тканей, марки РТ-2) — при навеске почвы более 1 г.
Почвенную суспензию, содержащую в 1 мл 0,1 г почвы, через 30 секунд после предварительной обработки (за это время оседают грубые минеральные частицы) используют для приготовления последовательно убывающих концентраций почвы. Для этого из первого разведения, находящегося во флаконе, с содержанием почвы 0,1 г/мл отбирают стерильной пипеткой 1 мл и переносят в пробирку с 9 мл стерильной водопроводной воды. При этом получают второе разведение, содержащее 0,01 г/мл почвы. Повторяя эту операцию, доводят разведение почвы до 0,0001 — 0,00001 г/мл. Для приготовления каждого разведения используют отдельные пипетки.
Приготовленные децимальные разведения используются для посева почвы на различные питательные среды, а также для учета численности микроорганизмов методом прямой микроскопии.
Для определения отдельных показателей применяются и другие способы обработки, описание которых приводится ниже в соответствующих разделах.
Для получения сравнимых и более полных результатов желательно производить пересчет количества обнаруживаемых микроорганизмов на 1 г абсолютно сухой почвы. Для этого необходимо производить определение влажности анализируемого образца почвы. С этой целью навеску почвы (10 — 20 г) помещают в заранее взвешенный стеклянный или металлический бюкс и высушивают в сушильном шкафу при 105 °C. Первое контрольное взвешивание высушенной почвы делают через 3 часа, затем высушивают почву до постоянного веса (контрольное взвешивание каждые 2 часа). Расчет производится по следующей формуле:
N — количество клеток бактерий в 1 г абсолютно сухой почвы;
Nc — количество клеток бактерий в 1 г сырой почвы;
а — степень десятикратного разведения;
n — число колоний, выросших на чашке (берется среднее арифметическое из всех чашек);
С — влажность исследуемой почвы (%).
IV. Санитарно-бактериологическое исследование почвы
IV.1. Определение микробиологических показателей, характеризующих фекальное загрязнение почвы
Определение количества бактерий группы кишечных палочек
К бактериям группы кишечных палочек (БГКП) относятся грамотрицательные, не образующие спор короткие палочки, сбраживающие лактозу и глюкозу с образованием кислоты и газа при 37 ± 0,5 °С в течение 24 — 48 часов, не обладающие оксидазной активностью.
В настоящее время имеется возможность дифференцированно подходить к выбору методики определения БГКП в почве (рис.). При анализах почв, для которых предполагается невысокая степень фекального загрязнения, рекомендуется проводить определение БГКП титрационным методом. При этом возможно использование любой из двух равнозначных по эффективности сред — Кесслера-Свенертона или лактозного бульона с трифенилтетразолием хлорида (ТТХ). В качестве ускоренного метода для анализа слабозагрязненных почв рекомендуется использовать метод мембранных фильтров. При анализах проб с предполагаемой высокой степенью фекального загрязнения можно проводить прямой поверхностный посев разведений почвенной суспензии на среду Эндо.
Дальнейшая идентификация БГКП проводится по стандартной методике
——- — предлагаемые усовершенствования
Рис. Определение бактерий группы кишечной палочки в почве
Для исследования используются предварительно подготовленные почвенные суспензии и разведения по описанной выше методике.
Определение кишечных палочек в почве титрационным методом. Из первого разведения почвенной суспензии (1:10), прошедшей предварительную обработку, стерильной пипеткой берут 10 мл и засевают во флаконы с 50 мл жидких сред, что соответствует засеву 1 г почвы. Посев меньших количеств (0,1 г, 0,01 г и т.д.) делают по 1 мл из соответствующих разведений почвенной суспензии в пробирки с 9 мл тех же сред.
Перед посевом в каждую пробирку с лактозным бульоном прибавляют по 0,3 мл 2 % водного раствора ТТХ, а в каждый флакон — по 1,5 мл. Методика с использованием ТТХ основана на способности кишечной палочки восстанавливать бесцветное соединение ТТХ в трифенилформазан, выпадающий в виде осадка и придающий среде коричневато-красный цвет. Кишечная палочка устойчива к действию формазана, в то время как развитие другой микрофлоры тормозится.
Посевы на среде Кесслера-Свенертона выращивают 48 часов при 43° или 37°. Отсутствие через 48 часов газообразования и помутнения в бродильных сосудах дает окончательный отрицательный ответ на наличие бактерий группы кишечных палочек. Отрицательный ответ на лактозном бульоне с ТТХ дается через 24 часа в том случае, если в пробирках и флаконах цвет среды не изменился.
При наличии в сосудах со средой Кесслера-Свенертона газообразования и помутнения или только помутнения производят высев на среду Эндо или на розоловый агар. Для посева на среду Эндо отбираются те сосуды с лактозным бульоном, цвет которых изменился в кирпично-красный. Чашки с посевами помещают в термостат на 24 часа при температуре 37°. Ход анализа в дальнейшем одинаков, независимо от того, какая среда использовалась первоначально.
Отсутствие роста на чашках дает окончательный отрицательный ответ. Типичными для кишечных палочек колониями являются красные, розовые с металлическим блеском, не разлагающие лактозу, и бесцветные на среде Эндо и желтые и оранжевые — на розоловой среде.
Заключительный этап исследования заключается в идентификации выросших на агаризованных средах характерных колоний, которая производится аналогично анализу кишечных палочек в воде. Из типичных колоний приготовляют мазки и окрашивают их по Граму.
У грамотрицательных палочек проверяют оксидазную активность. Постановка оксидазного теста при этом осуществляется следующим образом: петлей или стеклянной палочкой снимают колонии грамотрицательных палочек со среды Эндо и наносят штрихом на фильтровальную бумагу, смоченную специальным реактивом, (пропись приготовления которого дана ниже, в разделе «питательные среды»). В месте нанесения бактериальной массы цвет бумаги не изменяется, если оксидазный тест отрицательный, и синеет в течение 1 мин, если бактерии имеют активную оксидазу. Исследование изолированных колоний является обязательным, иначе можно необоснованно отбросить кишечную палочку при ложном посинении за счет примеси оксидазоположительных бактерий. Если оксидазный тест со среды Эндо проявляется недостаточно четко из-за того, что мешают ингибиторы, то для получения правильного результата такие колонии можно пересеять на скошенный питательный агар и после подращивания повторить оксидазный тест.
При наличии на поверхности агаризованной среды Эндо розовых или красных колоний грамотрицательных палочек с отрицательной оксидазной активностью их подсчитывают и причисляют к бактериям группы кишечных палочек после подтверждения ферментации глюкозы. Для этого засевают 2 — 3 колонии каждого типа в полужидкую среду с глюкозой. Учет производят через 4 — 5 и 18 часов инкубации при 37 °C. Если за это время в среде происходит образование кислоты и газа, то это подтверждает наличие кишечных палочек в исследуемом разведении почвы. Признаком газообразования является всплывание на поверхность среды ватного тампончика или появление пузырька газа в стеклянном поплавке; об образовании кислоты свидетельствует пожелтение среды. При наличии только кислоты пробирки оставляют в термостате для окончательного ответа через 24 часа. При отсутствии газообразования через этот срок получают окончательный отрицательный ответ, при наличии газообразования — положительный результат. Результаты анализа выражают колититром.
Определение кишечных палочек в почве методом мембранных фильтров. В качестве ускоренного метода для обнаружения БГКП целесообразно использовать метод мембранных фильтров. При этом через стерильные мембранные фильтры № 3 пропускают 5 — 10 мл почвенной суспензии первого разведения (1:10). Для того, чтобы облегчить фильтрование почвенной суспензии через мембранный фильтр, желательно до фильтрования провести после предварительной обработки центрифугирование почвенной суспензии при 2000 об/мин в течение 5 минут. При этом происходит осаждение крупных почвенных частиц и фильтрование почвенной суспензии происходит значительно эффективнее.
Мембранные фильтры № 3 перед употреблением стерилизуют путем кипячения в дистиллированной воде на медленном огне (во избежание скручивания фильтров). Кипячение проводят 2 раза по 20 минут, сливая каждый раз воду. После последнего кипячения воду не сливают, фильтры оставляют в воде до употребления.
По окончании фильтрования верхнюю часть прибора снимают. Мембранные фильтры с адсорбированными на них клетками бактерий осторожно захватывают обожженным пинцетом за край и накладывают на поверхность среды Эндо, налитой в чашки Петри и заранее остуженной, избегая образования пузырьков воздуха между мембранным фильтром и средой. В чашку можно поместить 4 фильтра. На чашке под каждым фильтром делают надпись с указанием номера пробы и объема профильтрованной суспензии (удобно это делать в виде дроби, например 1/5 — т.е. проба номер 1, профильтровано 5 мл и т.д.). Чашки с помещенными на них фильтрами ставят в термостат при температуре 37° на 24 часа. После инкубации отбирают 2 — 3 типичные колонии для окраски по Граму и дальнейшей идентификации, которая проводится аналогично тому, как это рекомендуется при работе титрационным методом, подробное описание которого приводилось выше.
Прямой поверхностный посев на агаризованные питательные среды для учета кишечных палочек в почве
При анализе загрязненных и сильнозагрязненных почв, отобранных в местах интенсивного фекального загрязнения, рекомендуется проводить прямой поверхностный посев почвенной суспензии в количестве 0,1 или 0,05 мл на поверхность среды Эндо обычным способом. Среда Эндо заранее разливается в чашке Петри и подсушивается в сушильном шкафу при температуре 50 — 60 °C до образования так называемой «муаровой» пленки. Возможно подсушивание чашек Петри со средой Эндо путем постепенного высушивания их при комнатной температуре. В этом случае чашки со средой Эндо оставляют на сутки на рабочем столе в положении — «крышкой вниз», прикрыв их от света. Посев при анализах сравнительно чистых почв производится из разведений от 1:10 до 1:1000. При работе с загрязненными почвами обычно используют разведения до 1:1000000. Посевы выращивают в термостате при 37° в течение 24 час. Следующий этап исследований заключается в идентификации выросших микроорганизмов, который проводится аналогично определению кишечных палочек титрационным методом.
Результаты анализа последними двумя методами можно выразить в колититре или колииндексе. В любом случае расчет ведется с учетом влажности анализируемой почвы. Чтобы подсчитать число клеток кишечной палочки в 1 г сырой почвы, необходимо среднее число колоний на чашке умножить на степень разведения, затем проводят перерасчет на 1 г абсолютно сухой почвы, согласно ранее приведенной формуле.
Определение в почве общего количества бактерий
Для характеристики в почве общего микробного загрязнения фекального происхождения используют определение численности микроорганизмов, преимущественно бактерий, растущих на мясопептонном агаре при 37 °C. При этом производят посев почвенных разведений в 1,5 % мясопептонный агар (возможно использование питательного агара дагестанского производства). Из каждой пробы почвы должно быть использовано для посева не менее двух различных разведений в зависимости от степени предполагаемого загрязнения исследуемой почвы. Перед посевом каждое разведение тщательно перемешивают стерильной пипеткой, после чего берут 1 мл суспензии и переносят на дно стерильной чашки. Из каждого разведения посев производят минимум на 2 параллельные чашки. После в каждую чашку вливают предварительно расплавленный и остуженный до 45° питательный агар в количестве 15 — 20 мл. Чашки Петри с расплавленным агаром хорошо перемешивают с имеющейся там почвенной суспензией, осторожно наклоняя чашки во все стороны. Затем чашки помещают на строго горизонтальную поверхность до затвердевания среды. На чашке должна быть сделана надпись с указанием номера или названия пробы и разведения.
После застывания агара чашки с посевом помещают в термостат в перевернутом виде (крышкой вниз) при температуре 37° на 24 часа.
После инкубации подсчитывают выросшие колонии и проводят пересчет на 1 г абсолютно сухой почвы.
Определение Cl. perfringens в почве
Рекомендуется два способа учета Cl. perfringens в почве.
Посев почвенных разведений в среде Вильсон-Блер. Из всех приготовленных почвенных разведений (до 1:1000000) по 1 мл переносится в два параллельных ряда пробирок. Один ряд пробирок прогревают при температуре 80 °C в течение 15 минут или при 90° — 10 минут. Затем во все пробирки наливают по 9 — 10 мл среды Вильсон-Блер, приготовленной ex tempore. Инкубация посевов производится при 37 °C или 43° в течение 24 часов. Учет можно производить и несколько раньше, так как санитарно-показательные клостридии, преимущественно Cl. perfringens, через несколько часов образуют колонии черного цвета. Наличие в мазках, приготовленных из этих колоний, характерных грамположительных палочек указывает на наличие Cl. perfringens.
В последние годы была показана также возможность использования вместо среды Вильсон-Блера сульфит-полимиксин-неомициновую среду, предложенную Г.И. Сидоренко и Ю.П. Пивоваровым для учета Cl. perfringens в объектах внешней среды.
Общепринятой методике индикации Cl. perfringens на среде Вильсон-Блер присущ существенный недостаток — питательная среда в определенной степени ингибирует рост Cl. perfringens. Для устранения этого явления разработана и предложена модификация учета содержания Cl. perfringens в почве.
Использование сред накопления для определения Cl. perfringens в почве. Модификация методики определения Cl. perfringens в почве, разработанной в Молдавском НИИ гигиены и эпидемиологии, заключается в следующем. По 1 мл прогретых и нативных почвенных разведений высевают в пробирки с жидкими и полужидкими питательными средами, предварительно регенерированных кипячением (Клодницкого, Китт-Тарроцци, бульона Мартена с ватой и др.). После инкубации (18 — 20 часов) при 37° производится высев в количестве 0,5 — 1 мл из помутневших пробирок в среду Вильсон-Блер или сульфит-полимиксин-неомициновую среду. Посев, инкубация и учет при этом производятся аналогично первому способу.
Определение термофильных бактерий
При выявлении степени фекального загрязнения почвы целесообразно провести определение в ней количества термофильных микроорганизмов. Как известно, последние несвойственны незагрязненным почвам. В почву термофилы попадают вместе с органическими удобрениями (навоз, компосты, термы). Сточные жидкости, фекалии и свежий навоз богаты кишечной палочкой, но бедны термофилами. Поэтому если почва содержит много кишечных палочек и много термофилов, то очевидно она была удобрена навозом и компостами. Почвы, показывающие высокое содержание кишечных палочек и бедные термофилами, можно рассматривать фекально загрязненными.
Учет термофильных сапрофитных микроорганизмов производят на мясопептонном агаре, который следует разливать более толстым слоем, чем обычно. Посев производят из разведений 1:10 — 1:1000000 на 2 — 3 параллельные чашки Петри. Термофильные бактерии выращивают при 60 ± 2 °C. Учет производят через 24 часа инкубации аналогично, как и при определении общего количества бактерий в грамме почвы.
Определение в почве нитрифицирующих бактерий
Нитрифицирующие бактерии завершают цикл превращения в почве азотсодержащих соединений, окисляя аммиак до нитритов и нитратов. Поэтому численность этих микроорганизмов довольно четко указывает на степень органического загрязнения, скорость и окончание распада органики в почве.
Определение нитрификаторов можно производить посевом разведений почвенной суспензии на плотных или жидких средах. Чаще всего применяется для этих целей минеральная среда Виноградского. Для этого производят посев почвенных разведений, приготовленных обычным способом, во флаконы со средой, разлитой тонким слоем. В опыт рекомендуется включать два незараженных флакона со средой, служащих контролем на чистоту среды. Посевы инкубируют при 28 °C в течение 14 — 15 суток.
При развитии нитрифицирующих бактерий в среде постепенно появляются азотистая и азотная кислоты. Образование окисных соединений азота рекомендуется проверять на 5 — 7 день после засева и вторично на 14 — 15 день. Титр нитрифицирующих бактерий чаще всего устанавливают с помощью качественной пробы с дифениламином; в присутствии азотистой и азотной кислот этот реактив дает синее окрашивание. Для этого пастеровской пипеткой несколько капель среды из каждого флакона, не взмучивая осадок, переносятся на стеклянную или фарфоровую пластинку. Затем добавляют несколько капель раствора дифениламина в концентрированной серной кислоте. Появление синего окрашивания указывает на присутствие в среде нитратов, как результат размножения нитрифицирующих бактерий. Среда контрольных флаконов не должна давать изменение окраски.
IV.2. Методы определения микроорганизмов, характеризующих загрязнение и самоочищение почвы от органических и химических загрязнений
Общее количество бактерий и нитрификаторов дает определенное представление о течении процессов загрязнения и самоочищения почвы от органических и химических загрязнений, но далеко не полное. В связи с этим, для более глубокого изучения этих процессов дополнительно применяется комплекс методов определения отдельных групп и видов почвенной микрофлоры: общая численность сапрофитных микробов, число споровых бактерий, аммонификаторов, целлюлозоразлагающих микроорганизмов и др.
Определение общей численности почвенных сапрофитных микроорганизмов
Напряженность микробиологических процессов почвы коррелятивно связана с размножением и активностью всей совокупности почвенных сапрофитных микроорганизмов. Существует несколько методов определения численности почвенных сапрофитов: посев почвы на питательные среды, прямая и электронная микроскопия. Практически применяются первые два метода.
Определение общей численности почвенных микроорганизмов на питательных средах. Для более полного учета общей численности сапрофитных микроорганизмов этим методом рекомендуется проводить диспергирование и десорбцию клеток с поверхности почвенных частиц следующим способом. Навеску почвы, используемую для приготовления первого разведения, доводят путем добавления небольшого количества стерильной водопроводной воды до пастообразного состояния. После чего почва в пастообразном состоянии растирается в течение 5 мин. Затем готовят первое разведение (1:10) почвы на стерильной водопроводной воде и почвенная суспензия охлаждается при -5 — 7° в течение 20 — 30 мин. По истечении срока охлаждения производят раститровку почвенной суспензии обычным способом.
Посев производится на поверхности почвенного агара, разлитого в чашки Петри. Термостатирование засеянных чашек ведется при 28 — 30 °C в течение 72 часов. Учет анализа и расчет общей численности почвенных микроорганизмов производится, как и при определении общего количества бактерий.
Определение общей численности почвенных микроорганизмов методом прямой микроскопии. При определении численности почвенной микрофлоры наиболее достоверные результаты можно получить при использовании методов непосредственного учета микроорганизмов в почве — прямой микроскопии. Желательно при этом пользоваться методом капилляроскопии по Перфильеву и Габе с последующей люминесцентной микроскопией. Обработка почвенной суспензии при этом проводится 1 % раствором акридинового оранжевого. Этот метод дает возможность определить в 10 раз большее количество живых микробных клеток в 1 г почвы за счет учета клеток, сорбированных на почвенных частицах.
Для этого к 1 мл почвенного разведения 1:10 добавляется 1 — 2 капли красителя. Через 5 секунд в почвенную суспензию помещают отрезок счетного капилляра (2 — 2,5 см). После заполнения капилляра его помещают на предметное стекло и фиксируют двумя каплями расплавленного парафина, нанося их на концы отрезка капилляра. Эти парафиновые капли одновременно защищают содержимое каналов. После этого приступают к подсчету общей численности почвенных микроорганизмов с помощью люминесцентного микроскопа при увеличении до 90×10.
Численность микроорганизмов в 1 г почвы определяется по формуле:
где Q — количество микроорганизмов в г изучаемого образца почвы;
m — средняя численность микроорганизмов в одном ходе капилляра;
10 12 — объем 1 см 3 в кубических мк;
И — объем одного хода капилляра в кубических мк;
С — кратность разведения суспензии, которое обычно равно 10.
Определение общего числа и процента почвенных бацилл
Этот показатель является индикатором глубины минерализации органического субстрата. В чистых почвах, с окончившимся процессом самоочищения, число бацилл относительно общей микробной обсемененности, достигает 20 — 50 %, в загрязненных сохраняется в пределах до 20 %. Однако содержание бацилл и их процент колеблется в зависимости от почвенно-климатических условий, поэтому в конкретных условиях необходимо устанавливать величины этих микробиологических показателей.
Для учета бациллярных форм микроорганизмов используются те почвенные разведения, что и для определения общей численности, предварительно прогретые при 80 °C в течение 15 минут. Посев может производиться на поверхность среды, состоящей из 50 % сусла и 50 % мясопептонного агара (pH 7,0 — 7,2), на поверхность агара Сабуро или почвенного агара. Термостатирование и учет производятся аналогично, как и при учете общей численности микроорганизмов.
Определение количества грибов и актиномицетов в почве
Данные по изучению загрязнения почвы указывает на большую чувствительность к действию отдельных химических веществ почвенных актиномицетов и грибов по сравнению с почвенными споровыми и неспоровыми бактериями. Несомненно, что такая разбалансировка равновесия в почвенном микробиоценозе, должна рассматриваться как отрицательное явление. Актиномицетам и грибам принадлежит большая роль в превращении широкого круга органических и минеральных веществ и благодаря чрезвычайно выраженным антагонистическим и токсическим свойствам они оказывают большое влияние на формирование микробных почвенных ценозов, являются продуцентами многих физиологических активных веществ — аминокислот, ферментов, витаминов.
Для учета почвенных актиномицетов и грибов используются те же разведения почвенной суспензии, что и при учете общей численности микроорганизмов, те же методы посева и учета. Как правило, для учета почвенных грибов используют разведения почвенной суспензии 1:10 — 1:100, а при учете актиномицетов — 1:100 — 1:10000. Посев производят поверхностным способом, нанося на агаризованные среды 0,1 — 0,05 мл суспензий. Для учета актиномицетов используется чаще всего крахмалоаммиачный агар или агар Ваксмана, при учете грибов — сусло-агар или минеральная среда Чапека. При учете грибов используют добавление в среду веществ, ингибирующих рост бактерий — концентрированную молочную кислоту в количестве 4 мл/л среды. Прибавление такого количества кислоты доводит pH среды до 4,0 — 4,5. Кислота добавляется непосредственно перед посевом в расплавленную среду. Поскольку прибавляют концентрированные кислоты, то их предварительно не стерилизуют.
Определение аэробных целлюлозоразлагающих микроорганизмов
Эта группа микроорганизмов осуществляет самоочищение почвы от остатков растительного происхождения. Чаще всего для учета этих микроорганизмов используют посев разведений почвенной суспензии в жидкую среду Гетчинсона. Среда разливается в колбочки или пробирки, куда в качестве источника углерода помещают фильтровальную бумагу; в колбочки опускают складчатый фильтр, в пробирки — полоски бумаги. Учет производится через 15 — 20 суток (инкубация при 28°) по разложению полосок фильтровальной бумаги и образованию колоний микроорганизмов на них.
Определение аммонификаторов в почве
Аммонифицирующие микроорганизмы принимают участие в расщеплении белковых соединений до аммиака. Их учитывают на мясопептонном агаре, а при необходимости на жидких пептонных средах (мясопептонный бульон, пептонная вода) с индикаторными бумажками, открывающими аммиак. Для определения выделяющегося аммиака над средой в пробирке подвешивают красную лакмусовую бумажку (при выделении аммиака она синеет) или полоски фильтровальной бумаги, пропитанные реактивом Круппа (от аммиака краснеют). При выращивании почвенных суспензий на мясопептонном агаре результаты выражают в количестве бактерий на 1 г почвы. При определении этого показателя в жидких средах определяют титр аммонифицирующих микроорганизмов по последней пробирке, в которой еще обнаруживается аммиак (на 10-е сутки) после термостатирования при температуре 25 — 30 °C.
Определение токсичности почв к микроорганизмам
Метод определения степени токсичности почв к микроорганизмам используется в качестве быстрого и достаточно чувствительного теста для получения ориентировочных данных о самоочищающей способности почвы от патогенных и санитарно-показательных микроорганизмов. Кроме того, этот тест оказался также чувствительным при определении влияния химических веществ на почвенный микробиоценоз. Низкая степень токсичности или ее снижение по отношению к патогенным микроорганизмам свидетельствует о наличии или возникновении более благоприятных условий для выживания возбудителей в таких почвах. К почвенным сапрофитам наоборот: высокая или повышенная токсичность — явление неблагоприятное. Степень токсичности почв отдельных территорий оценивается по классам:
Источник