Условия культивирования микроорганизмов, микробиология
Условия культивирования микроорганизмов, микробиология
Условия культивирования микроорганизмов Для роста микроорганизмов существенное значение имеют не только состав питательной среды, но и такие факторы, как кислотность среды, аэрация, температура, свет, влажность. Развитие микроорганизмов возможно лишь в определенных пределах каждого фактора, причем для различных групп микроорганизмов эти пределы часто не одинаковы. Активная кислотность среды (рН) имеет решающее значение для роста многих микроорганизмов. Большинство бактерий лучше всего растет при рН, близком к 7,0, напротив, микроскопические грибы предпочитают слабокислые среды. Поэтому в приготовленных средах всегда следует определить значение рН. Значение рН сред может измениться в процессе стерилизации, поэтому после стерилизации его следует проверить и довести до нужного, если это требуется, стерильными растворами кислоты или щелочи. В процессе культивирования микроорганизмов кислотность питательной среды часто меняется. Эти изменения могут быть результатом образования продуктов метаболизма или неравномерного потребления отдельных компонентов среды. Поддержание определенного значения рН во время роста особенно важно для тех микроорганизмов, которые образуют в процессе жизнедеятельности кислоты, но не обладают устойчивостью к ним. К их числу относятся мол очно-кислые бактерии, а также многие псевдомонады. Аэрация. По типу дыхания бактерии разделяют на 4 группы:
а) облигатные, или строгие, аэробы, которые могут расти только при наличии кислорода; б) микроаэрофилы, которые нуждаются в кислороде, но лучше растут при парциальном давлении О2 меньшем, чем в воздухе; в) факультативные анаэробы, которые способны расти как в присутствии, так и в отсутствии молекулярного кислорода (например, некоторые дрожжи или энтеробактерии в зависимости от наличия кислорода осуществляют аэробное дыхание или брожение; г) облигатные анаэробы (клостридии ботулизма, газовой гангрены, столбняка, бактероиды и др.) растут только на среде без кислорода, который для них токсичен. Неодинаковые потребности микроорганизмов в свободном кислороде определяют различия и в способах их культивирования. Температура. Интервалы температур, в которых возможен рост различных микроорганизмов, заметно варьируются. У мезофилов, к которым относится большинство известных бактерий, температурный оптимум ле35 жит в интервале 25 — 37 °С. У термофилов он значительно выше — от 45 до 80 — 90 °С. Психрофилы хорошо развиваются в интервале температур 5 — 10 0 С. Отклонения температуры от оптимальной неблагоприятно влияют на развитие микроорганизмов.
мезофильные микроорганизмы выращивают в термостатах или специальных термостатированных комнатах, где с помощью терморегуляторов поддерживается соответствующая оптимальная температура. Для выращивания психрофилов используют холодильные камеры. Периодическое и непрерывное культивирование. Существуют две принципиально разные системы выращивания микроорганизмов в жидкой среде.
В одном случае после инокуляции среды не происходит ни добавления в нее, ни удаления каких-либо компонентов, кроме газовой фазы. Такая закрытая система культивирования носит название периодической и может поддерживать размножение клеток только в течение ограниченного времени, на протяжении которого меняются состав исходной среды и окружающие условия. Непрерывное (проточное) культивирование в отличие от периодического характеризуется постоянной подачей питательной среды со скоростью, равной скорости удаления культуры. При этом объем культуры в ферментере во времени не меняется. Одно из основных условий непрерывного культивирования — хорошее перемешивание культуры в ферментере.
Источник
ОСНОВЫ МИКРОБИОЛОГИИ — В. М. Самыгин — 2015
ГЛАВА 10. ОСНОВНЫЕ ПРИНЦИПЫ ВЫРАЩИВАНИЯ БАКТЕРИЙ
Выращивание (культивирование) микроорганизмов необходимо для получения биомассы или различных метаболитов (продуктов обмена веществ) микробной клетки. Выращивание микробов в лабораторных условиях производят на искусственных питательных средах, в культурах тканей и в организме экспериментальных животных. Культуральные признаки микроорганизмов определяют по характеру роста на питательных средах. Эти признаки имеют важное диагностическое значение и являются постоянными для каждого вида микроорганизмов.
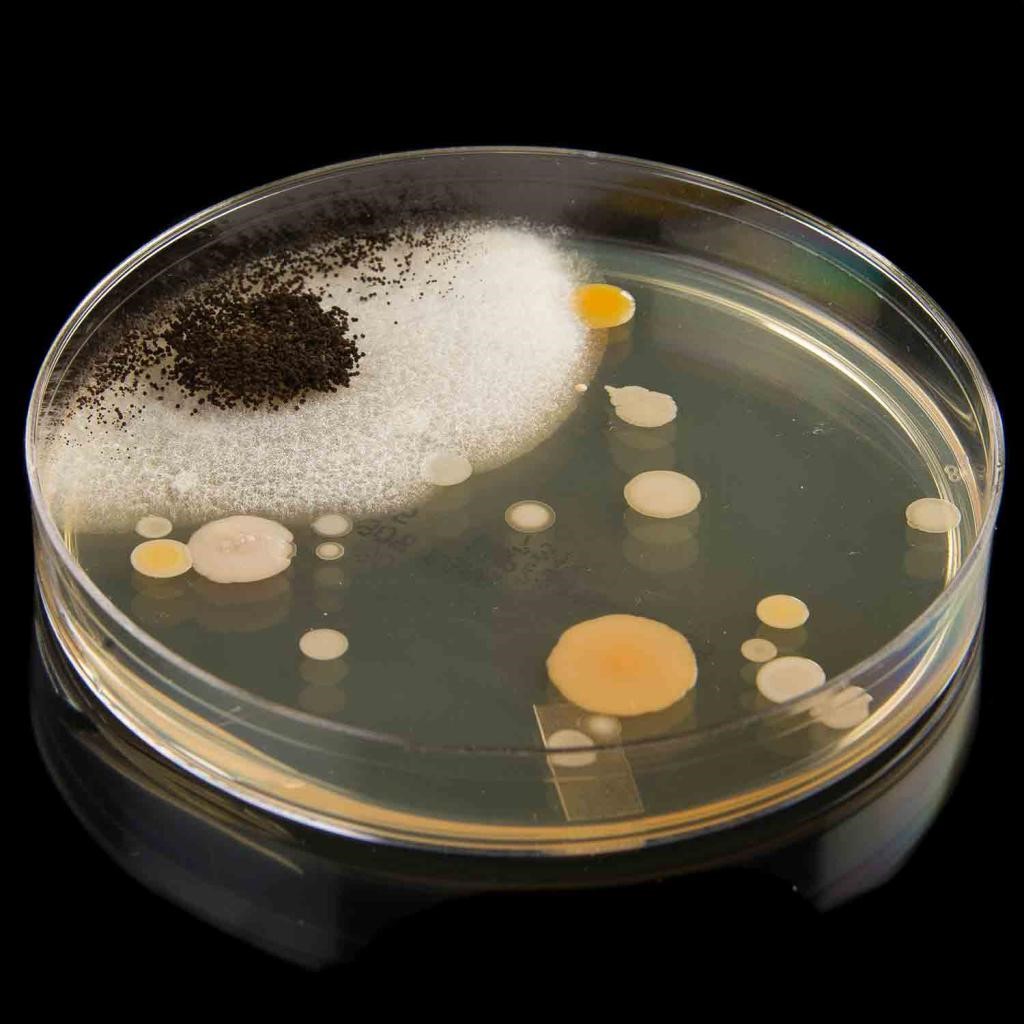
На плотных питательных средах при посеве большого количества микробных клеток наблюдается сплошной рост в виде «газонной» культуры микроорганизмов. При посеве ограниченного числа клеток образуются различные по форме и величине колонии, которые представляют собой видимые скопления особей одного вида микроорганизмов, формирующиеся в результате размножения одной клетки. Колонии бывают плоскими, выпуклыми, куполообразными, вдавленными, поверхность их — гладкой (S-формы), шероховатой (R-формы), исчерченной, бугристой, края — ровными, зазубренными, волокнистыми, бахромчатыми. Форма колоний разнообразна: круглая, розеткообразная, звездчатая, древовидная. По величине колонии бывают крупные (4-5 мм в диаметре), средние (2-4 мм), мелкие (1-2 мм) и карликовые (менее 1 мм). Колонии отличаются по консистенции, плотности, цвету. Они бывают прозрачными и непрозрачными, окрашенными и бесцветными, влажными, сухими и слизистыми (рис. 10 и 11).
Рис. 10. Основные типы колоний микроорганизмов
Рис. 11. Морфологическое и структурное разнообразие колоний: 1 — формы выпуклости колоний над поверхностью питательной среды: 2 — очертания колоний: 3 — характер края колоний: 4 — внутренняя структура колоний
В жидких питательных средах микробы растут с образованием диффузной мути, пленки, осадка, видимых невооруженным глазом. Иногда наблюдается пристеночный рост бактерий.
В лабораторных условиях бактерии выращивают в пробирках, чашках Петри, флаконах, бактериологических матрицах. В производственных условиях культивирование микроорганизмов осуществляют в различных ферментерах (ферментаторах, биореакторах) по специально разработанной технологии.
При оценке эффективности роста обычно измеряют биомассу или число микробных клеток. Прямой способ измерения клеточной массы — это определение веса сухого вещества клеток, содержащихся в определенном объеме культуры, путем отделения их от среды, высушивания и последующего взвешивания. Однако с помощью обычных весов трудно точно определить массу менее 1 мг, а такое количество сухого вещества может содержать до 5 млрд бактерий.
Более удобным методом определения массы одноклеточных микроорганизмов является оптический метод — измерение количества света, рассеянного суспензией клеток. Он основан на том, что рассеяние света мелкими частицами в определенных пределах пропорционально их концентрации, и доля пропущенного света служит мерой оптической плотности суспензии. Измерения проводят с помощью спектрофотометра или фотоэлектроколориметра. Эти приборы показывают единицы оптической плотности, которая представляет собой логарифм отношения интенсивности света, падающего на суспензию, к интенсивности пропущенного света. Нижний предел чувствительности данного метода — около 10 млн клеток в 1 мл.
Для определения числа клеток можно использовать микроскопический метод на специальных предметных стеклах — счетных камерах, прямой подсчет клеток с помощью электронного прибора (счетчик Коултера) и др. Однако чаще подсчет общего количества клеток в суспензии проводят с помощью бактериального стандарта мутности, а также высевом микроорганизмов на плотную питательную среду в чашки Петри.
Стандарт мутности представляет собой взвешенные в дистиллированной воде частицы стекла диаметром от 0,5 до 3,5 мкм. Взвесь этого стекла при взбалтывании осадка соответствует определенной концентрации клеток. Стандарт состоит из запаянных пробирок-эталонов, эквивалентных по степени мутности 5 и 10 международным единицам мутности (5 • 10 8 и 10 9 кл/мл соответственно). К комплекту бактериальных эталонов прилагается шрифтовая таблица, содержащая набор различных шрифтов. Исследуемую культуральную взвесь помещают в стандартную пробирку, толщина стенок и цвет стекла которых соответствует пробиркам- эталонам. Разбавляя культуру измеренными количествами физиологического раствора, доводят мутность в исследуемой пробирке до эталонной и производят расчет исходной концентрации микробных клеток. Расчет производят либо по степени разведения культуры, либо на основе общего количества клеток в бактериальной суспензии.
Число одноклеточных микроорганизмов можно подсчитать также после высева на плотную питательную среду в чашки Петри, поскольку жизнеспособные клетки, пространственно отдаленные друг от друга на поверхности плотной среды, в процессе роста образуют отдельные колонии, видимые невооруженным глазом. Следовательно, приготовив соответствующие разведения бактериальной популяции и использовав их для засева среды, можно определить число жизнеспособных клеток в исходной суспензии путем подсчета числа вырастающих после инкубации колоний и умножения этой цифры на коэффициент разведения. Этот метод называют определением концентрации жизнеспособных клеток,так как он позволяет учесть только те микроорганизмы, которые могут расти на питательной среде. Определение числа жизнеспособных клеток, несомненно, является наиболее чувствительным методом количественного учета бактерий, так как он дает возможность зарегистрировать даже единичную жизнеспособную клетку в суспензии. Для установления доли жизнеспособных клеток в популяции можно использовать методы отдельного определения общего числа клеток (с помощью стандарта мутности) и числа жизнеспособных клеток.
Биологическая библиотека — материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
© 2018-2021 Все права на дизайн сайта принадлежат С.Є.А.
Источник
Современный подход к культивированию микроорганизмов и культур клеток
Большинство научных исследований в области биологии и медицины проводятся не на живых организмах, а «в пробирке». Клеточные культуры и культуры микроорганизмов являются наиболее простым и удобным модельным объектом, позволяющим как тестировать на них воздействие извне, так и исправлять ошибки внутри клетки. Благодаря исследованиям в области клеточного редактирования постепенно становится возможным лечение многих генетических заболеваний. Но каким образом мы можем добиться культуры, максимально соответствующей требованиям к модели для сложных экспериментов? Рассмотрим наиболее популярные современные способы выращивания микроорганизмов и культур клеток.
Общее понимание культивирования
Культивирование как микроорганизмов, так и отдельных клеток – это выращивание изъятого из определенной среды материала в лабораторных условиях. Выращенная таким образом подборка единообразных микробов или клеток уже может называться культурой.
Для того, чтобы выращивание прошло успешно, требуется наличие определенного оборудования, а также соблюдение условий, необходимых для роста и созревания культуры. Стандартно для культивирования используются:
- Питательная среда, на которой будущая культура должна расти.
- Факторы роста – питательные вещества, используемые клетками.
- Посуда, включающая в себя стерильные чашки Петри, инструменты для переноса клеток на среду и др.
- Дополнительное оборудование: термостаты, аппараты для ферментации и другие.
Также в процессе культивирования от лаборатории требуется соблюдение условий роста для каждой конкретной культуры. Ввиду того, что как клетки, так и микробы, требуют для себя условий, приближенных к естественным, в лаборатории должны поддерживаться различные условия роста при наличии разных культур. Основные условия: приемлемая для культур температура, влажность, давление, постоянная подача кислорода (для аэробных бактерий) или исключение доступа к кислороду (для анаэробных). (Рекомендуем статью: «Флуоресцентная микроскопия»)
Факторы роста
Факторами роста называют все питательные вещества, которые требуются бактериям и клеткам для оптимального роста и развития. В случае если сама среда не обладает достаточным количеством нужных элементов, их добавляют извне. При этом количество строго регулируется в зависимости от требований к конечной культуре.
К наиболее часто использующимся в современном лабораторном культивировании факторам роста относятся:
- Аминокислоты. Отдельным микроорганизмам или группам клеток требуются дополнительные аминокислоты извне. При этом требоваться может только одна кислота, например, лейцин и аргинин для стрептококков.
- Пуриновые или пиримидиновые основания. Также используются и их производные (аденин, гуанин и др.).
- Витамины. Они требуются для того, чтобы поддерживать работу коферментов, участвующих в метаболизме как клеток, так и бактерий.
В зависимости от типа культивируемых клеток или бактерий, фактор роста может как входить в состав питательной среды, так и вноситься извне.
Питательные среды и требования к ним
Питательная среда – это пространство, в котором находится необходимая группа клеток или бактерий. Среды бывают очень разными, в том числе и узкоспециализированными, для роста наиболее привередливых микроорганизмов. Однако существуют и общие требования, предъявляемые ко всем средам без исключения:
- Питательность. Среда должна содержать все необходимые вещества, которые используются бактериями для роста и не могут быть синтезированы ими без среды.
- Нужный уровень pH. Это требуется для регулирования проницаемости мембраны клетки и, как следствие, уровень питательных веществ, попадающих внутрь.
- Уровень осмотического давления, равный уровню давления в культивируемой клетке.
- Оптимальный для конкретной бактерии уровень влажности.
- Окислительно-восстановительные качества. Наибольшие различия требований по данной характеристике существуют при культивировании аэробов и анаэробов.
- Единый состав среды. Каждая конкретная среда должна иметь одинаковое количество веществ, чтобы не было вариативности в результатах культивирования.
При этом питательные среды могут значительно различаться по всем остальным характеристикам. Они могут быть как натуральными, так и синтезированными искусственно, а также жидкими, полужидкими или плотными.
Условия роста
Рост микроорганизмов и клеток невозможен без соблюдения определенных условий, таких как температура, влажность, давление, свет и аэрация (насыщение кислородом). Существуют микроорганизмы, которые имеют диаметрально противоположные требования по условиям роста. Для решения проблемы условий при культивировании различных клеток или микроорганизмов используется специальная аппаратура с камерами, внутри которых поддерживается нужный уровень температуры, света или давления. В одном таком устройстве, но в разных камерах, может быть одновременно несколько чашек Петри с материалом, имеющим различные требования по условиям роста. (Рекомендуем статью: «Инновационные технологии для поиска и разработки новых лекарств»)
Стерилизация посуды, сред и окружения
Одним из наиболее важных требований к процессу культивирования, является отсутствие загрязнений на оборудовании, при помощи которого происходит выращивание. Этого добиваются, проводя мероприятия по стерилизации. Стерилизация может проводиться несколькими способами, наиболее известные и используемые в современных лабораториях:
- Прокаливание. Экспресс-метод устранения микробиологического загрязнения через нагрев, может выполняться на спиртовке. Однако данный метод не может быть использован с чем-то, кроме игл и петель для переноса материала.
- Кипячение. Данный метод широко используется для устранения микробов, но споры бактерий он не устраняет.
- Сухожаровая стерилизация. Проводится в сушильном шкафу, наиболее часто используется для лабораторной посуды.
- Автоклавирование под давлением. Один из самых популярных и универсальных методов, однако многие материалы и среды разрушаются при использовании автоклавов.
Основным моментом в современном культивировании клеток и микроорганизмов, всегда будет являться неуниверсальность методик. Из-за большого разнообразия объектов культивирования, всегда будет необходимость подбирать наилучшие условия для конкретного объекта.
Источник