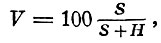Кислотность почв
Кислотно-щелочная характеристика, или реакция, — это способность почв проявлять свойства кислот и щелочей при взаимодействии с водой или растворами солей. Мерой реакции почв является соотношение в почвенном растворе водородных (Н + ) и гидроксильных (ОН — ) ионов. Реакция почв характеризуется величиной pH — отрицательным логарифмом активности водородных ионов в растворах. Почвы могут иметь кислую (pH 7) реакцию.
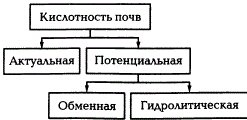
Различают два вида почвенной кислотности: актуальную и потенциальную, которая в свою очередь подразделяется на обменную и гидролитическую.
Виды кислотности почв
Актуальной кислотностью называется кислотность почвенного раствора. Она измеряется при взаимодействии почвы с дистиллированной водой (pHH2O). Актуальная кислотность зависит от наличия в почвенном растворе свободных органических и минеральных кислот (главным образом, угольной кислоты). Актуальная кислотность в почвах проявляется в диапазоне pH от 3 до 7.
Обменная кислотность обусловлена наличием в ППК обменных водорода и алюминия и определяется путем вытеснения ионов Н + и Аl 3+ раствором нейтральной соли КСl. Степень кислотности оценивают по величине pH солевой вытяжки. Обменная кислотность всегда больше актуальной. В почвах с ППК, насыщенны основаниями, обменная кислотность не определяется. Наиболее сильно она выражена в подзолистых почвах и краснозёмах. Существует четыре градации потенциальной кислотности почв, характеризуемой рНКСl.
Градации кислотности почв
Гидролитическая кислотность определяется путем воздействия на почву гидролитически щелочной соли. При взаимодействии почвы с солью происходит более полное вытеснение из ППК обменных водорода и алюминия. Для определения гидролитической кислотности принято использовать 1,0 н. раствор CH3COONa. Он выражается в мг-экв на 100 г почвы.
По величине гидролитической кислотности (Н) находят необходимую для известкования почвы дозу извести и рассчитываю степень насыщенности почвы основаниями (V, %):
где S — сумма поглощенных оснований.
Почвы, обладающие кислотностью, распространены очень широко в бореальном поясе, а также в условиях влажных субтропиков и тропиков.
В Российской Федерации в конце XX в. кислые почвы занимал 51 млн га сельскохозяйственных угодий, в том числе 43 % всей пашни. Среди них преобладают сильно- и среднекислые почвы (рНКСl менее 5,0), площадь которых составляла 28 млн га. Во многих странах площади, занятые кислыми почвами, увеличиваются, и растет степень их кислотности. Причин тому несколько. Одна из них — внесение минеральных, часто физиологически кислых удобрений, не сопровождаемое необходимым известкованием.
Для многих, особенно промышленных, регионов характерно выпадение кислых и даже сильнокислых дождевых осадков с pH примерно 4,0—4,5, содержащих серную и частично азотную кис-лоты. Кислые дожди служат дополнительным фактором ускорения развития кислотности почв. В Нечерноземной зоне РФ потери СаCO3 в результате антропогенного подкисления почв достигают 400—450 кг/га в год.
Негативное влияние повышенной кислотности на растения обусловлено несколькими причинами, среди которых наибольшее значение имеют следующие:
- недостаток Са 2+ — необходимого для растений элемента питания;
- повышенная концентрация ионов Аl 3+ , Мn 2+ , Н + ;
- изменение доступности растениям макро — и микроэлементов питания;
- изменение физических свойств почвы.
От величины pH зависят подвижность и доступность растениям практически всех элементов питания. Усвояемость фосфора максимальна при pH = 6,5, снижаясь как в более кислой, так и в щелочной среде. Только в сильнощелочных почвах при pH около 9 и выше растворимость фосфатов вновь возрастает.
В кислых почвах повышается растворимость соединений железа, марганца, алюминия, бора, меди, цинка. При избытке этих элементов продуктивность растений снижается. В то же время высокая кислотность понижает доступность такого важного микроэлемента, как молибден.
Оптимальный интервал pH связан не только с растворимостью почвенных компонентов, но и с физиологическими особенностями возделываемых культур. Для одних растений оптимум pH лежит в интервале 4,0 — 5,0 (чайный куст, клюква), для других — от 6,0 до 8,0 (вишня, груша, орех грецкий, слива, яблоня). Для снижения поденной кислотности в качестве химических мелиорантов используют различные материалы. Наиболее употребительны осадочные породы, состоящие преимущественно из кальцита, доломита СаМn(СO3)2, доломитизированные известняки, мергели. Кроме того, применяют известковые туфы и различные промышленные отходы: дефекат (отход свеклосахарного производства), другие шлаки. В большинстве мелиорантов действующим веществом является СаСО3.
С химической точки зрения карбонат кальция является лучшим средством для снижения почвенной кислотности.
При внесении карбоната кальция в кислую почву происходят реакции:
В результате этих реакций создаются наиболее благоприятные условия: почвенный поглощающий комплекс насыщается кальцием, а в почвенном растворе образуется слабая угольная кислота.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник
Сельское хозяйство | UniversityAgro.ru
Агрономия, земледелие, сельское хозяйство
Популярные статьи
Кислотность почвы
Кислотность почвы — свойство почвы, обусловленное наличием ионов водорода в почвенном растворе и обменных ионов водорода и алюминия в поглощающем комплексе почвы.
Интервал pH 5,5-7 соответствует наиболее агрономически благоприятной структуре почвы, высокому качеству гумуса и оптимальному водному режиму.
Реакция среды почвенного раствора
Реакция среды почвенного раствора — соотношение концентрации Н + и OH — ионов почвенного раствора, выраженное в виде pH водной или солевой вытяжки. Удобрения, как правило, изменяют реакцию почвенного раствора.
Реакция почвы оказывает влияние на питательный режим почв, рост, развитие и урожайность растений, деятельность микроорганизмов почвы, трансформацию форм питательных элементов удобрений и почвы, агрофизические, агрохимические, физико-химические и биологические свойства почв. Удобрения и мелиоранты позволяют регулировать реакцию почв в желаемую для возделываемых культур сторону.
Реакция почвенного раствора определяется концентрацией ионов водорода (Н + ) и гидроксид-иона (OH — ). В чистой воде с нейтральной реакцией, концентрация ионов водорода совпадает с концентрацией гидроксид-иона и равна 1⋅10 7 моль/л. При добавлении 1 ммоль соляной и азотной кислоты к 1 л воды, которые полностью диссоциируют в водном растворе, концентрация ионов водорода составит 1 ммоль Н + , или 1⋅10 3 моль/дм 3 . Концентрацию ионов водорода выражают через показатель pH, равный:
где CH + — концентрация ионов водорода в растворе, моль/дм 3 .
В растворе с нейтральной реакцией концентрация ионов водорода равна 0,0000001 = 1 · 10 -7 моль/дм 3 , или pH = 7.
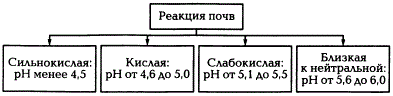
По реакции среды (рН) почвы деляться на:
Реакция почвенных растворов может колебаться в широких пределах от pH = 3-3,5, характерная для сфагновых торфов и лесных подстилок сфагновых лесов до pH = 10-11 у солонцов.
Для большинства возделываемых сельскохозяйственных культур благоприятны почвы с нейтральной или близкой к нейтральной реакцией, однако значительные площади сельскохозяйственных угодий характеризуются неблагоприятной реакцией.
Источник
КИСЛОТНОСТЬ ПОЧВЫ
КИСЛОТНОСТЬ ПОЧВЫ, свойство, обусловленное определённой концентрацией водородных ионов в почве.
Почвенная кислотность оказывает громадное влияние на развитие р-ний и почвенных микроорганизмов. Благоприятной для большинства с.-х. р-иий и для бактериальной флоры в почвах является слабокислая реакция почвенного раствора (см. Известкование почвы). Присутствие в растворе ионов Са и высокая буферность почв в отношении кислот ослабляют вредное влияние почвенной кислотности, между тем как присутствие в растворе ионов Al, Fe, Mn усиливает её токсичность для р-ний и почвенных микроорганизмов. Различают две формы кислотности почвы — актуальную и потенциальную. Актуальная кислотность почвы, или кислотность почвенного раствора (жидкой фазы почвы), зависит от концентрации в нём ионов Н и выражается обычно через рН раствора (рН — отрицательный логарифм концентрации водородных ионов, выраженной в грамм-эквивалентах на литр); при рН=7 — реакция раствора нейтральная, ниже 7 — кислая, выше 7 — щелочная; чем ниже рН, тем больше кислотность почвы. В большинстве случаев реакция почвенного раствора находится в пределах рН от 4 до 9. Потенциальная кислотность бывает обменная и гидролитическая. Обменная кислотность почв является более вредной и вызывает подкисление раствора нейтральной соли при взаимодействии её с почвой. По представлениям акад. К. К. Гедройца и ряда др. исследователей, эта форма потенциальной К. п. обусловливается присутствием ионов Н’, способных к обмену с катионами нейтральных солей, напр. с КС1, по уравнению: (Почва) Н+КСl↔(Почва) К+НС1. Обычно наблюдаемое появление Аl в солевых вытяжках из кислых почв, с этой точки зрения, объясняется растворением соединений алюминия в почвах кислотой, образующейся в результате обмена. В нек-рых почвах, при особых местных условиях почвообразования, наряду с обменным Н, по мнению акад. Гедройца, может присутствовать и обменный Al.
Согласно др. точке зрения, обменная кислотность почв обусловливается присутствием в них поглощённого Аl. При его вытеснении из почвы катионами нейтральных солей по уравнению: (Почва) Аl+3КСl2↔(Почва)К3 +АlСl3, в растворе появляются алюминиевые соли сильных кислот, к-рые, подвергаясь гидролизу (АlСl3+Н20↔Аl(ОН)С12 + НСl), обусловливают тем самым кислую реакцию солевых вытяжек из почв. В подтверждение этой точки зрения обычно указывается на эквивалентность между титруемой кислотностью солевых вытяжек из минеральных почв и содержанием в этих вытяжках Аl; в последнее время указанная точка зрения получила нек-рое подтверждение в работах В. А. Чернова, показавшего, что ионы Аl более энергично конкурируют с ионами Са за место в почвенном поглощающем комплексе, чем водородные ионы.
Наряду с указанными точками зрения, распространено мнение, согласно к-рому обменная К. п. обусловливается наличием в ней в поглощённом состоянии как ионов Н, так и ионов Аl; участие поглощённого Н в обменной К. п., повидимому, возрастает с увеличением содержания в ней органического вещества.
Др. формой потенциальной К. п. является гидролитическая кислотность. По представлениям ряда исследователей гидролитическая кислотность обусловливается присутствием в почвах в поглощённом состоянии ионов Н, не вытесняемых катионами нейтральных солей, но способных к замещению на основания из щелочей или гидролитически щелочных солей, напр., по уравнению: (Почва) Н +CH3COONa↔(Почва) Na +СН3СООН. Различие форм потенциальной К. п. с этой точки зрения можно объяснить наличием в ней поглощённых водородных ионов разной активности, поаналогии с различной активностью Н-ионов в многоосновных кислотах (напр., в фосфорной кислоте, в к-рой первый водород диссоциирует и замещается на основания при слабокислой реакции, между тем как второй и третий водород диссоциируют и замещаются на основания только при более щелочной реакции). Поэтому результаты определений почвенной кислотности находятся в зависимости от реакции солевого раствора, употреблявшегося для определения кислотности; последняя учитывается тем полнее, чем выше рН солевого раствора (после его взаимодействия с почвой).
С кислотностью почв тесно связан ряд их важнейших свойств, в частности состав почвенной микрофлоры, формы органического вещества, подвижность питательных соединений и др. Под влиянием гидролитической (и обменной) кислотности происходит разложение в почвах извести и применяемой в качестве удобрения фосфоритной муки. Кислотность почв надо принимать во внимание при выборе форм минеральных удобрений и их подготовки к внесению в почву (нейтрализация).
Происхождение кислотности в почвах связано с биологическими процессами. Так, напр., под пологом леса, в результате грибного процесса разложения древесного опада, образуется креновая кислота. Нисходящий ток воды, содержащий креновую кислоту, обусловливает вымывание из верхних слоев поглощённого кальция и образование гидролитической и обменной кислотности (см. Подзолистые почвы). Дерново-подзолистые почвы (пахотные) характеризуются след. показателями кислотности: рН солевой вытяжки от 4 до 6 (в преобладающей части 4 — 5); гидролитическая кислотность от 1 до 6 миллиграмм-эквивалентов на 100 г: обменная кислотность менее 1 миллиграмм-эквивалента на 100 г почвы. Степень насыщенности основаниями 50 — 80%; целинные подзолистые почвы отличаются более высокой кислотностью.
Значительной кислотностью обладают также почвы влажных субтропиков СССР (особенно краснозёмы). Слабой кислотностью характеризуются серые лесные почвы и выщелоченные чернозёмы. При систематическом применении кислых форм минеральных удобрений К. п. значительно увеличивается, а при внесении извести, золы и больших доз навоза, низинного торфа, наоборот, ослабляется. Ухудшая условия развития с.-х. р-ний, повышенная К. п. отрицательно отражается на эффективности многих важнейших агротехнических мероприятий, как-то: применение удобрений, введение и освоение травопольных севооборотов и т. д. Основным средством борьбы с повышенной К. п. является их известкование.
Для определения актуальной и потенциальной К. п. существует ряд методов. Актуальную кислотность почв устанавливают по величине рН, измеряемой в водных почвенных суспензиях, в почвенных растворах или в водных вытяжках из почв. рН водных почвенных суспензий лучше всего определять электрометрически со стеклянным электродом; хингидронный метод в этих условиях даёт иногда заметные ошибки (к почвам, содержащим подвижные соединения Fe и Мn или имеющим рН более 7,5, он неприменим вовсе). рН в почвенных растворах или в водных вытяжках из почв можно определять колориметрически.
Для определения потенциальной кислотности почв предложены многочисленные методы. Определение обменной кислотности (ненасыщенности почв) по методу Гедройца заключается в следующем: почва промывается 1,0 н. раствором ВаСl2 до прекращения подкисления фильтрата, после чего последний титруется щёлочью. Для определения в почве обменной кислотности и подвижного алюминия (метод А. В. Соколова) почву взбалтывают с 1,0 н. раствором КСl (при отношении почвы к раствору, как 1:2,5), после чего солевую вытяжку разделяют на 2 порции: первая титруется с прибавлением NaF для определения содержания НС1 в вытяжке, вторая — без прибавления NaF для определения обменной кислотности, зависящей от содержания HCl+AlCl3 в вытяжке; по разности устанавливается содержание подвижного алюминия в почве. Приближённое представление об обменной К. п. дают определения рН в 1,0 н. вытяжках КСl из почв; эти определения (с универсальным индикатором) широко применяются для установления потребности известкования почвы.
Гидролитическую кислотность (в сумме с обменной) определяют чаще всего ацетатным методом, в к-ром 1,0 н. уксусно-натриевую вытяжку из почвы (при отношении почва: раствор, как 1:2,5) титруют щёлочью и результат умножают на эмпирический коэф-т 1,75, в связи с неполнотой учёта кислотности при данном отношении почвы к раствору. В действительности этот коэф-т для разных почв не является одинаковым; кроме того, определения кислотности в раз-ных почвах производятся по этому методу при разных величинах рН равновесного ацетатного раствора, что является существенным недостатком метода. Весьма перспективным при изучении потенциальной кислотности является метод кривых титрования водных и особенно солевых почвенных суспензий (Ремезов, Алямовский и др.). В практике известкования в прошлые годы определения гидролитической кислотности ацетатным методом широко использовались для установления доз извести на кислых почвах. Однако в настоящее время широко рекомендуются более низкие дозы извести, составляющие лишь доли гидролитической кислотности (см. Известкование почвы).
Для характеристики К. п. может служить также величина степени их насыщенности основаниями V, вычисляемая по формуле:
где S — сумма поглощённых оснований в почве, Н — её гидролитическая кислотность. Чем ниже насыщенность почвы основаниями, тем больше её кислотность.
Литература: Аскинази Д., Пути к определению потребности почв в извести. Методы учета кислотности и емкости поглощения почв, М.- Л., 1931; Вильямс В., Почвоведение (Земледелие с основами почвоведения), 6 изд., М., 1949; Владимиров А., Физиологические основы применения азотистых и калийных удобрений, М., 1948; Гедройц К., Учение о поглотительной способности почв, 4 изд., М., 1933; Карпинский Н., Характеристика почв и почвенное районирование дерново-подзолистой зоны в связи с химизацией, «Вестник сельскохозяйственной науки», [Раздел] Агротехника, М., 1940, вып. 5; Кедров-Зихман О., Ярусов С. [и др.], Отзывчивость сельскохозяйственных растений на известкование в связи с почвенной кислотностью и степенью насыщенности почв основаниями, М., 1934 (Труды Всесоюзного н.-и. института удобрений, агротехники и агропочвоведения им.К.К. Гедройца, вып. 6); Чернов В., О природе почвенной кислотности, М. — Л., 1947.
- Сельскохозяйственная энциклопедия. Т. 2 (Ж — К)/ Ред. коллегия: П. П. Лобанов (глав ред) [и др.]. Издание третье, переработанное — М., Государственное издательство сельскохозяйственной литературы, 1951, с. 624
Источник