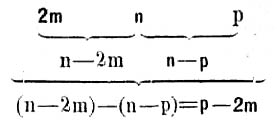Экология СПРАВОЧНИК
Информация
Определение щелочности почв
Щелочность почвенного раствора зависит от наличия в нем свободных гидроксильных ионов (ОН»). Вызывается она главным образом находящимися в почвенном растворе карбонатами и гидрокарбонатами щелочных и щелочноземельных металлов, которые при взаимодействии с водой образуют слабые кислоты и сильные основания, определяющие щелочную реакцию. Щелочность почвенного раствора может вызываться также гидролитически щелочными солями кремневой и органических кислот.[ . ]
Установление щелочности необходимо для разработки мероприятий по ее устранению.[ . ]
Появление в результате этой реакции в растворе иона НСО.7 приводит к снижению pH (ниже 8,2) и обесцвечиванию фенолфталеина. При этом, согласно уравнению реакции, сода оттитровывается лишь наполовину, то есть до образования бикарбоната.[ . ]
Ход анализа. К 25—50 мл водной вытяжки в конической колбочке прибавляют 1—2 капли фенолфталеина (реактив 1) и при появлении розовой окраски (что указывает на присутствие нормальных карбонатов) жидкость титруют 0,01 н. раствором Н2504 (реактив 2) до исчезновения окраски. Для большей точности определения конца титрования следует рядом с колбочкой, в которой проводят титрование, поставить такую же колбочку с таким же количеством вытяжки, но без фенолфталеина. Титруют до тех пор, пока окраска жидкости в колбочке с фенолфталеином не сравняется с окраской жидкости в колбочке без индикатора.[ . ]
Ход анализа. После определения щелочности от нормальных карбонатов, а при их отсутствии — непосредственно после добавления фенолфталеина (если не появилась окраска) в ту же колбочку приливают две капли метилоранжа (реактив 3) и титруют 0,01 н. раствором На504 до возникновения розовой окраски. Можно взять новую порцию вытяжки. Для точности титрования колбочку ставят на лист белой бумаги, рядом с ней помещают другую колбочку такого же объема и с тем же количеством вытяжки и индикатора. Титруют жидкость до слабого ее порозове-ния.[ . ]
Источник
Работа 1.5. ОПРЕДЕЛЕНИЕ ЩЕЛОЧНОСТИ ПОЧВ



Щелочность почвенного раствора зависит от наличия в нем свободных гидроксильных ионов (ОН – ). Вызывается она главным образом находящимися в почвенном растворе карбонатами и гидрокарбонатами щелочных и щелочно-земельных металлов, которые при взаимодействии с водой образуют слабые кислоты и сильные основания, определяющие щелочную реакцию. Щелочность почвенного раствора может вызываться также гидролитически щелочными солями кремневой и органических кислот.
Установление щелочности необходимо для разработки мероприятий по ее устранению.
Принцип определения щелочности, вызывающейся нормальными карбонатами. Некоторый объем водной вытяжки титруют серной кислотой в присутствии фенолфталеина:
Появление в результате этой реакции в растворе иона HCO3 — приводит к снижению рН (ниже 8,2) и обесцвечиванию фенолфталеина. При этом, согласно уравнению реакции, сода оттитровывается лишь наполовину, т. е. до образования бикарбоната.
Материалы и оборудование: аналитические весы, почва (воздушно сухая), ротатор.
Реактивы: Фенолфталеин, 0,01 н. раствор H2SO4, метилоранж.
Ход анализа. К 25—50 мл водной вытяжки в конической колбочке прибавляют 1—2 капли фенолфталеина и при появлении розовой окраски (что указывает на присутствие нормальных карбонатов) жидкость титруют 0,01 н. раствором H2SO4 до исчезновения окраски. Для большей точности определения конца титрования рядом с колбочкой, в которой проводят титрование, ставят такую же колбочку с таким же количеством вытяжки, но без фенолфталеина (свидетель). Титруют до тех пор, пока окраска жидкости в колбочке с фенолфталеином не сравняется с окраской жидкости в колбочке без индикатора.
Вычисление результатов анализа. Расчеты ведут по формуле
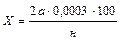
где X – количество ионов СО3 2– % к массе почвы;
а – количество 0,01 н. раствора H2SO4, израсходованного на титрование, мл;
2 – коэффициент, указывающий, что число миллилитров кислоты надо удвоить, так как при титровании обесцвечивание раствора наступает, как только карбонат перейдет в бикарбонат, т. е. когда фактически оттитровывается лишь половина карбонат-ионов;
0,0003 – граммы СО3 2– , соответствующие 1 мл 0,01 н. H2SO4;
н – навеска почвы, отвечающая объему вытяжки, взятой для титрования, г;
100 – для пересчета результатов в проценты.
Принцип определения общей щелочности. Метод заключается в титровании вытяжки кислотой в присутствии индикатора – метилоранжа, т. е. до рН 4,4:
Ход анализа. После определения щелочности от нормальных карбонатов, а при их отсутствии сразу же после добавления фенолфталеина (если не появилась окраска) в ту же колбочку (или в другую — с новой порцией вытяжки) приливают две капли метилоранжа и титруют 0,01 н. раствором H2SO4 до возникновения розовой окраски. Для точности титрования колбочку ставят на лист белой бумаги, а рядом с ней помещают другую колбочку такого же объема и с тем же количеством вытяжки и индикатора. Титруют жидкость до слабого ее порозовения.
Вычисление результатов анализа. Определяя общую щёлочность, суммируют количество кислоты, израсходованной при титровании вытяжки в колбочках как с фенолфталеином, так и с метилоранжем. Расчет ведут по формуле
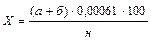
где X – общая щелочность, % НСО3 – к массе почвы;
а – количество 0,01 н. H2SO4, пошедшей на титрование вытяжки с фенолфталеином, мл;
б – количество той же кислоты, затраченное на титрование такого же объема с метилоранжем, мл;
0,00061 – количество НСО3 – , соответствующее 1 мл 0,01 н. раствора H2SO4, г;
н – навеска почвы, отвечающая объему вытяжки, взятой для титрования, г;
100 – для пересчета результатов в проценты.
Источник
Определение общей щелочности почвы
Щелочность водных вытяжек из почвы обусловливается присутствием в них карбонатов щелочных и щелочно-земельных металлов и щелочных солей кремневой и органических кислот; для определения щелочности, вызываемой в отдельности каждой из этих групп солей, не существует методов; можно определять только общую щелочность, вызываемую совокупностью этих соединений; вообще говоря, в большинстве почв эта общая щелочность вызывается главным образом карбонатами. Но общую щелочность почвы можно расчленить, с одной стороны, на щелочность, вызываемую нормальными карбонатами (углекислыми щелочами, преимущественно Na2CO3; сюда же войдет, по всей вероятности, щелочность, вызываемая щелочными солями органических и кремневой кислот), и на щелочность, вызываемую всеми двуглесолями; а с другой стороны, на щелочность, вызываемую углесолями щелочных металлов (сюда же войдет, по всей вероятности, щелочность, вызываемая щелочными солями кремневой и органических кислот), и на щелочность, вызываемую щелочноземельными карбонатами.
По ходу анализа удобнее начинять с определения щелочности, вызываемой нормальными карбонатами.
Определение щелочности, вызываемой нормальными карбонатами, или количества иона СО3. К 25-50 к. стм. водной вытяжки в небольшом стаканчике прибавляют 1-2 капли фенол-фталеина 1 ); если жидкость окрасилась в красный цвет, то это признак присутствия в ней нормальных карбонатов; в этом случае жидкость титруют 0,01 или 0,02 нормальной серной или соляной кислотой до исчезновения окраски, для большей точности определения конца титрования следует рядом со стаканчиком, в котором производится титрование, поставить такой же величины другой стаканчик с таким же количеством той же вытяжки; оба стаканчика должны стоять на листе белой бумаги; в стаканчик, в который прибавлен фенолфталеин, приливают по каплям титрованную кислоту до тех пор, пока окраска жидкости в нем не сравняется с окраской жидкости в стаканчике, не содержащем фенол-фталеина.
1 ) Приготовление индикатора: 1 гр. фенол-фталеина растворяют в 100 к. стм. 96% алкоголя.
Так как розовая окраска от фенол-фталеина исчезает тогда, когда весь нормальный карбонат перейдет в двууглекислый согласно уравнению: 2 Na2CO3 + H2SO4 = 2 NaHCO3 + Na2SO4, то число к. стм. истраченной кислоты (m), умноженное на 2, т.-е. 2m, будет соответствовать количеству нормального карбоната. Само собою разумеется, что если предполагается производить определение количества нормальных карбонатов, то необходимо для приготовления вытяжки применять воду, лишенную углекислоты.
Определение общей щелочности. В тот же стаканчик с водной вытяжкой от предыдущего определения после прибавления к ней фенол-фталеина, если в вытяжке не оказалось нормального карбоната, или после окончания вышеописанного титрования, если в вытяжке таковой оказался, прибавляют одну — две капли метил-оранжа 1 ) и продолжают титровать той же кислотой до появления розовой окраски. Как и в предыдущем случае, титрование необходимо вести при наличности другого стаканчика, такого же диаметра с таким же количеством вытяжки и таким же количеством метил-оранжа; оба стаканчика должны стоять на листе белой бумаги; оттенки в жидкостях обоих стаканов до титрования должны быть одинаковы; при титровании нужно сравнивать между собой цвет жидкости в обоих стаканах, и как только оттенок в стакане, в который приливается кислота, изменится по сравнению с оттенком в другом стакане, слегка порозовеет, титрование окончено; при некотором навыке легко улавливается малейшее изменение в оттенке.
Все количество кислоты, пошедшее на титрование в присутствии фенол-фталеина и метил-оранжа, будет соответствовать общей щелочности взятого количества водной вытяжки; обозначим это количество кислоты через n.
1 ) Приготовление индикатора: 0,05 гр. метил-оранжа растворяют в 100 к. стм. воды.
Определение щелочности, вызываемой углекислыми щелочами. Для этого определения необходимо выделить из водной вытяжки углекислый кальций. По нашим данным, наилучший результат дает следующий способ.
50 к. стм. вытяжки выпаривается досуха на водяной бане в небольшой платиновой чашечке; не давая чашке остыть, обрабатывают содержимое возможно меньшими порциями горячей воды, не содержащей углекислоты, при помощи стеклянной палочки с каучуковым наконечником, и фильтруют каждый раз раствор через маленький фильтр (7 стм. в диаметре) в стаканчик; для полного растворения щелочных карбонатов и промывания чашки вполне достаточно 10 порций воды; кроме того еще ополаскивают два раза фильтр. Чем меньше будет употреблено воды и чем быстрее будет окончено растворение (быстро фильтрующая воронка и хорошо прилаженный фильтр), тем полнее будет отделение щелочных карбонатов от щелочноземельных. Если вытяжка содержит сравнительно много последних, что будет видно по осадку на фильтре, то собранный фильтрат следует вторично выпарить и т. д. Иногда при фильтрации получается мутный фильтрат; в таких случаях приходится выпаривать новое количество вытяжки и фильтровать через плотный фильтр; титровать с мутью же ни в каком случае не следует, так как в ней могут содержаться щелочноземельные карбонаты. Полученный фильтрат, содержащий щелочные углесоли, как нормальные, так и двууглекислые, по охлаждении титруется в присутствии метил-оранжа 0,01 или 0,02 норм. кислотой совершенно так же, как при предыдущем определении, до появления розового оттенка; пусть при этом титровании пойдет р к. стм. 0,01 или 0,02 нормальной кислоты. Тогда на основании трех полученных данных (2m, n, р) производят расчет для взятого количества вытяжки по следующей схеме:
Примечание 1. Определение щелочности представляет особый интерес в солонцах и вообще солонцеватых почвах (т. е. в почвах или в горизонтах почвы, содержащих в поглощающем комплексе натрий). Но здесь особенно необходимо иметь ввиду условность получаемых результатов, их зависимость от продолжительности и способа хранения образцов в лаборатории, от соотношения между почвой и водой при приготовлении водных вытяжек, от времени взаимодействия между почвою и водою (вытяжки из солонцов фильтруются очень медленно и неодинаково медленно у различных солонцев, а этот промежуток времени может столько отразиться на щелочности). Особенно сильно все это сказывается в тех солонцах, в которых содержатся щелочно-земельные карбонаты и где поэтому при взаимодействии между почвою и водою идет усиленный обмен цеолитного (и гуматного) натрия на щелочно-земельные металлы карбонатов с образованием соды; здесь, напр., более продолжительная фильтрация вытяжки сейчас же отражается повышением содержания соды, так как, вследствие доступа углекислоты воздуха, вместо прореагировавшего с почвою двууглекислого кальция получается в растворе новое его количество, а значит и новое количество соды и т. д.
Примечание 2. Вытяжки из солонцеватых почв часто бывают очень интенсивно окрашенными гуматами; для определения щелочности приходится тогда брать малые количества и разбавлять их для титрования водою. Общую щелочность, Са (НСО3) и NaHCO3 можно в этом случае определять, выпаривши вытяжку и прокаливши остаток; при этом только необходимо иметь ввиду, что при таком ходе анализа определяется и вся та сода, которая должна возникнуть из натрия, связанного с гу-матами и кремнекислотой, находящимися в вытяжке. Такое определение во всяком случае может представлять интерес и помимо выше описанного.
Источник
Почвенная кислотность и щелочность, их формы и методы определения



Кислотность или щелочность водного раствора, в том числе почвенного, определяется соотношением ионов Н + и гидроксила ОН — .
При разложении органических остатков образуется много органических кислот, которые при определенных условиях нейтрализуются не полностью и поэтому почвы приобретают кислую реакцию. Первоисточником кислотности любой почвы являются водородные ионы угольной, и особенно органических, кислот, образующихся при разложении органических остатков и выделяемых корнями растений. Реакцию почвенного раствора выражают величиной рН, представляющей собой отрицательный логарифм концентрации водородных ионов в растворе. почвы могут иметь нейтральную (рН 7), кислую (рН менее 7) или щелочную (рН более 7) реакцию.
Кислотность делится на: актуальную (активную) и потенциальную (скрытую), которая, в свою очередь, подразделяется на обменную и гидролитическую.
Актуальная кислотность – кислотность почвенного раствора, обусловленная повышенной концентрацией ионов водорода по сравнению с ионами гидроксила. Она определяется наличием в нем водорастворимых кислот – щавелевой, лимонной, фульвокислот, гидролитических кислых солей, а прежде всего угольной кислоты (Н2СО3). Для большинства почв реация почвенного раствора рН колеблется от 4до 8. В дерново-подзолистых и торфяно-болотных почвах она находится в пределах 4,0-5,5.
Актуальная кислотность имеет большое значение в жизни растений и микроорганизмов.
Потенциальная кислотность – кислотность твердой фазы почвы. Она обусловлена наличием ионов водорода и алюминия в ППК в поглощенном состоянии. Подразделяется на два вида: обменную и гидролитическую
Обменная кислотность обусловлена наличием в поглощенном состоянии ионов водорода и алюминия, способных обмениваться на катионы нейтральных солей, например хлорида калия. Обменная кислотность- это кислотность, обусловленная обменно-поглощенными ионами водорода и алюминия, которые извлекаются из почвы при ее обработке раствором нейтральной соли. В величину обменной кислотности входит и актуальная кислотность. Следовательно, обменная кислотность всегда больше, чем актуальная, а рН солевой вытяжки ниже рН водной.
Обменная кислотность наиболее ярко выражена в подзолистых и красноземных почвах (рН 3-4). Для пахотного слоя дерново-подзолистых почв рН солевой вытяжки колеблется от 4 до 6, а в хорошо окультуренных почвах повышается до 6,0-6,5.
У почв с повышенной обменной кислотностью неблагоприятные агрономические свойства, которые могут быть улучшены известкованием и внесением достаточного количества органических удобрений
Гидролитическая кислотность (Hr) определяется наличием в почве поглощенных ионов водорода и алюминия, способных обмениваться на катионы гидролитически щелочных солей. Эта кислотность обнаруживается в растворе после обработки почвы уксуснокислым натрием и включающая все содержащиеся в почве ионы водорода — не только легко подвижные, но и менее подвижные, способные к замене на основания лишь при щелочной реакции среды.
Гидролитическая кислотность является первой формой кислотности, появляющейся при обеднении почвы основаниями. В дерново-подзолистых почвах ее уровень может быть значительным при сильно выраженной обменной кислотности, и в этих почвах она характеризует насыщенность почв основаниями.
Щелочная реакция почвенных растворов и водных вытяжек обуславливается наличием повышенной концентрации в почве ионов гидрооксила ОН — . Различают актуальную и потенциальную щелочность.
Актуальная щелочность обусловлена наличием в почвенном растворе гидролитически щелочных солей: карбонатов и гидрокарбонатов калия и натрия, кальция и магния (Na2CO3 , NaHCO3, Актуальная щелочность выражается величиной рН.
При характеристике актуальной щелочности природных вод и почвенных растворов различают общую щелочность, щелочность от нормальных карбонатов и щелочность от гидрокарбонатов. Эти виды щелочности различаются по граничным значениям рН. Щелочность от нормальных карбонатов является результатом обменных реакций почв, содержащих поглощенный натрий.
Потенциальная щелочность обусловлена наличием в почве поглощенного натрия и проявляется при взаимодействии с угольной кислотой. Потенциальная щелочность дает представление о суммарном содержании щелочей в почвенном растворе.

Щелочная реакция неблагоприятна для большинства растений, а почвы приобретают неблагоприятные физические и химические свойства. При рН 9-10 они отличаются твердостью в сухом, вязкостью и липкостью во влажном состоянии. Щелочность почв характерна для солонцов, каштановых почв, сероземов, засоленных почв. Устраняют щелочность гипсованием, которое проводится при содержании более 10% поглощенного натрия от емкости катионного обмена.
Источник