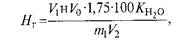Работа 1. Определение актуальной и обменной кислотности почв потенциометрическим методом
Концентрация водородных ионов в растворе может быть определена потенциометрическим методом. Для этой цели применяются специальные приборы, называемые потенциометрами. Чаще всего используют лабораторный рН-метр ЛПУ-01 (лабораторный потенциометр универсальный). В последние годы широко применяют прибор для лабораторного и полевого исследования почв – преобразователь рН-метрический «Статус-2» (2000).
Данные измерительные приборы состоят из собственно потенциометра и двух электродов: измерительного и электрода сравнения.
В качестве измерительного электрода применяют стеклянный и мембранный электроды, потенциал которых определенным образом связан с рН раствора или почвы и определяется им.
Стеклянный электрод представляет собой трубку с полым шариком из литиевого электродного стекла внизу. При погружении этого электрода в раствор в результате обмена ионы лития в поверхностном слое стекла замещаются ионами водорода. Трубка внутри заполнена раствором и содержит внутренний электрод.
В качестве электрода сравнения в природе чаще используют хлорсеребряный электрод, потенциал которого постоянен и не зависит от рН раствора. В нем насыщенный раствор хлористого калия медленно вытекает по трубке в анализируемый раствор, не допуская проникновения ионов из анализируемого раствора в систему электрода сравнения.
Потенциометрический метод определения рН основан на измерении электродвижущей силы (ЭДС), возникающей при опускании в почвенную суспензию, в водную или солевую вытяжку двух электродов. Между электродом сравнения и измерительным электродом возникает разность потенциалов, которую можно измерить. По ее величине можно рассчитывать величину рН анализируемого раствора. Если прибор градуирован в милливольтах и в единицах рН, то необходимость расчета отпадает. Преобразователь рН-метрический «Статус-2» цифренно преобразует входной сигнал в ЭДС и рН, которые отображаются на цифровом индикаторе прибора.
Цель работы: изучить и определить виды кислотности (актуальную и обменную) у различных типов почв, приобрести навыки работы с измерительными приборами.
Материалы и оборудование: рН-метр, почвенные сита с диаметром ячеек 1 мм, фарфоровые чашки с пестиками, колбы объемом 100 мл, мерные стаканчики, фильтровальная бумага, образцы почв.
Реактивы: дистиллированная вода, 0,1 н раствор НCl, насыщенный раствор КCl, 1 н раствор КCl, буферные растворы на рН-метр.
Объект исследования: различные типы почв (чернозём, дерново-подзолистая, темно-серая лесная, торф, солонец).
Ход работы. Для определения рН почвенного образца необходимо выполнить следующие этапы: подготовить электроды для работы, подготовить прибор для измерения, подготовить почвенные вытяжки для анализа.
При подготовке электродов их необходимо вымочить в 0,1 н растворе НCl в течение 5–7 суток до установления постоянного потенциала асимметрии. Электрод сравнения заполнить насыщенным раствором КCl и дать отстояться в течение суток.
Для подготовки прибора к работе следует проверить его исправность. После его включения и подключения электродов провести настройку прибора по буферным растворам и установить температурную компенсацию.
Известно, что при установлении рН в вытяжке из минеральных горизонтов, принято соотношение почва/вода (или раствор 1 н КCl) 1:5; при изучении торфяных почв и лесных подстилок – 1:25. Поэтому для приготовления почвенной вытяжки необходимо взвесить на весах две навески массой по 10 г воздушно-сухой почвы, просеянной через сито с диаметром отверстий 1 мм. Навески почвы поместить в конические колбы объемом 100 мл и добавить в одну колбу 50 мл дистиллированной воды (водная вытяжка почвы), а в другую – 50 мл раствора хлористого калия (солевая вытяжка). Водная вытяжка почвы служит для определения актуальной кислотности почвы, а солевая вытяжка с КCl – для определения обменной кислотности. Каждую колбу со смесью закрыть пробкой и взболтать в течение 5 минут. В полученной суспензии определить рН почвенного раствора на рН-метре. Для этого почвенную вытяжку перелить в стаканчик для анализируемого раствора и аккуратно погрузить туда электроды на глубину не менее 3 см. Перед погружением и после него электроды хорошо промыть дистиллированной водой и просушить фильтровальной бумагой. Измерения проводить при открытом отверстии электрода сравнения, после чего его закрыть во избежание испарения раствора хлористого калия в нерабочем режиме.
Задание: приготовьте водную и солевую (КCl) вытяжки различных типов почв, проведите измерения величины рН на приборе. Полученные результаты запишите в таблицу 13. Ранжируйте и сравните типы почв по кислотности.
Источник
ОПРЕДЕЛЕНИЕ РЕАКЦИИ СРЕДЫ ПОЧВЫ (рН) ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ
Практические занятия
Для определения рН почвы потенциометрическим методом используют иономер, к которому подсоединяют стеклянный измерительный электрод и хлорсеребряный электрод сравнения. Рабочая часть измерительного электрода — стеклянная мембрана. При измерении рН между мембраной и раствором (суспензией) возникает разность потенциалов, которая зависит от активности ионов водорода в растворе. Поскольку приборы откалиброваны в единицах рН, то по разности потенциалов на стеклянном электроде и электроде сравнения определяют рН.
Для определения актуальной кислотности 10 г почвы взвешивают на весах с точностью до 0,1 г и переносят в стеклянный стаканчик на 50 мл, прибавляют 25 мл дистиллированной воды, чтобы отношение почва раствор составило 1:2,5. содержимое стаканчика перемешивают в течение 5 мин стеклянной палочкой. В суспензию помешают стеклянный измерительный электрод и хлор-серебряньй электрод сравнения. Измеряюг рН на потенциометре. При определении обменной кислотности измеряют рН солевой суспензии, выполняя все те же операции, что и при определении актуальной кислотности, только вместо дестиллированной воды к почве приливают 25 мл н. раствора КС1. При анализе торфяных почв и лесных подстилок соотношение почва раствор составляет 1:25.
ОПРЕДЕЛЕНИЕ ГИДРОЛИТИЧЕСКОЙ КИСЛОТНОСТИ
Метод определения гидролитической кислотности основан на том, что при взаимодействии раствора ацетата натрия (СН3ООNа)с почвой образуется уксусная кислота. Эту кислоту оттитровывают щелочыо и по количеству щелочи, пошедшей на титрование, судят о величине гидролитической кислотности.
Для анализа на технохимических весах отвешивают 20 г воздушно-сухой почвы, просеянной через сито с отверстиями диаметром 1 мм, и высыпают в колбу на 200 мл. К почве приливают 50 мл 1 н. раствора СН3ООNа и взбалтывают содержимое колбы в течение 1 ч. Часовое взбалтывание можно заменить пятиминутным с последующим отстаиванием суспензии в течение суток. Суспензию отфильтровывают через сухой складчатый фильтр. Перед фильтрованием жидкость хорошо взбалтывают, чтобы перенести почву на фильтр. Если фильтрат мутный, его снова фильтруют через тот же фильтр. Затем отбирают 25 мл прозрачного фильтрата и переносят в коническую колбу на 100 мл. Прибавляют 1. 2 капли фенолфталеина и оттитровывают фильтрат 0,1 Н. раствором NаОН до появления слабо-розовой окраски, не исчезающей в течение 1 мин. Гидролитическую кислотность, мг-экв/100г почвы, вычисляют по формуле:
где: V1 — объем раствора NаОН, пошедшего на титрование взятого объема фильтрата, мл;
н — нормальность NаОН; V0 — общий объёмфильтрата, мл; 1,75 — поправка на полноту вытеснения ионов водорода; 100 — коэффициент пересчёта на 100 г почвы;
m — навеска почвы, г; V2 —объем фильтрата, взятого для титрования, мл.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Лабораторная работа № 7 определение актуальной и обменной кислотности почвы (рН) потенциометрическим методом
Цель работы освоить потенциометрический метод определения кислотности почвы.
Основные понятия. Кислотность почвы имеет более широкий смысл, чем кислотность обычного раствора. В зависимости от того, в каком состоянии находятся в почве ионы водорода, различают следующие виды кислотности: актуальную (почвенного раствора) и потенциальную с подразделением последней на обменную и гидролитическую (Рис.2).
Актуальная кислотность – это кислотность почвенного раствора, которая характеризуется величиной рН, равной
–lg[H + ], где [H + ] – активность ионов водорода в почвенном растворе, в молях Н + на литр почвенного раствора. рН 7 – щелочной. В почвоведении принято называть нейтральными почвы со значениями рН от 6,5 до 7 .
Рис.2 Виды кислотности в почве
Потенциальная кислотность – способность твердой фазы почвы проявлять себя как слабая кислота при взаимодействии с растворами солей вследствие появления в растворе дополнительного количества ионов Н + , вытесняемых из почвенно–поглощающего комплекса. Наиболее сильно на кислотность почвы оказывают влияние катионы алюминия, вытесняемые из ППК.
Катионы водорода присутствуют не только в растворе, но и на участках обмена катионами твердой фазы почвы, и тогда говорят об обменной кислотности, как части потенциальной, которую также измеряют в единицах рН.
Природа обменной кислотности обусловлена составом и свойствами почвенных коллоидов кислота. Источником обменного водорода могут служить органические кислоты и угольная кислота. Катионы водорода этих кислот внедряется в диффузный слой почвенных коллоидов, занимая место оснований, выщелачивающихся или выпадающих в осадок:
Обменную кислотность определяют по концентрации титруемых ионов Н + в вытяжке 1н раствора хлористого калия. При взаимодействии нейтральной соли с почвенно – поглощающим комплексом обменные ионы водорода и алюминия вытесняются в почвенный раствор:
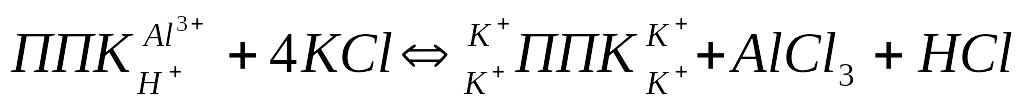
Далее хлорид алюминия – соль слабого основания и сильной кислоты – подвергается гидролизу, причем гидролиз в обычных условиях идет, в основном, по 1 – ой ступени:
Гидролитическая кислотность равна величине потенциальной кислотности почвы, которая формируется при взаимодействии почвы с раствором гидролитически щелочной соли (соли сильного основания и слабой кислоты).
Кислотность почвы – величина не постоянная. подкисление почв происходит в результате
абсорбции почвенным раствором из атмосферы СО2 ;
воздействия кислотных дождей;
изменения состава ППК за счет выщелачивания обменных Са 2+ и Mg 2+ потоком воды просачивающихся через почву осадков;
выветривания алюмосиликатных минералов, входящих в состав почвообразующей породы, при этом соли алюминия попадают в почву и подвергаются кислотному гидролизу, в результате которого ионы Н + поступают в почвенный раствор;
применения физиологически кислых минеральных удобрений (аммиачной селитры, калийной соли и др.);
выделения органических кислот при разложении растительных остатков, корневой деятельности растений и микроорганизмами.
С увеличением кислотности почв увеличивается подвижность и доступность для растений ионов тяжелых металлов, увеличивается количество обменного алюминия, в результате чего фосфаты выпадают в осадок.
Для суждения о кислотности почвы определяют рН водного и солевого растворов (водная и солевая вытяжка). Величина рН водного раствора характеризует актуальную кислотность, а солевого – обменную кислотность почвы. Обычно рН солевой вытяжки ниже рН водной вытяжки, так как обменные катионы водорода вытесняются нейтральной солью с поверхности почвенных частиц в раствор.
Величину рН можно определить с помощью индикаторов в прозрачных и бесцветных растворах и потенциометрическим методом в суспензиях. Электрохимическими методами можно определять рН в прозрачных и мутных растворах и непосредственно в почвенных суспензиях. В настоящее время, в основном, пользуются потенциометрическим методом, так как он прост, определение требует немного времени, что важно при массовых анализах.
Потенциометрическое определение кислотности почвы
Принцип метода. Метод потенциометрии основан на измерении электродвижущей силы (ЭДС), возникающей при опускании в почвенную суспензию, в водную или солевую вытяжку двух разных электродов (индикаторного и электрода сравнения).
Применяемые в практике приборы откалиброваны в единицах рН. Потенциал одного электрода – электрода сравнения – не зависит от значения рН испытуемого раствора. В качестве электрода сравнения используется хлорсеребряный электрод. Потенциал второго электрода – индикаторного – зависит от рН раствора. В качестве индикаторного используется стеклянный электрод. Разность потенциалов между электродами прямо пропорциональна рН.
Перед измерением калибруют рН – метр по буферным растворам и проводят измерение в соответствии с инструкциями изготовителя прибора.
Оборудование: потенциометр рН – 121; индикаторный электрод – стеклянный; электрод сравнения – хлорсеребряный; технические весы; фарфоровая ложка; стаканы стеклянные (V=100 мл) – 2 шт.; мерные цилиндры (V=50 мл) – 2 шт.; промывалка.
Подготовка образца почвы осуществляется в лаб. работе № 1.
На технических весах берут две навески по 10 г подготовленного образца почвы в стеклянные стаканы.
Готовят водную вытяжку из почвы, приливая к навеске 50 мл дистиллированной воды (соотношение почва : вода = 1: 5).
Готовят солевую вытяжку из почвы, приливая к навеске 50 мл 1 н раствора KCl (из расчета почва : раствор = 1:5).
Погружают электроды последовательно в первый и второй стаканы; проводят измерения на рН – метре водной и солевой вытяжек, предварительно включив магнитную мешалку. Измеренное значение рН в течение 5 сек не должно изменяться более, чем на 0.02.
после каждой пробы электроды промывают и высушивают фильтровальной бумагой.
Записывают результаты измерений в таблицу12.
Результаты потенциометрического определения кислотности почвы
Источник
Тема: Определение кислотности почвы потенциометрическим методом
Лабораторная работа № 3
Теория. Кислотно-основные свойства (реакция среды) почвы имеют важное генетическое и агротехническое значение. Они определяют интенсивность внутрипочвенного выветривания, подвижность химических элементов и соединений, биологическую активность почвы, трансформацию органического вещества. Для выращивания сельскохозяйственных растений важно соответствие реакции среды почвенного раствора диапазону оптимальных значений рН, который различен для разных видов. Важен учет кислотно-основных свойств почв для эффективного использования удобрений, которые сами могут быть факторами изменений рН почвенного раствора.
Кислотность почв— это способность почвы подкислять почвенный раствор имеющимися в почве кислотами и обменно-поглощенными катионами водорода, а также алюминия, способного при вытеснении из ППК образовывать гидролитически кислые соли.
Внешним источником подкисления почв могут быть атмосферные осадки, содержащие растворы кислот (угольной, серной, азотной), особенно в промышленных районах. При разложении растительных остатков, поступающих на почву, образуются органические кислоты, особенно это характерно для лесного (в большей степени хвойного) опада.
В почвах имеются также внутренние источники кислотности:
— корни и микоорганизмы образуют при дыхании СО2, который растворяется в почвенном растворе с образованием угольной кислоты;
— Н + выделяется в процессе разложения органического вещества почвы в результате минерализации, нитрификации и выщелачивания;
— органические кислоты, которые выделяются из растительности, органического вещества почвы и корней растений;
— корни выделяют Н + и ОН – , чтобы их поверхность оставалась электронейтральной в ходе поглощения ионов питательных веществ. Таким образом, корни могут быть источниками кислот и оснований;
— педогенные минералы являются кислыми, выделяя Н + в ходе их растворения почвенной водой;
— уничтожение естественной растительности вызывает ускоренное разложение органического вещества, вымывание нитратов и развитие кислотности;
— в процессе нитрификации аммонийных удобрений образуются ионы Н + .
Различают актуальную (активную, реальную) и потенциальную (пассивную, резервную).
А к т у а л ь н а я к и с л о т н о с т ь обусловлена наличием свободных ионов водорода в почвенном растворе. Она определяется в водной вытяжке (при соотношении почва: вода 1 : 5 или 1: 2,5). Актуальную кислотность определяют как для кислых, так и для щелочных почв. Обозначают символом рН (Н2О).
П о т е н ц и а л ь н а я к и с л о т н о с т ь обусловлена ионами водорода и алюминия, находящимися в обменно-поглощенном состоянии в ППК. По способу определения ее подразделяют на обменную и гидролитическую.
О б м е н н а я к и с л о т н о с т ь — это та часть потенциальной кислотности, которая определяется при взаимодействии с почвой 1 н. раствора гидролитически нейтральной соли KCI (рН 5,6). При этом взаимодействии ионы Н + и Al 3+ в ППК замещаются ионом К + :

Обменная кислотность характеризуется величиной pH (KCI) и обычно ниже значения рН (Н2О). Значения обменной кислотности могут быть использованы при определении необходимости в известковании почвы, но для этих целей чаще используют другой показатель – гидролитическую кислотность почвы.
По значениям обменной кислотности производят оценку кислотности почв (табл. 1).
Группировка почв по степени кислотности
| Класс | Степень кислотности | Величина рН (КCl) |
| I | Очень сильнокислые | менее 4,0 |
| II | Сильнокислые | 4,1 – 4,5 |
| III | Среднекислые | 4,6 – 5,0 |
| IV | Слабокислые | 5,1 – 5,5 |
| V | Близкие к нейтральной | 5,6 –6,0 |
| VI | Нейтральные | более 6,0 |
Г и д р о л и т и ч е с к а я к и с л о т н о с т ь (Нг) – дает более полное представление о потенциальной кислотности почв, т. к. замещение Н+ и Al3+ в ППК производится при воздействии на почву 1 н. раствором гидролитически щелочной соли ацетата натрия CH3COONa с рН 8,2. Выражается в ммоль/100 г почвы.

Кроме расчета доз извести, гидролитическую кислотность используют также при вычислении показателя, получившего название степени насыщенности почвы основаниями.
Оценку потенциальной кислотности почв производят по величине гидролитической кислотности (табл. 2)
Степень кислотности почвы по величине Нг
| Класс | Степень кислотности | Величина Нг, ммоль/100 г почвы |
| I | Очень сильнокислые | более 6,0 |
| II | Сильнокислые | 5,1 – 6,0 |
| III | Среднекислые | 4,1 – 5,0 |
| IV | Слабокислые | 3,1 – 4,0 |
| V | Близкие к нейтральной | 2,1 – 3,0 |
| VI | Нейтральные | менее 2,0 |
Устранение вредной кислотности почв осуществляется известкованием – внесением в почву извести Са(ОН)2, карбоната кальция СаСО3 и некоторых других известковых материалов.

Щелочностьпочв связана с избытком ионов ОН – . Эти ионы образуются при выветривании алюмосиликатов почвообразующей породы, но в большей степени – при наличии в почве гидролитически щелочных солей (Na2CO3, NaHCO3, Ca(HCO3)2) и ионов Na + в ППК. Подщелачивание почв возможно также вследствие выпадения щелочной пыли из атмосферы, загрязняемой предприятиями стройиндустрии. Различают актуальную и потенциальную щелочность.
А к т у а л ь н а я щ е л о ч н о с т ь определяется содержанием в почвенном растворе гидролитически щелочных солей, преимущественно карбонатов и гидрокарбонатов щелочных и щелочноземельных металлов. Актуальная щелочность может определяться значением рН водной вытяжки.
П о т е н ц и а л ь н а я щ е л о ч н о с т ь почв определяется содержанием обменного Na + , переходя в почвенный раствор, он подщелачивает его.
Оценку щелочности почв производят по значениям рН водной вытяжки (табл. 3)
Группировка почв по степени щелочности
| Класс | Степень щелочности | Величина рН (Н2О) |
| I | Слабощелочные | 7,2 – 7,5 |
| II | Щелочные | 7,6 – 8,5 |
| III | Сильнощелочные | 8,5 – 10,0 |
| IV | Резкощелочные | 10,1 – 12,0 |
Для борьбы с повышенной щелочностью почв применяют их гипсование, т.е. внесение гипса СаSO4·2H2O.
С процессами ионного обмена связано и такое свойство почв, как к и с л о т н о -о с н о в н а я б у ф е р н о с т ь , то есть сопротивляемость почвы изменению рН при действии кислоты или основания. Почва является «буферной» средой, поскольку противостоит резким изменениям рН. Буферная способность почвы зависит от емкости поглощающего комплекса, который выполняет важную функцию регулятора концентрации почвенного раствора.
Цель работы:Познакомиться и освоить методы определения различных видов кислотности почв. Уметь объяснять: из каких составляющих складывается актуальная и разные виды обменной кислотности. Иметь представление о почвенном поглощающем комплексе (ППК).
Реактивы и оборудование:дистиллированная вода, раствор хлорида калия с молярной концентрацией С(КС1) = 1.0 моль/дм3, раствор уксуснокислого натрия с молярной концентрацией C(CH3COONa) = l.0 моль/дм3, рН-метр, ротатор (мешалка), стеклянные колбы на 100 мл с широким горлом, закрывающиеся пробками (или стеклянные стаканчики на 100 мл), мерные цилиндры, буферные растворы с рН 1.68, 3.56, 4.01, 6.86, 9.18.
Раствор КС1, 1М.В мерную колбу на 1 литр поместите 74.5 г КС1, добавьте дистиллированную воду, растворите и доведите до метки дистиллированной водой.
Раствор CH3COONa, 1М. В мерную колбу на 1 литр поместите 82 г CH3COONa, добавьте дистиллированную воду, растворите и доведите до метки дистиллированной водой.
Буферные растворы с рН 1.68,3.56,4.01,6.86,9.18. Готовят из фиксаналов в ампулах, согласно инструкции.
Принцип метода:
Измерение рН почвы производится потенциометрически в надосадочной жидкости суспензии, приготовленной при соотношении почва: вода равном 1:2,5. Жидкостью служит либо вода — рН (Н2О), либо раствор соли — рН(КС1) и pH(CH3COONa).
1. Перед измерениями откалибруйте рН-метр по буферным растворам для нужного вам диапазона рН. Из-за разницы в наклоне калибровочной линии измерения за пределами калибровочного диапазона могут быть ошибочными.
2. Буферные растворы не следует хранить слишком долго. Растворы с рН 9 и 10 особенно чувствительны в CO2 и довольно быстро могут стать ненадежными.
Ход работы:
1. Определение актуальной кислотности— рН водной вытяжки [рН (Н2О)]
• Возьмите навеску 10 г мелкозема воздушно-сухой почвы в чистую, сухую 100 миллилитровую колбу с широким горлом (или в стаканчик). Добавьте 25 мл дистиллированной воды, закройте колбу пробкой.
• Встряхивайте на мешалке в течение двух часов.
• Перед тем, как открыть колбу для производства измерений, встряхните ее раз или два руками.
• Поместите электрод в верхнюю часть суспензии.
• Когда показания прибора стабилизируются, считайте значение рН (точность 0.01 единицы рН).
Примечание: показания прибора считаются установившимися, когда в течение 30 секунд они меняются не более, чем на 0.1 единицу рН (или 0.02 единицы за 5 секунд). В карбонатных почвах достичь стабилизации показаний может быть трудно из-за неравновесных условий.
2. Определение обменной кислотности — рН солевой вытяжки [рН (КС1)]
Ход работы аналогичен определению актуальной кислотности, только вместо дистиллированной воды к навеске почвы необходимо прибавить 25 мл раствора хлорида калия.
3. Определение гидролитической кислотности — рН солевой вытяжки [pH(CH3COONa)]
Ход работы аналогичен определению актуальной кислотности, только вместо дистиллированной воды к навеске почвы необходимо прибавить 25 мл раствора уксуснокислого натрия.
Величину гидролитической кислотности почвы находят по полученным значениям рН в нижеприведенной таблице 4.
Источник