Наиболее значимые ферментативные показатели
Наиболее хорошо изученными ферментами в почве являются гидролазы, которые представляют обширный класс ферментов, осуществляющих реакции гидролиза разнообразных сложных органических соединений, действуя на различные связи: сложноэфирные, глюкозидные, амидные, пептидные и др. Гидролазы широко распространены в почвах и играют важную роль в обогащении их подвижными и достаточными для растений и микроорганизмов питательными веществами, разрушая высокомолекулярные органические соединения. К этому классу относятся ферменты уреаза (амидаза), инвертаза (карбогидраза), фосфатаза (фосфогидролаза) и др., активность которых является важнейшим показателем состояния почв.
Уреаза — фермент, участвующий в регуляции азотного обмена в почве. Этот фермент катализирует гидролиз мочевины до аммиака и углекислого газа, вызывая гидролитическое расщепление связи между азотом и углеродом в молекулах органических веществ. Из ферментов азотного обмена уреаза изучена лучше других. Она обнаруживается во всех почвах. Ее активность коррелирует с активностью всех основных ферментов азотного метаболизма. В почве уреаза находится в двух основных формах: внутриклеточной и внеклеточной. Наличие в почве свободной уреазы позволило выделить фермент в кристаллическом виде. Часть внеклеточной уреазы адсорбирована почвенными коллоидами, имеющими высокое сродство к уреазе. Связь с почвенными коллоидами предохраняет фермент от разложения микроорганизмами и способствует его аккумуляции в почве. Каждая почва имеет свой стабильный уровень уреазной активности, определяемый способностью почвенных коллоидов, главным образом органических, проявлять защитные свойства. В почвенном профиле наиболее высокую активность фермента проявляет гумусовый горизонт, дальнейшее распределение по профилю зависит от генетических особенностей почвы. В связи с широким применением мочевины в качестве азотного удобрения, вопросы, связанные с ее превращениями под действием уреазы, являются практически значимыми. Высокая уреазная активность большинства почв препятствует использованию мочевины в качестве универсального источника азотного питания, так как высокая скорость гидролиза мочевины почвенной уреазой приводит к локальной аккумуляции ионов аммония, повышению реакции среды до щелочных значений, и как следствие этого, потерям азота из почвы в виде аммиака. Расщепляя мочевину, уреаза предотвращает изомеризацию её в фототоксичный цианат аммония. Хотя сама мочевина частично используется растениями, однако в результате активного действия уреазы она не может долго сохраняться в почве. В исследованиях ряда ученых отмечено улетучивание из почвы азота мочевины в форме аммиака при высокой активности уреазы, а при внесении в почву различных ингибиторов уреазы замедлялся гидролиз мочевины и потери были меньше. На скорость гидролиза мочевины в почве влияют температура, кислотность почвы. Отрицательное воздействие оказывает насыщенность почвы карбонатами, присутствие в значительных количествах солей мышьяка, цинка, ртути, сульфат-ионов, соединений меди и бора, из органических соединений существенно ингибируют уреазу алифатические амины, дегидрофенолы и хиноны.
Активность инвертазы — один из наиболее устойчивых показателей, обнаруживающий наиболее четкие коррелятивные связи с воздействующими факторами. Исследованиями А.Ш. Галстяна (1966, 1974) установлена корреляция инвертазы с активностью других почвенных карбогидраз. Инвертазная активность в почве убывает по профилю, коррелирует с содержанием гумуса. Корреляция с гумусом может отсутствовать при значительном содержании в почве алюминия, железа, натрия. Тесная связь активности инвертазы с количеством почвенных микроорганизмов и их метаболической активностью свидетельствуют о преимуществе в почве инвертазы микробного происхождения. Однако такая зависимость не всегда подтверждается, активность инвертазы значительно более устойчивый показатель и непосредственно может быть не связана с колебаниями численности микроорганизмов. По сообщению А.Ш.Галстяна (1974) почвы с тяжелым гранулометрическим составом обладают более высокой ферментативной активностью. Однако имеются сообщения, что инвертаза заметно инактивируется при адсорбции глинистыми минералами и почвы с высоким содержанием монтмориллонита обладают низкой инвертазной активностью. Зависимость инвертазной активности от влажности и температуры почвы исследована недостаточно, хотя многие авторы объясняют сезонные изменения активности гидротермическими условиями. Влияние температуры на потенциальную активность инвертазы подробно исследовал А.Ш. Галстян (1975), установив оптимум при температуре около 60°, порог инактивации фермента после прогревания почв при 70° и полную инактивацию после трехчасового прогревания при 180°С. Многими авторами рассмотрена инвертазная активность почв в зависимости от произрастающих растений. Развитие лугового процесса, образование мощной дернины под травянистым покровом способствует увеличению инвертазной активности. Однако имеются такие работы, в которых влияние растений на активность инвертазы не установлено.
В почвах в большом количестве имеется фосфор в форме органических соединений, поступающий с отмирающими остатками растений, животных и микроорганизмов. Высвобождение фосфорной кислоты из этих соединений осуществляется сравнительно узкой группой микроорганизмов, имеющих специфические ферменты фосфатазы. Среди ферментов фосфорного обмена наиболее полно исследована активность ортофосфорных монофосфоэстераз. Продуцентами фосфатаз преимущественно являются клетки почвенных микроорганизмов. Фосфатазная активность почвы определяется ее генетическими особенностями, физико-химическими свойствами и уровнем культуры земледелия. Среди физико-химических свойств почвы для фосфатазной активности особенно важна кислотность. Дерново-подзолистые и серые лесные почвы, имеющие кислую реакцию, преимущественно содержат кислые фосфатазы, в почвах со слабо щелочной реакцией преобладают щелочные фосфатазы. Следует отметить, что оптимум активности кислых фосфатаз находится в слабокислой зоне, даже тогда, когда почвы имеют сильнокислую реакцию. Этот факт подтверждает важность известкования кислых почв для ускорения гидролиза сложных органических фосфатов и обогащения почвы доступным фосфором. Наблюдаемое характерное распределение фосфатаз в почвах в зависимости от их кислотности обусловлено составом микрофлоры. В почве функционируют приспособленные к определенным условиям среды микробные сообщества, которые выделяют ферменты, активные в данных условиях. Суммарная фосфатазная активность почвы зависит от содержания гумуса и органического фосфора, который является субстратом для фермента. Наиболее высокой фосфатазной активностью характеризуются черноземы. В дерново-подзолистых и серых лесных почвах активность фосфатазы невелика. Низкая активность этих кислых почв обусловлена более сильной адсорбцией фосфатаз почвенными минералами. Вследствие малого содержания органического вещества в таких почвах адсорбирующая поверхность минералов больше обнажена по сравнению с высокогумусными черноземами, где глинистые минералы покрыты гумифицированным органическим веществом. Активность фосфатазы динамична в течение вегетационного периода. В активные фазы роста растений при высокой температуре почвы и достаточной влажности в летние месяцы фосфатазная активность почв максимальна. В некоторых почвах отмечена корреляция фосфатазной активности с общей численностью микроорганизмов и количеством микроорганизмов, минерализующих органические соединения фосфора, в других — связь активности фосфатазы с числом микроорганизмов не установлена. Влияние гумуса проявляется в характере изменения активности фермента по профилю, при сопоставлении почв разной степени гумусированности и проведении мероприятий по окультуриванию почвы. Исследования многих авторов свидетельствуют о прямой зависимости фосфатазной активности почв от содержания в почве органического фосфора. Рассмотрим несколько подробнее общие закономерности формирования фосфатазного пула почв. Значительную часть общего фосфора в почве составляют фосфорорганические соединения: нуклеиновые кислоты, нуклеотиды, фитин, лецитин и др. Большинство из встречающихся в почве органофосфатов непосредственно растениями не усваивается. Их поглощению предшествует ферментативный гидролиз, осуществляемый фосфогидролазами. Субстратами почвенных фосфатаз являются специфические гумусовые вещества, включающие фосфор гумусовых кислот, а также не специфические индивидуальные соединения, представленные нуклеиновыми кислотами, фосфолипидами и фосфопротеинами, а также метаболическими фосфатами. Первые накапливаются в почве в результате биогенеза гумусовых веществ, вторые, как правило, поступают в почву с растительными остатками и накапливаются в ней, как продукты промежуточных метаболических реакций. Роль высших растений в формировании фосфатазного пула почв, используемых в сельском хозяйстве, ниже, чем микроорганизмов и связана в основном с поступлением в почву пожнивных остатков и корневых выделений, что подтверждается данными С.Н. Ивлеевой и Т.А. Щербаковой (1994), которые исследовали в вегетационном опыте влияние различных сельскохозяйственных культур на активность гидролитических и окислительно-восстановительных ферментов: фосфатазы, инвертазы, протеазы, уреазы, каталазы на маломощной торфяной почве. Активность фосфатазы оказалась примерно одинаковой под всеми культурами: ячменем, картофелем и черным паром и лишь немного больше под многолетними травами, тогда как активность других ферментов значительно различалась в зависимости от характера использования почв. Самцевич С. А., Борисова В.Н. (1972) отмечают увеличение активности фосфатазы в ризосфере пшеницы и бобовых, что может быть связано как с увеличением численности микроорганизмов в ризосфере, так и с внеклеточной фосфатазной активностью корней. С агрохимической точки зрения важен конечный результат — рост ферментативного пула почв с увеличением мощности корневых систем растений. Обедненность агроценозов растениями приводит к снижению ризосферного эффекта и, как следствие, к уменьшению активности фосфатазы почвы. Отмечено значительное снижение фосфатазной активности почв при возделывании монокультуры. Включение почв в севооборот создает условия для улучшения гидролитических процессов, что приводит к увеличению метаболизма фосфорных соединений. Н.В. Раськова (1994) исследовала дерново-подзолистые почвы, сформированные под естественной (лесной) растительностью разного состава и определяла распределение фосфатазной активности в профиле почвы, соотношение между лабильными и стабильными формами ферментов, пространственную и временную их вариабельность. Установлено, что в почвах, сформированных под естественной лесной растительностью, генетические горизонты различаются по активности фосфатазы, распределение которой в профиле тесно коррелирует с содержанием гумуса. По данным Н.В. Раськовой, наибольшая фосфатазная активность наблюдалась в подстилочном слое, затем в 4 — 18 раз уменьшалась в гумусово-аккумулятивном и резко падала в почвенном слое ниже 20 см в почве под ельником (лесная растительность). Под луговой растительностью несколько иное распределение: максимальная активность в дерновом горизонте, в 1,5-2 раза ниже в гумусово-аккумулятивном, а дальнейшее значительное снижение наблюдается только после 40 — 60 см. На основании вышеизложенного можно сделать вывод, что максимальный вклад в формирование фосфатазного пула под естественной растительностью вносят микроорганизмы и растительные остатки в качестве субстрата, корневые выделения и постморально поступающие внутриклеточные ферменты играют несколько меньшую роль.
Интенсивность биохимических процессов в почве и уровень её плодородия зависит как от условий существования живых организмов, которые поставляют ферменты в почву, так и от факторов, способствующих закреплению ферментов в почве и регулирующих их актуальную активность.[23]
Источник
Способ определения уреазной активности почвы
О П НИ Е 445749
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
Республик (61) Зависимое от авт. свидетельства (22) Заявлено 17.08.71 (21) 1692589 22-3 с присоединением заявки № (51) И. Кл. Е 21с 4960
Государственный комитет (32) Пр нор итет
Совета Министров СССР по делам изобретений и открытий
Опубликовано 05.10.74. Бюллетень № 37
Дата опубликования описания 06.03.75 (53) УДК 631.42:631. .445.1 (088.8) (72) Авторы изобретения
С. В. Рунксв, Г. Д. Никитина и Н. А. Козловская
Геологоразведочный торфяной трест «Геолторфразведка» (71) Заявитель (54) СПОСОБ ОПРЕДЕЛЕНИЯ УРЕАЗНОЙ АКТИВНОСТИ
ПОЧВЫ, НАПРИМЕР ТОРФЯНОЙ
Изобретение относится к изучению степени естественного плодородия почв, в частности, из уреазной активности, т. е. способности к разложению ими мочевины с образованием углекислоты и аммиака.
Известны способы определения уреазной а»тивности почвы, включающие колориметрирование с реактивом Несслера, аммиака, образующегося в результате гидролиза и ингибирования путем нагревания.
Недостатком известных способов определения уреазной активности почв является использование в качестве контрольных образцов предварительно автоклавированных, при температуре 100 — 120 С, проб почвы, что приводит к дополнительному образованию аммиака в контроле за счет гидролиза азотсодержащих соединений почв, в результате чего увеличивается время проведения анализа.
С целью данного уменьшения времени проведения анализа ингибирование контрольного до инкубации и опытного после инкубации образцов почвы производят 10%-ным раствором медного купороса при 15 — 25 С.
Это исключает дополнительное образование аммиачного азота, имевшее место при термическом гидролизе азотсодержащих соединений, которым может сопровождаться автоклавирование проб почвы.
Г1редлагаемый способ позволяет не только повысить надежность и — î÷íîñòü результатов анализа, но и существенно сократить его общую продолжительность.
Способ заключаетс51 в следующем.
Навеску почвы, почвенную вытяжку или гемогенат (100 — 200 мг) помещают на дно дшрфузпонного сосуда, добаиля1от буферный раствор (рН 7 — 7,5) и после тщательного перемс шивания приливают 10 iq-ный раствор мочевины в 2,5 — 5-кратном количестве против на вески почвы п толуол в количестве 10 — 20% от объема раствора мочевпны.
B контрольную пробу, помимо указанных
15 реагентов, после добавлснпя буферного раствора приливают раствор пнгпбптора — 10 «/Оный раствор CuS0 канне аммиа шого азота определяют по калибровочному графику. Пересчет уреазной активности почвы проводят на 1 г сухой почвы или ее органической массы.
Способ был широко испытан и по сравнению с другими известными способами определения уреазпой активности почв показал более правильные и точные результаты.
Способ определения уреазной активности почвы, например торфяной, включающий колориметрирование с реактивом Несслера, ам1р миака, образующегося в результате гидролиза и ингибирования путем нагревания, о тл и ч аю шийся тем, что, с целью уменьшения времени проведения анализа, ингибирование ко трольного до инкубации и опытного после ипку15 бации образцов почвы производят 10,/о-ным раствором медного купороса при 15 — 25 C..
Источник
БИОДИАГНОСТИКА ПОЧВ ПО ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
Цель работы ‑ определение биологической активности почв на разном удалении от дороги по четырем ферментным системам: дегидрогеназам, каталазе, инвертазе, уреазе.
Почвенно-энзимологические методы позволяют определять не количественное содержание ферментов в почве, а активность ферментов, находящихся преимущественно в адсорбированном (иммобилизованном) состоянии на поверхности почвенных коллоидов и частично в почвенном растворе.
Принципметода определения активности почвенных ферментов основан на учете количества переработанного в процессе реакции субстрата или образующегося продукта реакции в оптимальных условиях температуры, рН среды и концентрации субстратов.
Ферменты, относящиеся к классу оксидоредуктаз, катализируют окислительно-восстановительные реакции, играющие ведущую роль в биохимических процессах в клетках живых организмов, а также в почве. Наиболее распространены в почвах такие оксидо-редуктазы, как каталаза и дегидрогеназы, активность которых является важным показателем генезиса почв.
Каталазаразлагает на воду и молекулярный кислород ядовитую для клетки перекись водорода, образующуюся в процессе дыхания живых организмов в результате различных биохимических реакций окисления органических веществ.
Активность каталазы определяется газометрическим методом по объему выделившегося кислорода, основанным на измерении скорости разложения перекиси водорода при ее взаимодействии с почвой.
Дегидрогеназы ‑ ферменты, которые участвуют в процессе дыхания, отщепляя водород от окисляемых субстратов. Одни дегидрогеназы переносят водород непосредственно на молекулярный кислород, другие — на какие-либо акцепторы, например на хиноны, метиленовую синь.
Для определения активности дегидрогеназы в качестве акцептора водорода применяют бесцветные соли тетразолия (2,3,5-трифенилтетразолий хлористый (ТТХ), которые восстанавливаются в красные соединения формазана (трифенилформазан (ТФФ).
Гидролазы осуществляют реакции гидролиза разнообразных сложных органических соединений, действуя на различные связи: сложноэфирные, глюкозидные амидные, пептидные и др. К этому классу относятся ферменты инвертаза, уреаза и др., активность которых является важным показателем биологической активности почв и широко используется для оценки антропогенного воздействия.
Инвертаза действует на p-фруктофуранозидную связь в сахарозе, рафинозе, стахиоэе и производит расщепление сахарозы на эквимолярные количества глюкозы и фруктозы.
Фотоколориметрическое определение активности инвертазы основано на учете восстанавливающих сахаров, образующихся при расщеплении сахарозы.
Разложение органических азотистых соединений осуществляется при непосредственном участии внеклеточных ферментов. Образующийся при уреазной активности аммиак служит источником питания растений.
Уреаза катализирует гидролиз мочевины. Конечными продуктами гидролиза являются аммиак и углекислый газ. Мочевина попадает в почву в составе растительных остатков, навоза и как азотное удобрение; она образуется также в самой почве в качестве промежуточного продукта в процессе превращения азотистых органических соединений — белков и нуклеиновых кислот.
Определение каталазной активности
Оборудование и реактивы:
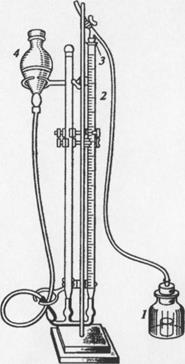
Cистема для газометрии (рис. 8); 10%-й раствор Н2O2; СаСОэ.
Рис. 8 ‑ Установка для газометрического определения каталазной активности в почвенных образцах:
1 — колба, 2 — бюретка, 3 — переходник, 4 — груша с водой
Порядок выполнения работы
1. Навеску просеянной почвы 1 г внести в колбу на 100 см 3 , добавить 0,5 г СаСО3.
2. На дно осторожно поставить с помощью пинцета маленький стаканчик с 1,7 см 3 10%-го раствора перекиси водорода.
3. Навеску почвы смочить 4 см 3 дистиллированной воды.
4. Колбу плотно закрыть каучуковой пробкой с трубкой, соединенной с бюреткой толстостенным каучуком через тройник, снабженный зажимом. Бюретка сообщается с грушей. Бюретка и груша заполнены водой. Уровень воды в них уравновешивают и грушу закрепляют на определенной высоте.
5. Начало опыта отметить по секундомеру в момент, когда сосудик с перекисью водорода опрокинут, и вслед за этим встряхнуть содержимое колбы. Взбалтывание смеси следует продолжать во все время опыта, не касаясь непосредственно дна колбы руками. Выделяющийся кислород вытесняет из бюретки воду, уровень которой отмечают.
6. Количество выделившегося молекулярного кислорода учитывают в течение 1 мин при температуре 18-20 0 С.
7. Активность каталазы выражают в объеме (см 3 ) кислорода, выделившегося на 1 г почвы в минуту. Ошибка определения до 5%.
8. Аналогичные процедуры проделать со всеми образцами почв.
9. По табл. 15 оценить степень насыщения исследуемых почв каталазой.
Таблица15 ‑Шкала для оценки степени обогащенности почв ферментами
| Степень обогашенности почв | Каталаза, О2 см 3 /г за 1 мин | Дегидрогеназы, мг ТФФ на 10 г за 24 ч | Инвертаза, мг глюкозы на 1 г за 24 ч | Уреаза, мг NH4, на 10 г за 24 ч | Фосфотаза, мг Р2О3 на 10 г за 1 ч |
| Очень бедная | 30 | >30 | > 150 | > 100 | > 15 |
Определение дегидрогиназной активности
Приборы, посуда, реактивы:
Фотоколориметр; миллиметровая бумага; 0,1М раствор глюкозы; 1 %-й раствор 2,3,5-трифенилтетразолия хлористого (ТТХ); СаСО3; этиловый спирт; трифенилформазан (ТФФ).
Порядок выполнения работы
1. Навески воздушно-сухой почвы по 1 г из каждого образца поместить в пробирки, добавить по 10 мг (на кончике шпателя) СаСО3, по 1 см 3 0,1 М раствора глюкозы и по 1 см 3 1%-го раствора ТТХ; содержимое каждой пробирки тщательно смешать.
2. Пробирки поместить в анаэростат и откачать воздух насосом при разрежении 10-12 мм рт. ст. в течение 2-3 мин. Затем инкубировать при 30 0 С в течение 24 ч.
3. По истечении времени инкубации содержимое пробирок экстрагировать в 3-4 приема 25 см 3 этилового спирта. Для этого небольшой объем спирта внести в пробирку и встряхивать в течение 5 мин до появления красной окраски. Дать отстояться и надпочвенную жидкость профильтровать через бумажный фильтр. Добавить в пробирку следующую порцию спирта.
4. Полученный окрашенный раствор формазана колориметрировать на ФЭКе с синим светофильтром (500-600 нм).
5. Количество формазана в миллиграммах рассчитать по стандартной кривой. Для этого приготовить стандартный раствор формазана в этиловом спирте в концентрации 0,1 мг в 1 см 3 . Рабочие растворы для составления кривой приготовить путем разведений стандартного раствора (примерно 5 точек). Стандартную кривую построить на миллиметровой бумаге в системе: оптическая плотность при длине волны 500-600 нм — концентрация формазана в спирте.
6. Вычислить активность дегидрогеназы. По табл. 15 оценить степень насыщения исследуемых почв дегидрогеназой.
Активность дегидрогеназы (X) выражают в миллиграммах ТФФ на 10 г почвы за сутки по формуле:

где V ‑ общий объем фильтрата, 25 см 3 ;
10 ‑ пересчетный коэффициент веса почвы, г;
v ‑ произведение объемов субстрата и реагента, 1 см 3 ;
А ‑ количество ТФФ, полученное по калибровочной кривой, мг/см 3 . Ошибка определения ‑ до 8 %.
Определение инвертазной активности
Приборы, посуда, реактивы:
Фотоколориметр; 5%-й раствор сахарозы; ацетатный буфер (рН 4,7); толуол; раствор Феллинга: а ‑ 40 г CuSO4×5Н2О растворяют в воде и доводят до 1 дм 3 , фильтруют через бумажный фильтр, б ‑ 200 г сегнетовой соли (С4H4O6KNa×4Н2О) растворяют в дистиллированной воде, прибавляют 150 г КОН и доводят до 1 дм 3
Порядок выполнения работы
1. В колбы вместимостью 50 см 3 поместить по 5 г каждого образца почвы, добавить по 10 см 3 5%-го раствора сахарозы, 10 мл ацетатного буфера (рН 4,7) и 5-6 капель толуола.
2. Колбы закрыть пробками, встряхнуть, поместить в термостат при температуре 30 0 С на 24 ч и периодически встряхивать их.
3. После инкубации содержимое колб отфильтровать в мерные колбы на 25 см 3 . Довести до метки.
4. Из фильтратов взять по 6 см 3 в большие пробирки, добавить по 3 см 3 раствора сегнетовой соли и 3 см 3 раствора сернокислой меди, хорошо перемешать и кипятить на водяной бане 10 мин. Получается красный осадок.
5. Пробирки с раствором охладить в воде, содержимое отфильтровать в большие пробирки. Прозрачный фильтрат колориметрировать на ФЭК, используя светофильтр с длиной волны 630 нм, ширина кюветы 1 см.
6. Для получения калибровочной кривой приготовить стандартный раствор: 6 мг глюкозы в 1 см 3 . Разведением приготовить серию растворов. Фотоколориметрировать и построить кривую: оптическая плотность ‑ концентрация глюкозы в 1 см 3 .
7. Вычислить активность и по табл. 15 оценить степень насыщения исследуемых почв инвертазой.
Активность инвертазы (X) выражают в миллиграммах глюкозы на 1 г почвы за 24 ч по формуле:
X = 
где А ‑ количество глюкозы, полученное по калибровочной кривой из оптической плотности, мг/см 3 ;
m ‑ навеска почвы, 5 г;
V ‑ общий объем фильтрата, 25 см 3 ;
v ‑ объем фильтрата, взятого для анализа, 6 см 3 .
Ошибка определения ‑ до 5 %.
Определение уреазной активности почв
Приборы, посуда, реактивы:
Фотоколориметр; 2%-й раствор мочевины в фосфатном буфере (рН = 6,7); 50%-й раствор сегнетовой соли; 50%-й раствор CCl3COOH (трихлоруксусная кислота); 1%-й раствор КС1; реактив Несслера; стандартный раствор NH4C1.
Порядок выполнения работы
1. По 5 г воздушно-сухой почвы поместить в колбы емкостью 100 см 3 , прилить по 20 см 3 2%-го раствора мочевины в фосфатном буфере (рН 6,7) и по 200 мкл толуола.
2. Колбы плотно закрыть и поместить в термостат при температуре 37 0 С на 4 ч.
3. После экспозиции прилить по 1 см 3 50%-го раствора трихлоруксусной кислоты.
4. Для вытеснения из почвы поглощенного аммиака добавить по 50 см 3 1 н. раствора хлористого калия.
5. Содержимое колб отфильтровать.
6. По 2 см 3 фильтрата поместить в мерные колбы объемом 50 см 3 , развести водой до 30 см 3 , затем прилить по 2 см 3 50%-го раствора сегнетовой соли и по 2 см 3 реактива Несслера. Колбы долить водой до метки, перемешать и окрашенный раствор колориметрировать при длине волны 400 нм.
7. Содержание аммиака в фильтрате рассчитать по стандартной кривой. Для этого приготовить стандартный раствор NH4C1 в концентрации 0,005 мг N-NH4 в 1 см 3 . Сделать серию разведений. Построить калибровочную кривую.
8. Вычисляют активность уреазы.
9. По табл. 15 оценить степень насыщения исследуемых почв уреазой.
Активность уреазы (X) выражают в миллиграммах N-NH4 на 1 г почвы за 4 ч по формуле:
X = 
где А ‑ содержание аммиака в фильтрате, полученное по калибровочной кривой, мг/см 3 ;
V ‑ общий объем фильтрата, 50 см 3 ;
m — навеска почвы, 5 г.
Вопросы для самоподготовки:
1. Что такое каталазная активность?
2. Дайте оределение инвертазной активности.
3. Охарактеризуйте уреазную активность.
4. Что такое буферная смесь?
5. Принцип и сущность метода определения активности почвенных ферментов.
6. Методика отбора образцов почвы.
Таблица 1 ‑ Примерный список организмов — индикаторов сапробности
| Организмы | Сапробность |
| Нитчатые бактерии: | |
| Sphaerotilus natans | р |
| Beggiatoa sp. | р |
| Thiothrix sp. | р |
| Грибы: | |
| Leptomitus lacteus | α |
| Mucor racemosus | α |
| Fusarium aquaeductum | р |
| Водоросли: | |
| сине-зеленые: | |
| Anabaena flos aquae | β |
| Microcystis aeruginosa | β |
| Aphanizomenon flos aquae | β |
| Oscillatorla tenuis | α |
| Диатомовые | — |
| Cymbella cesati | о |
| Oomphonema cevli | о |
| Melostra granulata | β |
| Navicula angustata | α |
| Navicula apiculata | α |
| Synedra acus | β |
| Synedra ulna | β |
| Nitzschia palea | α |
| эвгленовые: | |
| Euglena acus | β |
| Euglena viridis | р |
| Euglena deses | α |
| зеленые и протококковые: | |
| Volvox globator | о-β |
| Ankistrodesmus falcatus | β-α |
| Crucigenta rectangularis | а-β |
| Scenedesmus quadricauda | β |
| Draparnaldia sp. | о |
| Ulothrix zonata | о |
| Stlgeoclonium tenue | α |
| Животные: | |
| амебы: | |
| Pelornyxa palustris | р |
| Организмы | Сапробность |
| инфузории: | |
| Colpidium, campylum | p |
| Colpldlum colpoda | p |
| Euplotes charon | β |
| Chllodon cucullulus | p |
| Opercularia coaretata | α |
| Paramecium caudatum | α |
| Spirostomum amblguum | α |
| Stentor coeruleus | α |
| Vortlcella convallarla | α |
| Vorticella microstoma | p |
| Podophrya fixa | α |
| коловратки: | |
| Kellcottia longispina (syn. Notholca Iongispina) | о |
| Keratella cochlearls | β |
| Keratella quadrata | β |
| Leucane lunarls (syn. Monostyla lunarls) | β |
| Rotaria rotatoria (syn. Rotifer vulgaris) | α |
| олигохеты: | |
| Limnodrilus hofmelsterl | p |
| Tub if ex tublfex | p |
| Stylarla lacustris | β |
| ракообразные: | |
| Daplmla magna | α |
| Daphnla pulex | α |
| Leptodora Kindtli | о |
| Eudiaptomus gracilis | o |
| Astacus fluviatilis | o |
| насекомые: | |
| Caenls macrura | o |
| Heptagenia coerulana | β |
| Chironomus Plumosus | р |
| рыбы: | |
| лещ: | β |
| усач | β |
| форель | o |
| линь | β-α |
Таблица 2 ‑ Шкала частот для пересчета организмов в 100 полях на частоту
| Значение частоты | Микробентос | Обрастания |
| Данные подсчета | Сумма в 100 полях | |
| 1-я категория крупности | ||
| Не более 1 в каждом 2-м поле зрения Не более 2 в поле зрения Не более 10 в поле зрения Не более 30 в поле зрения Не более 60 в поле зрения Более 60 в поле зрения | Не более 1 в каждом 2-м поле зрения Не более 2 в поле зрения Не более 10 в поле зрения Не более 50 в поле зрения Не более 250 в поле зрения Более 250 в поле зрения | 1-50 50-200 200-1000 1000-5000 5000-25000 Более 25000 |
| 2-я категория крупности | ||
| Не более 1 в каждом 20-м поле зрения Не более 1 в каждом 5-м поле зрения Не более 1 в поле зрения Не более 3 в поле зрения Не более 6 в поле зрения Более 6 в поле зрения | Не более 2 в 20 полях зрения Не более 1 в 5 поле зрения Не более 1 в поле зрения Не более 5 в поле зрения Не более 25 в поле зрения Более 25 в поле зрения | 1-5 6-20 21-100 100-500 500-2500 Более 2500 |
| 3-я категория крупности | ||
| 1 в 100 полях зрения 1 в 50 полях зрения Не более 1 в 10 полях зрения Не более 1 в 4 полях зрения Не более 1 в 2 полях зрения Приблизительно 1 в поле зрения | 1 в 100 полях зрения 1 в 50 полях зрения Не более 1 в 10 в полях зрения 1в2 полях зрения Не более 2 в поле зрения Более 2 в поле зрения | 3-10 10-50 50-200 Более 200 |
Таблица 13. Пересчет результатов количественного учета на значение частоты
| Значение частоты, h | Зоопланктон | Макробентос | |||
| Доля одного вида в общем количестве экземпляров: | Количество экземпляров на площади 0,1 м 2 грунта водоема | ||||
| не более 1 | 1-5 | ||||
| 4-10 | |||||
| 4-10 | 11-50 | ||||
| 10-20 | 50-150 | ||||
| 20-40 | 150-500 | ||||
| 40-100 | Свыше 500 | ||||
| Зона | Условное обозначение | Численное значение | Зона | Условное обозначение | Численное значение |
| Олиго-сапробная | o | Альфа -мезосапробная | α | ||
| Бета-мезосапробная | β | Полисапробная | p |
Пример вычисления сапробности
Проба: река ниже города. Дата ________________ Сообщество: обрастания.
| Организмы | s | h | sft |
| Euglena viridis | p | ||
| Scenedesmus acuminatus | β | ||
| Spirogyra sygmoidea | β | ||
| Closterium acerosum | α | ||
| Closterium moniliierum | β | ||
| Cyclotella menengiana | α | ||
| Cymbella vesiculosa | β | ||
| Diatoma vulgare | β | ||
| Melosira italica | β | ||
| Melosira varians | β | ||
| Navicula cryptocephala | α | ||
| Navicula viridua | α | ||
| Nitzschia acicularis | β | ||
| Nitzschia palea | α | ||
| Surirella ovata | β | ||
| Chilidonella cuculata | α | ||
| Colpoda cuculus | α | ||
| Sh=41 | S(sh)=103 |
Интервал точности для статистической надежности 95%.
Источник