Основы технологии минеральных удобрений
Удобренияминазываются вещества, содержащие элементы, необходимые для питания растений и вносимые в почву с целью получения высоких устойчивых урожаев.
Удобрения классифицируют по ряду признаков.
По происхождению удобрения подразделяются на минеральные, органические, органоминеральные и бактериальные.
К минеральным, или искусственным, удобрениям относятся специально производимые на химических предприятиях преимущественно неорганические вещества, в основном минеральные соли.
Органические удобрения содержат питательные вещества главным образом в виде органических соединений, обычно — продуктов естественного происхождения (навоз, фекалии, солома, торф и др.).
Органоминеральные удобрения представляют собой смеси различных органических и минеральных удобрений.
Бактериальные удобрения содержат некоторые культуры микроорганизмов, способствующие накоплению в гумусовом слое (почве) усвояемых форм питательных элементов.
По составу,т.е. по видам питательных элементов, минеральные удобрения подразделяются на азотные, фосфорные (фосфатные), калийные (калиевые) и микроудобрения (магниеч вые, борные и др.).
По содержанию главных питательных элементовудобрения бывают простые (один главный питательный элемент) и комплексные (два или три элемента).
Но числу главных питательных элементов комплексные удобрения называются двойными (NP, PK, NK) и тройными (NPK).
При содержании питательных веществ более 33 % удобрения называются концентрированными, более 60 % — высококонцентрированными.
По назначению и срокам внесения удобрения подразделяются на основные (предпосевные), вносимые до посева; припо-севные, вносимые во время посева; подкормки, вносимые в период развития растений (в вегетационный период).
По степени растворимости удобрения бывают водорастворимые и водонерастворимые.
Состав минеральных удобрений характеризуется содержанием в них активных веществ: в азотных — азота (N), в фосфорных — оксида фосфора (Р2О5), в калийных — оксида калия (К20).
9.2.1. Основы технологии азотныхудобрений
Промышленностью выпускаются следующие виды азотных удобрений: аммиачные, содержащие азот в виде катиона NH 4+ , нитратные, содержащие азот в виде аниона NO 3- , аммиач-но-нитратные, содержащие оба иона, и амидные, азот в которых находится в форме NH2. По агрегатному состоянию азотные удобрения бывают твердые (например, карбамид) и жидкие (аммиак, аммиачная вода и аммиакаты, представляющие собой растворы твердых удобрений).
Наиболее распространенными из азотных удобрений являются аммиачная селитра (нитрат аммония) NH4NO3 и карбамид (мочевина) (NH2)2CO. Эти удобрения, как и все аммиачные и нитратные соли, водорастворимы и хороню усваиваются растениями, однако легко уносятся вглубь почвы при обильных дождях или орошении.
Аммиачная селитра (нитрат аммония) NH4NO3 является безбалластным удобрением, содержащим до 35 % азота в аммиачной и нитратной формах. Это удобрение можно использовать для любых сельскохозяйственных культур и почв. Однако нитрат аммония имеет и некоторые недостатки: его гранулы сильно гигроскопичны и поэтому расплываются на воздухе, слеживаются при хранении в крупные агломераты, трудно вносимые в почву. Кроме того, NH4NO3 огне- и взрывоопасен, что также осложняет его применение в качестве удобрения.
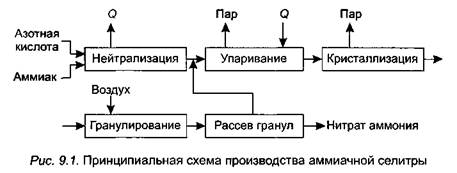
Технологический процесс производства аммиачной селитры (рис. 9.1) включает следующие стадии:
• нейтрализацию разбавленной азотной кислоты (HNO3) аммиаком (NH3);
• упаривание раствора нитрата аммония;
• кристаллизацию нитрата аммония;
• гранулирование и охлаждение плава;
• рассев гранул на товарные фракции.
Нейтрализация осуществляется в специальном реакторе — нейтрализаторе, откуда разогретый раствор NH4NO3 (реакция нейтрализации идет с выделением тепла) поступает в вакуум-выпарной аппарат, где на выходе получается плав с содержанием NH4NO3 98—99 %. Плав поступает в верхнюю часть грануляционной башни, где разбрызгивается через специальное приспособление — форсунку. Капли селитры, падая вниз, застывают в потоке подающегося снизу холодного воздуха и образуют гранулы, которые поступают на дополнительное охлаждение и затем рассеиваются на фракции. Частицы менее 1 и более 3 мм присоединяются к раствору, идущему на выпаривание. Готовый продукт (частицы размером 1—3 мм) упаковывается в водонепроницаемые мешки.
В структуре себестоимости аммиачной селитры удельный вес различных элементов затрат следующий: сырье и основные материалы — 85 %, вспомогательные материалы — 5, энергия — 5, зарплата — 0,3, прочие расходы — 4,7 %.
Карбамид (NH2)2CO относится к ценным азотным удобрениям, содержащим до 46 % азота. Его применяют также как азотную добавку в корм скоту. Высокая концентрация азота, ценные физико-химические свойства, малая слеживаемость, низкие расходы на хранение и транспортирование сделали карбамид основным азотным удобрением.


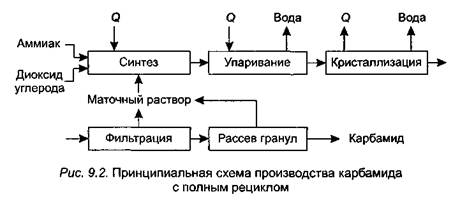
Технологический процесс производства карбамида (рис. 9.2) включает следующие стадии:
• упаривание раствора карбамида до плава;
• кристаллизация или гранулирование плава;
• фильтрация кристаллов (в случае кристаллизации);
• рассев гранул на товарные фракции.
В промышленности синтез карбамида осуществляется в две стадии при 100 % -ном избытке аммиака, давлении 18—20 МПа и температуре 180—200 °С. Выход карбамида в оптимальных условиях составляет 60—70 % при использовании чистых СО2 и NH3. В целях улучшения экономических показателей производства не вступившие во взаимодействие аммиак и СО2 ис_ пользуются повторно или для получения других продуктов.
Диоксид углерода, предварительно очищенный от соединений серы и механических примесей, сжимается компрессором до 18—20 МПа и при температуре 40 ° С непрерывно подается в колонну синтеза. Плунжерным насосом в колонну непрерывно вводится также жидкий аммиак, нагретый до 90 °С. Полученный раствор карбамида упаривается в выпарном аппарате. Затем карбамид либо кристаллизуют в кристаллизаторах и отделяют кристаллы от маточного раствора на соответствующем фильтровальном оборудовании, либо гранулируют в грануляционной башне. Рассев гранул карбамида на товарные фракции осуществляется так же, как и аммиачной селитры.
Для получения 1 т карбамида в среднем расходуется: аммиака — 0,58 т; диоксида углерода — 0,77 т; воды — 90 м 3 ; электроэнергии — 130 кВт- ч; пара — 1,3 т.
В структуре себестоимости карбамида удельный вес различных элементов затрат следующий: сырье и основные материалы — 65 % , вспомогательные материалы — 15, энергия — 15,6, зарплата — 0,4, прочие расходы — 4 %.
9.2.2. Основы технологии фосфорных удобрений
К фосфорным удобрениям относятся природные фосфаты и продукты их переработки. В отличие от других видов минеральных удобрений, фосфорные обладают разной растворимостью, по которой подразделяются на водорастворимые (группа I); растворимые в органических кислотах или усвояемые (группа II); нерастворимые или растворимые только в сильных минеральных кислотах (группа III). По содержанию питательного элемента фосфорные удобрения бывают концентрированные (более 30 % Р2О5) и неконцентрированные (менее 30 % Р2О5).
Методы переработки фосфатного сырья существенно зависят от состава руды и могут быть механическими и химическими.
Механической обработкой (измельчением) получают простейшее фосфорное удобрение — фосфоритную муку.
Задачей химической переработки природных фосфатов в фосфорные удобрения является превращение исходного фосфорсодержащего сырья в такие соединения фосфора, которые легко усваиваются растениями и являются высококонцентрированными, т.е. в их состав входит максимально возможное количество Р2О5 в усвояемой форме при минимальном содержании балласта и вредных примесей.
Важнейшими фосфорными удобрениями являются простой и двойной суперфосфаты, которые выпускаются в виде порошка или гранул.
Простой суперфосфат получают камерным методом при разложении природных фосфатов (апатитового концентрата или фосфоритной муки) серной кислотой.
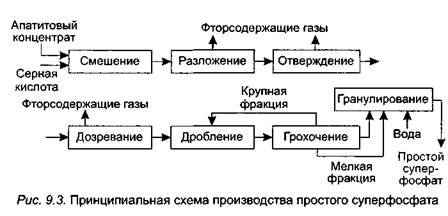
Основными стадиями производства простого суперфосфата являются (рис. 9.3):
• смешение апатитового концентрата или фосфоритной муки с серной кислотой;
• разложение сырья при химическом взаимодействии исходных компонентов с образованием суперфосфата и фосфогипса;
• отверждение получаемой суспензии в суперфосфатной камере;
• дозревание суперфосфата на складе дообработки;
• дробление простого суперфосфата;
• грохочение (отделение крупных и мелких фракций);
• гранулирование простого суперфосфата.
Существенными недостатками технологии производства простого суперфосфата являются образование побочных продуктов — фосфогипса (CaSO4) и выделение на всех стадиях производства очень токсичного газообразного фтористого водорода (HF). При этом содержание Р2О5 в простом суперфосфате не превышает 20 %.
Двойной суперфосфат является более концентрированным удобрением, чем простой. Его получают путем разложения природных фосфатов фосфорной кислотой. Производство двойного суперфосфата осуществляется двумя методами: камерным (по схеме получения простого суперфосфата) и поточным (бескамерным).
К недостаткам камерного способа относятся длительное складское дозревание продукта, сопровождающееся неорганизованными выделениями вредных фтористых соединений в атмосферу, и необходимость применения концентрированной фосфорной кислоты, содержащей 50—55 % Р2О5.
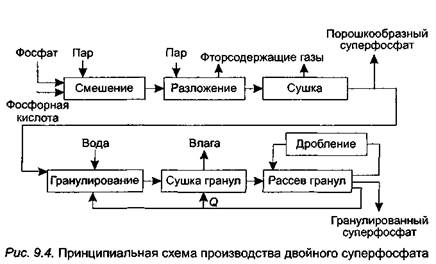
Основными стадиями производства двойного суперфосфата поточным методом являются (рис. 9.4):
• смешение апатитового концентрата или фосфоритной муки с 32 %-ной фосфорной кислотой;
• разложение фосфатного сырья (процесс протекает 0,5—1 ч при температуре 95 °С) в реакторе-смесителе с образованием пульпы готового продукта;
• сушка в распылительной сушилке и получение порошкообразного удобрения;
• гранулирование части порошкообразного суперфосфата в грануляторе-смесителе;
• сушка гранул в барабанной сушилке;
• рассев гранул на грохоте и получение товарной фракции двойного суперфосфата (размеры частиц — 1—4 мм).
После рассева гранул суперфосфата на грохоте крупная фракция (размер частиц — 4 мм и более) измельчается на молотковой дробилке и снова поступает на грохот, а мелкая, называемая ретуром (размер частиц — 1 мм и менее), возвращается вгранулятор-смеситель.
В себестоимости производства суперфосфата наибольшая доля затрат (93—96 %) приходится на стоимость сырья, при этом себестоимость гранулированного двойного суперфосфата выше, чем порошкообразного. Однако гранулирование способствует значительному улучшению качества и агрохимических свойств удобрений. Себестоимость двойного суперфосфата на 10—13 % выше, чем простого, но это увеличение компенсируется экономией труда при его транспортировке и внесении в почву.
Дата добавления: 2016-12-09 ; просмотров: 4789 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Основной технологический процесс минеральных удобрений
Минеральные удобрения (МУ) — соли и другие неорганические природные или полученные промышленным путем вещества, содержащие в своем составе элементы, необходимые для питания растений и улучшения плодородия почвы, используемые с целью получения высоких и устойчивых урожаев сельскохозяйственных культур.
В образовании тканей растений, в его росте и развитии принимают участие около 70 элементов, которые по их роли могут быть разделены на следующие группы:
- элементы-органогены (углерод, водород, кислород, азот);
- зольные элементы (фосфор, кальций, калий, магний, сера);
- микроэлементы (бор, молибден, медь, цинк, кобальт);
- элементы, входящие в состав хлорофилла и различных ферментов (железо, марганец).
Из этих элементов углерод, водород и кислород образуют около 90% массы сухого вещества растения, 8 – 9% составляют азот, фосфор, сера, магний, кальций и калий. На долю остальных элементов, в том числе таких жизненно важных, как бор, железо, медь, марганец и другие, приходится не более 1-2%.
Важнейшее значение для питания растений имеют азот, фосфор и калий, от которых зависят обмен веществ в растении и его рост. Азот входит в состав белков и хлорофилла, принимает участие в фотосинтезе. Соединения фосфора играют важную роль в дыхании и размножении растений, участвуя в процессах превращения углеводов и азотсодержащих веществ. Калий регулирует жизненные процессы, происходящие в растении, улучшает водный режим, способствует обмену веществ и образованию углеводов в тканях растений.
Основную массу кислорода, углерода и водорода растение получает из воздуха и воды, остальные элементы извлекает из почвы. При современных масштабах культурного земледелия естественный кругооборот питательных элементов в природе нарушается, так как часть их выносится с урожаем и не возвращается в почву (таблица. 10.1), а также вымывается из почвы дождевыми водами или переходит в недеятельную форму (иммобилизируется). Например, азот под воздействием микроорганизмов восстанавливается из иона NO3 — до N2 и N2O. При этом, чем выше урожайность, тем больше вынос питательных элементов из почвы.
Таблица 10.1 — Вынос питательных элементов из почвы
Элемент и его соединение
Вынос, кг/га, при урожае
сахарной свеклы 270 ц/га
Это вызывает необходимость в компенсации потерь питательных элементов в почве путем внесения в нее веществ, содержащих эти элементы, то есть минеральных удобрений, что позволяет обеспечить высокие урожаи сельскохозяйственных культур. Так, при внесении в почву полного, то есть содержащего азот, фосфор и калий, удобрения урожай повышается в 1,5 – 3 раза в зависимости от культуры (табл. 10.2).
Таблица 10.2 — Влияние минеральных удобрений на урожайность
Применения МУ, помимо повышения урожайности, увеличивает производительность труда, сокращает себестоимость сельскохозяйственной продукции и улучшает ее качество: повышает содержание сахара в свекле, крахмала в картофеле, увеличивает прочность хлопкового и льняного волокон, морозо- и засухоустойчивость растений.
10.2. Классификация минеральных удобрений
Ассортимент выпускаемых промышленностью МУ весьма многообразен. Они классифицируются по природе питательных элементов, по содержанию и числу питательных элементов, по способам получения и свойствам.
По природе питательных элементов МУ подразделяют на азотные, фосфорные (фосфатные), калиевые (калийные), магниевые (магнезиальные), борные и т.д. Основное место по масштабам производства занимают первые три вида минеральных удобрений.
По числу питательных элементов МУ делятся на простые (однокомпонентные) удобрения, содержащие только один питательный элемент, и комплексные удобрения, содержащие два (двойные типа NP, PK, NK) или три (тройные типа NPK или полные) элемента.
Комплексные МУ подразделяются на сложные, полученные в результате химической реакции, смешанные, представляющие механические смеси, образованные механическим смешением различных простых минеральных удобрений, и сложносмешанные, представляющие комбинацию двух первых типов.
По содержанию питательного элемента среди МУ выделяют неконцентрированные (содержащие менее 33% питательных элементов), концентрированные (содержащие более 33% питательных элементов) и высококонцентрированные (содержащие более 60% питательных элементов) удобрения.
По свойствам минеральные удобрения делятся на твердые, жидкие, порошкообразные, кристаллические, гранулированные, растворимые и нерастворимые.
Усвоение МУ растениями зависит от их растворимости и характера почв, главным образом от рН почвы. Азотные и комплексные минеральные удобрения растворимы в воде. Фосфорные минеральные удобрения по растворимости делятся на водорастворимые (рН=7), цитратно- или лимоннорастворимые, то есть растворимые в слабых органических кислотах (рН ;
Эффективность использования МУ существенно зависит от правильного сочетания питательных элементов, вносимых с ними в почву. Соотношение питательных элементов выражают в виде формул их состава, например:
Уравновешенные минеральные удобрения — удобрения, в которых соотношение питательных элементов соответствует агротехническим требованиям. От правильного использования минеральных удобрений (их «уравновешенности») существенно зависит урожайность зерновых и других сельскохозяйственных культур.
10.3. Типовые процессы солевой технологии
Большинство МУ представляет различные минеральные соли или твердые вещества с подобными солям свойствами. Технологические схемы производства минеральных удобрений весьма разнообразны, но в большинстве случаев складываются из одних и тех же типовых процессов, свойственных солевой технологии, цель которой – разделение сложных систем, состоящих из нескольких солевых компонентов.
Переработка минерального сырья в соли (и в минеральные удобрения) может идти или его высокотемпературной обработкой, или «мокрым» путем в жидких средах и суспензиях. В соответствии с этим, помимо обычных процессов подготовки сырья к переработке (измельчение, классификация ,обогащение, сушка), в солевой технологии особое значение имеют два типа процессов:
- термическая или термохимическая обработка, то есть различные виды обжига сырья или шихты;
- растворение и перекристаллизация веществ, связанные с их химической обработкой, разделением и очисткой растворов от примесей.
10.3.1. Обжиг
Обжиг — процесс термической обработки материалов, заключающийся в нагреве их до заданной температуры, выдержке при этой температуре и охлаждении. При обжиге, в зависимости от условий процесса, протекают реакции термического разложения, окисления или восстановления, образования и полиморфных превращений минералов. В соответствии с протекающими при обжиге химическими превращениями различают:
- кальцинационный обжиг ( кальцинация ) – удаление из вещества летучих компонентов, чаще всего оксида углерода (IV) и конституционной воды, например:
- обжиг известняка: CaCO3 = CaO + CO2,
- дегидратация гидроксида алюминия до его оксида: 2Al(OH)3 = Al2O3 + 3H2O;
- окислительный обжи г, в результате которого повышаются степени окисления элементов, например: 2FeO + O2 = 2Fe3O4 или превращение сульфида в оксид: CuS + 1,5O2 = CuO + SO2;
- восстановительный обжиг , в результате которого понижаются степени окисления элементов, например, получение элементарного фосфора: Ca3(PO4)2 + 5C + 3SiO2 = P2 + 5CO + 3CaSiO3.
Частный случай обжига – спекание сырья с какими-либо реагентами с целью образования растворимых, извлекаемых из сырья продуктов, например, спекание фторапатита с содой:
Обжиг и спекание представляют собой гетерогенные процессы, в которых реакции протекают в системах «Т + Т», «Ж + Ж» и «Т + Г», где газообразная и жидкая фазы образуются за счет диссоциации и плавления твердой фазы. Поэтому скорость процессов обжига и спекания зависит как от скорости химической реакции, так и скоростей возгонки, плавления и диффузии твердых, жидких и газообразных веществ через фазы, образованные реагирующими компонентами и продуктами их взаимодействия.
Скорость процессов обжига и спекания может быть увеличена за счет повышения температуры, измельчения компонентов обжигаемого материала, повышения их концентрации, перемешивания и создания условий, при которых один из компонентов будет находиться в жидком и газообразном состоянии.
10.3.2. Растворение и выщелачивание
Растворение твердого тела — процесс разрушения его кристаллической структуры под воздействием растворителя с образованием гомогенной системы – раствора.
Растворение может быть физическим, когда возможна обратная кристаллизация растворенного вещества из раствора по схеме
и химическим, когда растворитель или содержащийся в нем реагент химически взаимодействует с растворяемым веществом и делает невозможным его обратную кристаллизацию, то есть по схеме
- где: A — растворяемое вещество; Р — растворитель; В-новое вещество, образовавшееся в результате растворения.
Очевидно, что процесс химического растворения, в отличии от процесса физического растворения, является необратимым.
Растворение представляет гетерогенный некаталитический процесс, протекающий в системе «Т + Ж» в диффузионной области.
Процесс растворения ускоряется при повышении температуры, измельчении твердой фазы, перемешивании и увеличении концентрации. В случае физического растворения движущей силой процесса является разность концентраций , поэтому скорость его определяется уравнением
- (10.1)
- — коэффициент скорости растворения;
- — площадь поверхности кристаллов растворяемого вещества;
- — концентрация растворяемого вещества в жидкой фазе;
- — концентрация насыщенного раствора при данной температуре.
Очевидно, что по мере растворения разность концентраций (СН – С) убывает и процесс растворения замедляется.
Различные случаи химического растворения подчиняются различным кинетическим закономерностям. В наиболее простом случае, когда реакция протекает только на поверхности твердого тела, скорость химического растворения может быть выражена уравнением
- (10.2)
- K — коэффициент, зависящий от температуры, гидродинамических и других условий растворения;
- Ср — концентрация активного реагента в растворителе.
Частный случай растворения – выщелачивание. Это процесс извлечения (экстракции) жидким растворителем твердого компонента из системы, состоящей из двух и большего числа твердых фаз. Как и растворение, выщелачивание может быть физическим и химическим. Скорость выщелачивания зависит от структуры материала и тем выше, чем больше доля растворимой фазы в нем, больше поверхность и крупнее поры в выщелачиваемом материале.
10.3.3. Кристаллизация из растворов
Кристаллизация — процесс выделения твердой фазы (кристаллов) из растворов, происходящий при перенасыщении их по отношению к образующейся твердой фазе. В зависимости от приема, с помощью которого достигается перенасыщение раствора, различают два вида кристаллизации: политермическую и изотермическую.
При политермической кристаллизации пересыщенный раствор образуется за счет охлаждения системы. Этот процесс протекает при переменной температуре ( ). Метод применим для кристаллизации веществ, растворимость которых существенно возрастает при повышении температуры.
При изотермической кристаллизации пересыщенный раствор образуется в результате выпаривания части растворителя. Этот процесс протекает при постоянной температуре (Т = const.). Метод применим для кристаллизации веществ, растворимость которых мало зависит от температуры.
Частным случаем кристаллизации является высаливание, т.е. процесс выделения твердой фазы путем введения в концентрированный раствор веществ, понижающих растворимость растворенного вещества.
Из других типовых процессов, используемых в солевой технологии, наибольшее значение имеют операции разделения солей, находящихся в твердых смесях или растворах. Помимо описанных выше процессов кристаллизации и выщелачивания, к ним относятся: ионный обмен, экстракция веществ неводными растворителями, флотация, гидросепарация и некоторые другие.
Источник