Основы технологии азотных удобрений
Промышленностью выпускаются аммиачные азотные удобрения, содержащие азот в виде катиона NН 4+ , нитратные, содержащие азот в виде аниона NО 3- , аммиачно-нитратные, содержащие оба иона, и амидные, азот в которых находится в форму NН2. По агрегатному состоянию азотные удобрения делятся на твердые (например, карбамид) и жидкие (аммиак, аммиачная вода и аммиакаты, представляющие собой растворы твердых удобрений).
Наиболее распространенными из азотных удобрений являются аммиачная селитра (нитрат аммония) NH4NO3 и карбамид (мочевина) (NH2)2CО. Эти удобрения, как и все аммиачные и нитратные соли, водорастворимы и хорошо усваиваются растениями, однако легко уносятся вглубь почвы при обильных дождях или орошении.
Аммиачная селитра (нитрат аммония) NH4NO3 является безбаластным удобрением, содержащим до 35% азота в аммиачной и нитратной формах. Это удобрение можно использовать для любых сельскохозяйственных культур и почв. Однако NH4NO3 имеет плохие физические свойства: гранулы нитрата аммония сильно гигроскопичные и потому, расплываются на воздухе, слеживаются при хранении в крупные агломераты, трудно вносимые в почву. Кроме того, NH4NO3 огне- и взрывоопасен, что также осложняет применение его в качестве удобрения.
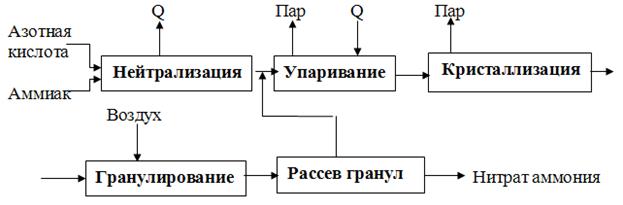
Технологический процесс производства аммиачной селитры (рис. 2) включает следующие стадии:
— нейтрализацию разбавленной азотной кислоты (HNO3) аммиаком (NH3);
— упаривание раствора нитрата аммония;
— кристаллизацию нитрата аммония;
— гранулирование и охлаждение плава;
— рассев гранул на товарные фракции.
Рис. 2 Принципиальная схема производства аммиачной селитры
Карбамид (NH2)2CО относится к ценным азотным удобрениям, содержащим до 46% азота. Как азотную добавку его применяют и в корм скоту. Высокая концентрация азота и хорошие физико-химические свойства, малая слеживаемость, низкие расходы на хранение и транспортирование сделали карбамид основным азотным удобрением.
Сырьем для производства карбамида является аммиак NH3 и диоксид углерода СО2.
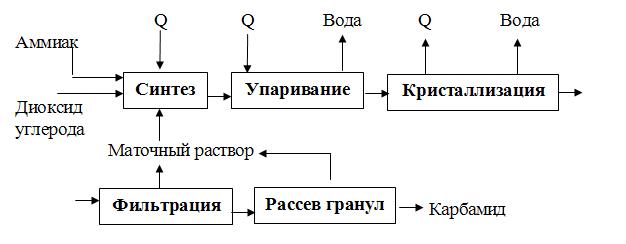
Технологический процесс производства карбамида (рис. 3) включает следующие стадии:
— упаривание раствора карбамида до плава;
— кристаллизация или гранулирование плава;
— фильтрация кристаллов (в случае кристаллизации);
— рассев гранул на товарные фракции.
Рис. 3. Принципиальная схема производства карбамида с полным рециклом
Источник
Азотная промышленность и производство удобрений в России
Основными сферами деятельности современной азотной промышленности России, основы которой были заложены в 1927 году с запуском Чернореченского химического завода, являются:
- получение водорода методом паровой конверсии (риформинга) метана и природного газа,
- производство аммиака и азотной кислоты,
- выпуск на их основе комплекса азотных удобрений.
К числу последних из перечисленных продуктов азотной отрасли относятся органические и неорганические соединения, имеющие в своём составе азот, а именно:
- мочевина (карбамид) и цианамид кальция – амидные удобрения;
- аммофос и диаммофос, хлористый аммоний, сульфат, сульфид и карбонат аммония – удобрения аммиачные;
- калиевая, кальциевая и натриевая селитры – нитратные удобрения;
- аммиачная и известково-аммиачная селитры – аммиачно-натриевые удобрения.
Кроме того, аммиак, являющийся важнейшим сырьём для химической промышленности (общемировая выработка его составляет свыше 180 млн т в год) и получаемая из него азотная кислота являются главными компонентами в деле производства взрывчатых веществ, серной кислоты, соды, растворителей.
История технологий
Продолжительное время источником получения селитры (комплекса минералов, имеющих в своём составе аммоний и нитраты группы щелочных и щелочноземельных металлов), служащей в качестве сырья для получения аммиака, а из него – азотной кислоты; являлись месторождения в Чили и Индии. А также простейшие технологии на основе использования органических отходов флоры и фауны, с добавлением ряда горных пород и строительного мусора. Интереснейший исторический факт: Видный французский учёный Гаспар Монж сумел-таки в момент блокады и вызванного ею экономического кризиса, обеспечить революционные силы Французской республики порохом. А произошло это посредством переработки отбросов и навоза под воздействием бактерий.
Долго так продолжаться не могло. Залежи селитры быстро истощались. А переработка мусора мало что давала. Мировая научная общественность пребывала в сильном затруднении в связи с грядущей проблемой отсутствия удобрений для нужд растениеводства, грозящей тотальным голодом. Но целый ряд проведённых крупнейшими европейскими учёными исследований, привёл в начале XX-го века к осуществлению синтеза аммиака, положенного в основу функционирования современной азотной промышленности.
Роль азота в жизни растений
В это же самое время крупнейший специалист в области агрохимии – российский академик Д. Н. Прянишников проанализировав международный опыт земледелия, приходит к выводу о важности обеспечения культурных растений азотом. Впоследствии жизнь подтвердила его умозаключения.
Сейчас из 214 млн т производимых в мире удобрений 57% падает на долю азотных. 24% – на фосфорные, остальное – на калийные. Развивающиеся страны мира: Китай, Индия, Индонезия, Бразилия быстрыми темпами наращивают их выпуск. Ситуация такова, что лидирующие позиции по выпуску азотных удобрений удерживают:
Список крупнейших экспортёров возглавляют:
- Россия – 9,1 млн т,
- Китай – 7,2 млн т,
- Нидерланды – 2,6 млн т.
А всё потому, что азот является важнейшим химическим элементом живой клетки. Входя в состав белков, хлорофилла, нуклеиновых кислот, ферментов, фосфатидов, витаминов, алкалоидов, он активно воздействует на процессы фотосинтеза и обмена веществ, запуская, регулируя и ускоряя рост и развитие самих растений. Его недостаток или отсутствие приводит к замедлению процесса созревания плодов, подверженности болезням, вплоть до полного прекращения роста и гибели самих растений.
Производство удобрений
Две третьих изготавливаемых и употребляемых азотных удобрений (в 2019 году их было выпущено 23,95 млн т) в нашей стране составляют аммиачная селитра и мочевина. Раннее для их производства применялся коксовый газ, что обуславливало привязку предприятий к объектам металлургической отрасли. Сегодня активнее используется газ природный, обеспечивая тем самым взаимодействие с нефтегазовой промышленностью.
Процесс получения аммиака заключается в синтезе его молекул из азота и водорода при повышенном давлении и температуре, проходящем при участии железного катализатора. Азот извлекают из воздуха, а водород является результатом восстановления воды из природного газа, имеющего в своём составе значительное количество метана.
В зависимости от необходимости получения того или иного продукта, последующая технология будет выглядеть следующим образом:
- Аммиачная селитра – реакция нейтрализации азотной кислоты под воздействием аммиака.
- Мочевина – процесс взаимодействия аммиака и углекислого газа.
- Сульфат аммония – итог протекания аммиачного газа сквозь раствор серной кислоты.
И это лишь малая часть технологических особенностей производства, предназначенного для удовлетворения потребностей агропромышленного комплекса. Структуры призванной обеспечить сельскохозяйственной продукцией жителей страны в необходимом объёме – выполнить продовольственную программу. Для осуществления столь важной задачи требуется дальнейшее развитие азотной промышленности, нацеленное на значительное увеличение выпуска азотных удобрений (снижающее импортную зависимость), как одного из приоритетных направлений российской экономики.
Источник
Основы технологии азотных удобрений



Промышленностью выпускаются аммиачные азотные удобрения, содержащие азот в виде катиона NН 4+ , нитратные, содержащие азот в виде аниона NО 3- , аммиачно-нитратные, содержащие оба иона, и амидные, азот в которых находится в форму NН2. По агрегатному состоянию азотные удобрения делятся на твердые (например, карбамид) и жидкие (аммиак, аммиачная вода и аммиакаты, представляющие собой растворы твердых удобрений).
Наиболее распространенными из азотных удобрений являются аммиачная селитра (нитрат аммония) NH4NO3 и карбамид (мочевина) (NH2)2CО. Эти удобрения, как и все аммиачные и нитратные соли, водорастворимы и хорошо усваиваются растениями, однако легко уносятся вглубь почвы при обильных дождях или орошении.
Аммиачная селитра (нитрат аммония) NH4NO3 является безбаластным удобрением, содержащим до 35% азота в аммиачной и нитратной формах. Это удобрение можно использовать для любых сельскохозяйственных культур и почв. Однако NH4NO3 имеет плохие физические свойства: гранулы нитрата аммония сильно гигроскопичные и потому, расплываются на воздухе, слеживаются при хранении в крупные агломераты, трудно вносимые в почву. Кроме того, NH4NO3 огне- и взрывоопасен, что также осложняет применение его в качестве удобрения.
Технологический процесс производства аммиачной селитры (рис. 2) включает следующие стадии:
— нейтрализацию разбавленной азотной кислоты (HNO3) аммиаком (NH3);
— упаривание раствора нитрата аммония;
— кристаллизацию нитрата аммония;
— гранулирование и охлаждение плава;
— рассев гранул на товарные фракции.
Рис. 2 Принципиальная схема производства аммиачной селитры
Нейтрализация осуществляется в специальном реакторе — нейтрализаторе, откуда разогретый раствор NH4NO3 (реакция нейтрализации идет с выделением тепла) поступает в вакуум-выпарной аппарат, где на выходе получается плав с содержанием NH4NO3 98-99%. Плав поступает в верхнюю часть грануляционной башни, где разбрызгивается через специальное приспособление – форсунку. Капли селитры, падая вниз, застывают в потоке подающегося снизу холодного воздуха и образуют гранулы, которые поступают на дополнительное охлаждение и затем рассеиваются на фракции. Частицы менее 1 мм и более 3 мм присоединяются к раствору, идущему на выпаривание. Готовый продукт (частицы размером 1. 3 мм) упаковывается в водонепроницаемые мешки.
В себестоимости аммиачной селитры затраты распределяются примерно следующим образом: затраты на сырье и основные материалы составляют 85%, на вспомогательные материалы – 5%, на энергию – 5%, зарплату – 0,3%, прочие расходы – 4,7%.
Таблица 2 – Физико-химические свойства аммиачной селитра в соответствии с ГОСТ 2-85
| Наименование показателя | Норма марки | |||
| А | Б | |||
| Высший сорт | Первый сорт | Второй сорт | ||
| 1. Суммарная массовая доля нитратного и аммонийного азота в пересчете: — на NH4NO3 в сухом веществе, %, не менее — на азот в сухом веществе, %, не менее | Не нормируется | Не нормируется | Не нормируется | Не нормируется |
| 34,4 | 34,4 | 34,0 | ||
| 2. Массовая доля воды, %, не более: — с сульфатной и сульфатно-фосфатной добавками — с добавками нитратов кальция и магния | 0,2 0,3 | 0,2 0,3 | 0,2 0,3 | 0,3 0,3 |
| 3. рН 10%-ного водного раствора, не менее: — с ульфаино-фосфатной добавкой | 5,0 4,0 | 5,0 4,0 | 5,0 4,0 | 5,0 4,0 |
| 4. Массовая доля веществ, не растворимых в 10%-ном растворе азотной кислоты, %, не более | 0,2 | Не нормируется | ||
| 5. Гранулометрический состав: — массовая доля гранул размером от 1 до 3 мм, %, не менее — массовая доля гранул размером от 1 до 4 мм, %, не менее В том числе Гранул размером от 2 до 4 мм, %, не менее — массовая доля гранул размером менее 1 мм, %, не более — массовая доля гранул размером более 6 мм, % | Не нормируется Не нормируется 0,0 | Не нормируется 0,0 | Не нормируется 0,0 | Не нормируется Не нормируется 0,0 |
| 6. Статичтическая прочность гранул, Н/ гранулу (кг/ гранулу), не менее: — с сульфатной и сульфатно-фосфатной добавками — с добавками нитратов кальция и магния | 5 (0,5) | 10(1,0) 8 (0,8) | 7 (0,7) | 5(0,5) |
| 7. Рассыпчатость, %, не менее |
Карбамид (NH2)2CО относится к ценным азотным удобрениям, содержащим до 46% азота. Как азотную добавку его применяют и в корм скоту. Высокая концентрация азота и хорошие физико-химические свойства, малая слеживаемость, низкие расходы на хранение и транспортирование сделали карбамид основным азотным удобрением.

Сырьем для производства карбамида является аммиак NH3 и диоксид углерода СО2.
Технологический процесс производства карбамида (рис. 3) включает следующие стадии:
— упаривание раствора карбамида до плава;
— кристаллизация или гранулирование плава;
— фильтрация кристаллов (в случае кристаллизации);
— рассев гранул на товарные фракции.
Рис. 3. Принципиальная схема производства карбамида с полным рециклом
В промышленности синтез карбамида осуществляется в две стадии при 100%-м избытке аммиака, давлении 18-20 МПа и температуре 180-200 0 С. Выход карбамида в оптимальных условиях составляет 60-70% при использовании чистых СО2 и NH3. В целях улучшения экономических показателей производства, не вступившие во взаимодействие между собой аммиак и СО2, используются для получения других продуктов или снова возвращаются в процесс.
Диоксид углерода, предварительно очищенный от соединений серы и механических примесей, сжимается компрессором до 18-20МПа и при температуре ≈ 40 0 С непрерывно подается в колонну синтеза. Плунжерным насосом в колонну непрерывно вводится и жидкий аммиак, нагретый до 90 0 С. Затем полученный раствор карбамида упаривается в выпарном аппарате. Далее карбамид либо кристаллизуют в кристаллизаторах и отделяют кристаллы от маточного раствора на соответствующем фильтровальном оборудовании, либо гранулируют в грануляционной башне. Рассев гранул на товарные фракции осуществляется так же, как и в случае аммиачной селитры.
На 1т карбамида в среднем расходуется: аммиака – 0,58 т; диоксида углерода – 0,77т; воды – 90м 3 ; электроэнергии – 130 кВт×ч; пара – 1,3т.
В себестоимости карбамида затраты распределяются примерно следующим образом: затраты на сырье и основные материалы составляют 65%, на вспомогательные материалы – 15%, на энергию – 15,6%, зарплату – 0,4%, прочие расходы – 4%.
Качество карбамида, идущего на нужды сельского хозяйства, регламентировано ГОСТ2081-92
Таблица 3 – Физико-химические свойства карбамида в соответствии с ГОСТ 2081-92
Источник