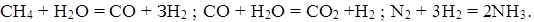Глава 5. Экологическая характеристика производств
О.А. Федяева
Промышленная экология
Конспект лекций. – Омск: Изд-во ОмГТУ, 2007. — 145 c.
Глава 5. Экологическая характеристика производств
5.8. Производство аммиака, азотной кислоты, азотных удобрений
В основе производства синтетического аммиака, из которого получают азотную кислоту, аммиачную селитру, карбамид и другие продукты, лежит фиксация азота из атмосферного воздуха. В качестве источника сырья водорода используются природный или коксовый газ. Реакция синтеза водорода и азота проходит при высоких температуре и давлении. Производство аммиака и получение водорода, на долю которого приходится до 80 % себестоимости продукции, довольно сложны. Только получение водорода конверсией природного газа водяным паром включает шесть стадий. Основные стадии процессов синтеза аммиака можно изобразить следующими уравнениями:
Из системы продувки, регенерации и конверсии газов при операциях переливания готовой продукции выделяются в атмосферу оксиды углерода, аммиак и метан. Удельные выбросы от производства аммиака с метанатором составляют, кг/т продукции: аммиака — 100, метана — 45; а от производства с абсорбером оксидов углерода и системой регенерации выбросы составляют: оксида углерода (II) — 100, аммиака — 105, метана — 45.
Уменьшение этих выбросов достигается за счет внедрения новых мощных агрегатов синтеза (400—500 тыс. т/год), применения продувочных газов в производстве и сжигания на свече, использования оксида углерода (IV) для синтеза карбамида (мочевины). Мочевина применяется для нужд животноводства, в качестве удобрения, а также для синтеза других органических соединений. Применение двухступенчатых орошаемых скрубберов позволяет обеспечить эффективность очистки до 99 %.
При производстве карбамида атмосфера загрязняется аммиаком и пылью. Установка конденсаторов-промывателей, абсорберов, проведение кислотной промывки газов, изменение конструкции гранулировочных башен привели к снижению этих выбросов, исключили образование мелкой фракции пыли.
За последние десятилетия изменение технологии, наращивание единичных мощностей привели к глубоким изменениям в структуре азотной промышленности, что положительно отразилось и на окружающей среде.
Получение азотной кислоты из аммиака происходит путем его окисления до оксидов азота при высокой температуре в присутствии катализаторов (платина и её соединения) и поглощения их водой с образованием слабой азотной кислоты. Реакции происходят в такой последовательности:
Анализ сложного технологического процесса получения аммиака, а из него оксидов азота и азотной кислоты показывает, что рабочие могут подвергаться воздействию врёдных газов (оксиды углерода, сероводород, аммиак, оксиды азота). В связи с тем, что некоторые процессы проходят при высоких давлениях и температуре, вероятность загрязнения воздушной среды увеличивается. Кроме того, существует опасность химических ожогов азотной и серной кислотами.
Многие газы, участвующие в химических процессах данного производства, способны образовывать с воздухом взрывчатую смесь. Так, для аммиака нижний предел взрываемости составляет 16, а верхний — 27 %, для оксида углерода (II) соответственно 12,5 и 75 %, водорода — 4 и 75 %, метана — 4,5 и 16 %, сероводорода — 4,5 и 46 %.
Концентрирование азотной кислоты осуществляется с помощью крепкой серной кислоты путем дегидратации в колонне. При этом воздух может загрязняться оксидами азота (нитрогазы), образующими непостоянную смесь оксида азота (II), оксида азота (IV) и других оксидов азота, а также туманом азотной кислоты.
Для снижения и ликвидации выбросов азота («хвостовых газов», «лисьих хвостов»), которые могут достигать 5-12 т в сутки, внедряется каталитическое восстановление на палладиевом или ванадиевом катализаторе. Созданы установки для селективного восстановления оксидов азота аммиаком на катализаторе из редкоземельных металлов. При исходной концентрации оксидов азота 1000 — 3000 мг/л, температуре 480 0 С и соотношении NH3/NO2 = 1 улавливается 95-99 % оксидов азота.
При получении концентрированной азотной кислоты выделяющиеся от конденсаторов оксиды азота улавливаются в абсорберах. Удельные выбросы оксида азота (IV) могут составлять 25-27,5 кг/т кислоты.
Выбросы оксидов азота в зависимости от способа производства азотной кислоты представлены в табл. 3.
Минимальными удельными выбросами, как видно из табл. 3, обладают системы, работающие под давлением 0,73 МПа. Эти системы снабжены узлами каталитической очистки газов на палладиевом катализаторе. Для восстановления используется метан:
После доочистки в отходящих газах может быть 0,005 об. % оксидов азота, что отвечает санитарным нормам.
Состав выбросов оксидов азота
Концентрация производимой азотной кислоты, %
Количество выбрасываемых оксидов азота, %
В ближайшее время в азотнокислотном производстве так называемые «лисьи хвосты» будут ликвидированы, так как старые технологические схемы заменят на новые, работающие под давлением 0,73 МПа и имеющие мощность 120 тыс. тонн кислоты в год, а в недалеком будущем — 400 тыс. т/год слабой азотной кислоты.
В настоящее время производство аммиачной селитры, карбамида и комплексных удобрений развивается в направлении наращивания единичных мощностей агрегатов, совершенствования отдельных стадий и максимального снижения отходов, выбрасываемых в окружающую среду. При производстве аммиачной селитры, которую получают путем взаимодействия азотной кислоты с аммиаком (нейтрализация, концентрирование раствора, сушка и гранулирование), внедряются установки мощностью 450 тыс. т/год. На них осуществлен ряд новых технических решений, позволивших устранять загрязнение конденсата сокового пара аммиачной селитры, уменьшить потери готовой продукции после гранулирования. Сейчас выбросы пыли при производстве аммиачной селитры достигают 3,7, оксидов азота — 1,95, аммиака — 1,9 кг/т готовой продукции.
Для очистки выбросов применяют скрубберы и циклоны. Уменьшить указанные потери можно также с помощью различных фильтрующих материалов.
При производстве карбамида можно достичь подобного эффекта при гранулировании его в жидких, инертных по отношению к карбамиду растворителях с температурой кипения и кристаллизация выше и ниже температуры расплава и затвердевания карбамида (жирные спирты, сульфированный керосин, дизельное топливо и др.). Возможны и другие пути уменьшения потерь в производстве азотных удобрений.
В целях охраны окружающей среды перспективными представляются методы фиксации атмосферного азота с применением плазмохимических реакций. Совмещение плазменного процесса с разложением фосфорсодержащего сырья в атмосфере воздуха с одновременной фиксацией азота даст возможность получить из оксида фосфора (V) и оксидов азота смесь фосфорной и азотной кислот для производства комплексных удобрений с одновременным обесфториванием продуктов и отсутствием фосфогипса. Известен также способ фиксации азота из атмосферного воздуха с использованием естественных ферментов, в состав которых входит металлы. Он может быть в будущем использован также для синтеза углеводородов из оксида углерода (IV) и соды.
Анализ особенностей производства аммиака и продуктов на его основе показывает, что благодаря научно-техническому прогрессу появляются возможности получения необходимых продуктов с одновременным снижением отрицательного воздействия на окружающую среду и здоровье людей.
Источник
Технология производства азотных удобрений на основе природного газа: аммиачной селитры
Использование удобрений в сельском хозяйстве. Описание и свойства аммиачной селитры и методы ее применения аграрном секторе. Характеристика производства аммиачной селитры. Выпарка водного раствора с использованием азотной кислоты разных концентраций.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 13.06.2019 |
| Размер файла | 811,6 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Министерство образования и науки РФ
Федеральное государственное бюджетное образовательное учреждение
«Уфимский государственный нефтяной технический университет»
Кафедра биохимии и технологии микробиологических производств
по дисциплине «Общая химическая технология»
Технология производства азотных удобрений на основе природного газа: аммиачной селитры
Студент гр. БТБ-15-01
Доцент БТМП, к.х.н
Соединения азота играют огромную роль в минеральном питании растений. Азот входит в состав белков, являющихся основой растительной ткани, а также в состав хлорофилла, с помощью которого растения ассимилируют углерод из находящегося в атмосфере диоксида углерода. Содержание азота в зерне составляет 1,8-2,1%,в соломе — 0,5%, в клубнях картофеля -0,2-0,3%,в листьях и ботве -0,4-0,5%.
Ежегодный вынос азота из почвы с урожаем сельскохозяйственных культур в зависимости от вида культуры и величины урожая колеблется от 50-300 кг/га. В связи с этим для поддержания и повышения урожайности сельскохозяйственных культур необходимо ежегодно вносить в почву вещества, содержащие в своем составе азот, в форме, доступной для усвоения растений. Эти вещества называются азотными удобрениями.
удобрение аммиачный селитра кислота
1. Понятие удобрений
Удобрениями называются вещества, содержащие элементы, необходимые для питания растений и вносимые в почву с целью получения высоких устойчивых урожаев.
Азотные удобрения подразделяются на аммиачные, в которых азот содержится в виде свободного аммиака или аммиакатов; аммонийные — азот содержится в виде катиона NH4; нитратные — азот содержится в виде аниона NO3, и амидные, в них азот содержится в виде амино-группы NH2.
К числу азотных удобрений относится жидкий и водный аммиак, сульфат, нитрат и фосфаты аммония, нитраты натрия и кальция, карбамид и их смеси. Все азотные удобрения хорошо растворимы в воде, поэтому азот из них легко усваивается растениями. Сырьем для получения аммиачных, аммонийных и амидных удобрений является аммиак, для нитратных удобрений — азотная кислота. Эти вещества получают из элементарного азота, запасы которого в атмосфере практически неограничены. Качество азотных удобрений оценивается по содержанию азота, величине растворимости в воде, по физиологическому действию на почвенные растворы, по гранулометрическому составу, гигроскопичности, слеживаемости, а также по термической устойчивости. Наибольшее применение в качестве азотных удобрений получили сульфат, нитрат аммония, карбамид и их смеси, поэтому в настоящем пособии ограничимся рассмотрением только этих соединений.
Промышленностью выпускаются следующие виды азотных удобрений: аммиачные, содержащие азот в виде катиона NH4+, нитратные, содержащие азот в виде аниона NO3-, аммиачно-нитратные, содержащие оба иона, и амидные, азот в которых находится в форме NH2. По агрегатному состоянию азотные удобрения бывают твердые (например, карбамид) и жидкие (аммиак, аммиачная вода и аммиакаты, представляющие собой растворы твердых удобрений).
Наиболее распространенными из азотных удобрений являются аммиачная селитра, содержащие азот в виде (нитрата аммония) NН4NO3 и карбамид (мочевина) (NH2)2CO,. Эти удобрения, как и все аммиачные и нитратные соли, водорастворимы и хорошо усваиваются растениями.
2. Аммиачная селитра,описание и свойства
Аммиачная селитра (нитрат аммония) NН4NO3 является безбалластным удобрением, содержащим до 35 % азота, из них 17,4% в аммиачной (NH4+) и 17,4% в нитратной (NO3-) форме. Это удобрение содержит аммиачный NH4 и нитратный NO3 -азот, что позволяет успешно использовать аммиачную селитру на любых почвах и для любых сельскохозяйственных растений.Бесцветное кристаллическое вещество с температурой плавления 169,6°С, хорошо растворимое в воде. Это ее качество, с одной стороны, является положительным, а с другой — отрицательным, так как удобрение вымывается из почвы дождевыми водами. Поэтому аммиачную селитру приходится вносить в несколько приемов, что требует дополнительных затрат. Однако эти затраты окупаются за счет увеличения урожайности сельскохозяйственных культур. может использоваться не только для основного внесения, но и в качестве разовых подкормок, эффективна на слабоувлажненных почвах и практически бесполезна на песчаных грунтах, требует безоговорочного соблюдения правил хранения.
Некоторые физические свойства аммиачной селитры затрудняют ее внесение в почву. В силу высокой гигроскопичности селитра слеживается при хранении. Для устранения этого недостатка ее гранулируют. При неблагоприятных условиях хранения (повышенные температура, влажность) аммиачная селитра взрывается, что необходимо учитывать при ее хранении и транспортировке. Кроме того, может иметь место изменение кристаллической формы селитры (ее перекристаллизация) с увеличением объема, что приводит к разрушению тары.
Это удобрение можно использовать для любых сельскохозяйственных культур и почв. Однако нитрат аммония имеет и некоторые недостатки: его гранулы сильно гигроскопичны и поэтому расплываются на воздухе, слеживаются при хранении в крупные агломераты, трудно вносимые в почву. Кроме того, NН4NO3 огне- и взрывоопасен, что также осложняет его применение в качестве удобрения.
Твердый нитрат аммония в области температур от 169,6°С до-50°С существует в виде пяти полиморфных модификаций, различающихся кристаллической структурой, плотностью кристаллов и объемом кристаллической решетки.
Таблица 1-Кристаллографические характеристики модификаций нитрата аммония
Каждая модификация существует в определенном интервале температур и переход одной модификации в другую сопровождается изменением структуры и объема кристаллической решетки. Эти превращения являются обратимыми и сопровождаются выделением (или поглощением тепла) и скачкообразным изменением удельного объема. При охлаждении расплава аммонийной селитры происходят последовательные превращения первой модификации во вторую, второй в третью, третей в четвертую и четвертой в пятую. В точках перехода одной модификации в другую в образовавшихся кристаллах возникают сильные деформационные усилия, которые приводят к их разрушению. Наибольшие деформации испытывают кристаллы NH4NO3 при последовательном превращении модификаций II > III > IV, так как элементарный объем кристаллической решетки третьей модификации примерно в два раза больше, чем второй, в то время как объемы второй и четвертой модификаций практически одинаковы. Превращение второй модификации в третью происходит при температуре 84,2°С, а третьей в четвертую — при 32,3°С. Во избежание разрушения кристаллов нитрата аммония при охлаждении возникает необходимость заменить последовательные превращения модификаций II > III > IV на метастабильное превращение второй модификации в четвертую, минуя третью. В этом случае деформации кристаллов NH4NO3 будут минимальными, так как объем кристаллической решетки второй модификации составляет 163,7 Е3, а четвертой — 155,4 Е3. Для решения этой проблемы был выполнен большой объем исследований по определению влияния различных примесей на характер и последовательность модификационных превращений нитрата аммония. Установлено, что характер и последовательность модификационных превращений зависит от содержания влаги в расплаве и примесей сульфата аммония, фосфатов аммония и нитрата магния. Так, при охлаждении плава нитрата аммония, содержащего 0,04- 0,08% Н2О, происходит замена последовательных превращений модификаций II > III > IV на метастабильный переход II > IV, который осуществляется при температуре 50°С.
Аналогичное влияние на характер и последовательность модификационных превращений нитрата аммония оказывают примеси сульфата аммония, фосфатов аммония и нитрата магния. При содержании этих примесей в расплаве NH4NO3 0,5-2,0% в процессе охлаждения стабилизируется переход второй модификации в четвертую, минуя третью при температуре 50°С. При наличии этих добавок содержание влаги в расплаве может быть увеличено до 0,2-0,3%.
Это свойство аммонийной селитры широко используется в промышленной практике. При производстве гранулированной аммонийной селитры в состав ее растворов перед выпаркой вводят соответствующие добавки, выпарку растворов проводят до концентрации 99,7-99,8%,гранулирование расплава осуществляют в грануляционных башнях, а охлаждение гранул — в аппаратах с кипящим слоем до температуры 40-50°С.
Аммонийная селитра хорошо растворима в воде, причем с повышением температуры растворимость резко возрастает. Влияние температуры на растворимость NH4NO3 характеризуется данными, представленными в таблице 2.
Таблица 2-Влияние температуры на растворимость NH4NO3
Таким образом, при выпарке водные растворы NH4NO3 могут быть превращены в расплав, что существенно упрощает технологию ее получения за счет исключения стадий кристаллизации из растворов, фильтрации и сушки.
Аммонийная селитра обладает высокой гигроскопичностью, которая характеризуется данными, представленными в таблице 3.
Таблица 3-Зависимость гигроскопичности аммонийной селитры от температуры
При относительной влажности воздуха выше гигроскопической точки аммонийная селитра поглощает влагу из воздуха и увлажняется. При изменении температуры происходит кристаллизация NH4NO3 из поверхностного раствора, благодаря чему частицы NH4NO3 сращиваются друг с другом, превращаясь из порошкообразного состояния в монолитную массу. Это явление называется слеживаемостью. Для борьбы со слеживаемостью необходима глубокая сушка продукта, упаковка во влагонепроницаемую тару и обработка поверхности частиц антислеживающими гидрофобными добавками.
Аммонийная селитра является низко термически устойчивой. При нагревании выше 110°С аммонийная селитра медленно разлагается на аммиак и азотную кислоту по реакции
NH4NO3= NH3+ HNO3+ 144,9 кДж (1)
При 165°С потеря массы селитры не превышает 6 %/сут. При этом аммиак удаляется в газовую фазу, а азотная кислота накапливается в твердой и жидкой фазе и разлагается с выделением NO2, который вступает во взаимодействие с NH4NO3по реакции
NH4NO3+ 2NO2= N2+ 2HNO3+ H2O + 232 кДж (2)
Эта реакция сильно экзотермична и приводит к образованию новых порций азотной кислоты и к разогреву массы. Таким образом, азотная кислота является катализатором разложения NH4NO3, поэтому нельзя допускать ее накопления в массе селитры. При нагревании селитры до температуры 200-270°С протекает слабоэкзотермическая реакция
NH4NO3= N2O + 2H2O + 36,8 кДж (3)
При резком повышении температуры, а также под воздействием детонаторов происходит взрывное разложение селитры по уравнению
NH4NO3= N2+ 0,5O2+ 2H2O +118 кДж (4)
Все эти свойства необходимо учитывать при производстве аммонийной селитры, строго соблюдая технологический регламент, и не допускать нарушений правил хранения и транспортировки готового продукта.
3 Характеристика производства аммиачной селитры
Технологический процесс производства аммиачной селитры включает следующие стадии:
-нейтрализацию разбавленной азотной кислоты аммиаком (NH3);
-упаривание раствора нитрата аммония;
-кристаллизацию нитрата аммония;
-гранулирование и охлаждение плава;
-рассев гранул на товарные фракции.
Производство азотных удобрений базируется на исходном сырье, коим является аммиак и азотная кислота 47-60% -ной концентрации. До недавнего времени аммиак получали из кокса (коксового газа), поэтому многие предприятия, специализирующиеся на изготовлении удобрений, располагались в непосредственной близости от металлургических заводов. Более того, крупные металлургические комбинаты практикуют производство азотных удобрений в качестве «попутной» продукции.
На сегодняшний день приоритеты несколько изменились и основным сырьем для удобрений все больше выступает не коксовый, а природный газ. Так что современные производители удобрений дислоцируются вблизи магистральных газопроводов. Также производство азотных удобрений было успешно налажено на основе использования отходов нефтепереработки.
Нейтрализация азотной кислоты аммиаком — это необратимый гетерогенный процесс, протекающий с выделением тепла, по уравнению:
HNO3+ NH3= NH4NO3 (5)
4 Выпарка водного раствора с использованием азотной кислоты разных концентраций
В результате нейтрализации образуется водный раствор нитрата аммония которые для получения твердого продукта подвергаются выпарке. В процессе нейтрализации выделяется большое количество тепла, которое используется для выпарки растворов. Количество выделяющегося тепла зависит от концентрации азотной кислоты. В соответствии с использованием тепла все существующие варианты технологического процесса производства нитрата аммония делятся на две группы:
-Без упаривания раствора. Концентрирование раствора осуществляется за счет теплоты нейтрализации азотной кислоты концентрацией 65% . При этом образуется 96% плав нитрата аммония.
-С упариванием раствора. Концентрирование раствора осуществляется как за счет использования теплоты нейтрализации, так и за счет подводимого извне тепла. При этом, в зависимости от концентрации азотной кислоты последующее упаривание раствора нитрата аммония может производиться: при 58% -ной кислоте в 1 ступень, при 50% -ной кислоте в 2 ступени.
При использовании чистых 100%-ныхвеществ тепловой эффект реакции составляет 144,9 кДж/моль. При использовании водных растворов азотной кислоты величина теплового эффекта уменьшается на теплоту разбавления100%-ной азотной кислоты и теплоту растворения аммонийной селитры. Зависимость теплоты нейтрализации от концентрации азотной кислоты представлена на рисунке 1.
Рисунок 1-Зависимость теплоты нейтрализации от концентрации азотной кислоты
С увеличением концентрации азотной кислоты количество выделяющегося тепла на единицу объема раствора возрастает, что позволяет испарять большее количество воды и получать более концентрированные растворы аммонийной селитры.
Зависимость концентрации растворов NH4NO3, образующихся в нейтрализаторе при использовании теплоты нейтрализации на выпарку воды, от концентрации HNO3 приведена на рисунке 1
Представленные данные показывают, что при использовании азотной кислоты с концентрацией выше 60% и подогреве исходных реагентов до 100°С и выше количество выделяющегося тепла достаточно для полного испарения воды и получения расплава селитры, что создает предпосылки для организации безупарочного процесса производства аммонийной селитры. Однако в этих условиях в реакционной зоне развиваются температуры выше 200°С, что приводит к разложению азотной кислоты и селитры, а также к потерям связанного азота. Поэтому безупарочные процессы практически не используются.
Рисунок 2-Зависимость концентрации растворов NH4NO3 от концентрации азотной кислоты:1-температура компонентов 70 °С;2- температура компонентов 20°С;3- без использования теплоты реакции.
Рисунок 3- Аппарат ИТН:
1-корпус аппарата;2- реакционный стакан;3- барботер азотной кислоты;4- барботер аммиака;5- циркуляционные окна;6- завихритель;7-гидрозатвор; 8- сепаратор;9- штуцер сокового пара
Отвод теплоты нейтрализации из реакционной зоны необходим не только для выпарки раствора, но и с целью предотвращения чрезмерного повышения температуры. Для решения этой проблемы был разработан реактор-нейтрализатор типа ИТН (использователь теплоты нейтрализации), в котором нейтрализация азотной кислоты осуществляется под атмосферным давлением в режиме кипения раствора.
Аппарат ИТН представляет собой цилиндрический сосуд 1, в котором установлен реакционный стакан 2.Азотная кислота и аммиак подаются в барботеры 3 и 4, расположенные друг над другом. Барботеры обеспечивают встречную подачу реагентов в диспергированном состоянии.
При соприкосновении азотной кислоты с аммиаком происходит мгновенная реакция нейтрализации, сопровождающаяся большим выделением тепла. В результате этого раствор селитры вскипает, в нем образуются пузырьки пара, создающие большую подъемную силу, под действием которой раствор селитры поднимается вверх и через крышку-завихритель 6 попадает в сепарационное пространство, где происходит отделение сокового пара от раствора. Раствор селитры по зазору между корпусом аппарата и реакционным стаканом опускается вниз и засасывается через отверстия 5 внутрь реакционного стакана, благодаря чему осуществляется интенсивная циркуляция раствора. Часть нейтрализованного раствора непрерывно выводится из аппарата ИТН через гидрозатвор 7 и сепаратор 8 и направляется на выпарку. Соковый пар под давлением 15-20 кПа выводится через штуцеры 9. Разработанный аппарат позволяет осуществлять процесс нейтрализации непрерывно в режиме кипения с максимальным использованием теплоты нейтрализации на выпарку воды, не опасаясь перегрева реакционной массы. С целью уменьшения потерь связанного азота с соковым паром процесс нейтрализации проводят с избытком азотной кислоты(2-3г/л), так как давление паров HNO3 над раствором NH4NO3 при ее избытке будет значительно меньше, чем давление паров NH3 при избытке аммиака. При нейтрализации 47-49%-ной азотной кислоты в аппарате ИТН получают раствор NH4NO3 с концентрацией 62-65%. При использовании 54-57%-ной HNO3 концентрация раствора NH4NO3 возрастает до72-80%,а при концентрации HNO3 58-60%образуется раствор NH4NO3 c концентрацией 89-92%.При этом температура сокового пара составляет соответственно 120, 130 и 160°С. Это позволяет использовать соковый пар в качестве греющего агента при выпарке раствора NH4NO3 в вакуум-выпарныхаппаратах, благодаря чему достигается двукратное использование теплоты нейтрализации на выпарку воды.
Технологическая схема нейтрализации азотной кислоты с двукратным использованием теплоты нейтрализации представлена на рисунке 4.
Рисунок 4- Схема нейтрализации азотной кислоты двукратным использованием теплоты нейтрализации:1- напорный бак азотной кислоты;2- подогреватель аммиака;3- сепаратор;4- аппарат ИТН;5- промыватель сокового пара;6-вакуум-выпарной аппарат;7- донейтрализатор
По этой схеме азотная кислота с концентрацией 47- 54% поступает в напорный бак 1, откуда через автоматический регулятор расхода направляется в аппарат ИТН4.
Газообразный аммиак под давлением 200-300 кПа проходит сепаратор3 и подогреватель 2 для предотвращения попадания в нейтрализатор жидкого аммиака и направляется в аппарат ИТН 4. Расход аммиака автоматически регулируется по величине рН раствора NH4NO3 на выходе из нейтрализатора так, чтобы концентрация HNO3 в нейтрализованном растворе составляла2-3г/л. Нейтрализованный раствор направляется на выпарку в вакуум-выпарной аппарат 6, где в качестве греющего агента используется соковый пар. Соковый пар на выходе из аппарата ИТН загрязнен брызгами раствора аммонийной селитры, аммиаком или парами азотной кислоты. Поэтому он подвергается очистке в промывателе 5 с тремя ситчатыми тарелками, на которых уложены змеевики, охлаждаемые водой. При этом часть сокового пара конденсируется и на тарелках создается слой конденсата, барботируя через который соковый пар очищается от примесей. После выпарки в вакуум-выпарном аппарате концентрация раствора NH4NO3 возрастает до 82-92%,после чего он направляется на окончательную выпарку до состояния плава с концентрацией 99,7-99,8%,которая осуществляется свежим паром. Перед окончательной выпаркой раствор NH4NO3 проходит донейтрализатор 7, где осуществляется полная нейтрализация HNO3 аммиаком и поддерживается избыток аммиака 0,1 г/л, так как на стадии окончательной выпарки наличие свободной азотной кислоты недопустимо.
Описанная схема используется в том случае, если концентрация азотной кислоты не превышает 54%.
При использовании азотной кислоты концентрацией 65% и температуре процесса около 70°С возможно за счет теплоты нейтрализации выпарить основную массу воды, вводимой с азотной кислотой и получить высококонцентрированный раствор и даже плав нитрата аммония.
5 Основные процессы производства аммиачной селитры
Обычно аммиачную селитру производят на заводах, вырабатывающих синтетический аммиак и азотную кислоту, по следующей схеме.
Рисунок 3-Схема производства аммиачной селитры
Нейтрализатор -цилиндрический сосуд из коррозионно-стойкой стали, внутри которого помещен второй цилиндр . Азотная кислота и газообразный аммиак непрерывно подаются в нижнюю часть цилиндра, в котором происходит нейтрализация кислоты, сопровождающаяся выделением теплоты. Нагретый раствор поднимается вверх и переливается через края цилиндров в пространство между ними, составляющее испарительную часть аппарата. Здесь удаляется значительная часть воды из раствора, в результате чего температура в нейтрализаторе снижается. Выделяющийся водяной пар выводят из аппарата и используют в качестве теплоносителя при дальнейшем упаривании раствора. Из нейтрализатора раствор поступает в донейтрализатор,куда подается дополнительно аммиак для полной нейтрализации раствора. Затем раствор направляют в вакуум-выпарной аппарат. Его концентрация доводится до 97…98%. Образующийся плав поступает в грануляционную башню на гранулирование. Башня представляет собой железобетонный цилиндр (высота 35…40 м, диаметр 12…16 м), в нижней части которого имеются щели для поступления воздуха. Для создания восходящего воздушного потока устанавливается вентилятор, а для разбрызгивания плава селитры-форсунка. Капли селитры, падая вниз, застывают в потоке холодного воздуха и образуют гранулы, которые поступают на дополнительное охлаждение и затем рассеиваются на фракции. Частицы менее 1 мм и более 3 мм присоединяются к раствору, идущему на выпаривание. Готовый продукт (частицы размером 1…3 мм) упаковывается в водонепроницаемые мешки (многослойные бумажные, пропитанные битумом, или полиэтиленовые).
Аммиачная селитра выпускается двух марок: А — кристаллическая или чешуйчатая, Б — гранулированная. Селитра марки Б применяется в качестве удобрения и проверяется на рассыпчатость и гранулометрический состав.
Производство аммонийной селитры оказывает минимальное техногенное воздействие на окружающую среду. Твердые и жидкие отходы в этом производстве отсутствуют. Единственным источником загрязнениям окружающей среды являются газообразные отходы — соковый пар из аппаратов ИТН, паровоздушная смесь из комбинированного выпарного аппарата и охлаждающий воздух из грануляционных башен. Они содержат в своем составе брызги раствора NH4NO3, пары азотной кислоты, аммиак, пыль и аэрозольные частицы NH4NO3.
Список использованных источников
1.Атрощенко, В. И. Технология связанного азота / В. И. Атрощенко. — Киев: Вища школа, 1985.
2.Производство аммиака под ред. В. П. Семенова. — М.: Химия, 1985.
3.Атрощенко, В. И. Технология азотной кислоты / В. И. Атрощенко, С. И. Каргин. — Л.: Химия, 1980.
4.Производство азотной кислоты в агрегатах большой единичной мощности / под ред. В. М. Олевского. — М.: Химия, 1985.
5.Производство аммиачной селитры в агрегатах большой единичной мощности / под ред. В. М. Олевского. — М.: Химия, 1990.
6. Кучерявый, В. И. Синтез и применение карбамида / В. И. Кучерявый, В. В. Лебедев. — М.: Химия, 1970.
7.Горловский, Д. М. Технология карбамида / Д. М. Горловский, Л. Н. Альтшулер, В. И. Кучерявый. — Л.: Химия, 1981.
8.Атрощенко, В. И. Методы расчетов по технологии связанного азота / В. И. Атрощенко. — Киев: Выш. школа, 1978.
9.Аммиак. Вопросы технологии / И. М. Демиденко [и др.]. — Донецк: ГИК «Новая печать»: ООО «Лебедь», 2001.
10.Химическая технология неорганических веществ: учеб. пособие: в 2 т. / под ред. Т. Г. Ахметова. — М.: Высш. школа, 2002. -Т. 1, 2.
Размещено на Allbest.ru
Подобные документы
Общая характеристика минеральных удобрений. Технологическая схема производства аммиачной селитры на ОАО «Акрон». Составление материального и теплового баланса. Определение температуры проведения процесса, конечной концентрации селитры; свойства продукции.
отчет по практике [205,2 K], добавлен 30.08.2015
Характеристика исходного сырья, методы и технологическая схема производства аммиачной селитры; физико-химические свойства, технические требования к готовой продукции, ее применение. Основная аппаратура узла для выпаривания растворов аммиачной селитры.
курсовая работа [4,3 M], добавлен 11.10.2011
Производство аммиачной селитры. Промышленное получение азотной кислоты. Аммиак как ключевой продукт различных азотсодержащих веществ, применяемых в промышленности и сельском хозяйстве. Процесс его синтеза. Физико-химические свойства аммиачной селитры.
реферат [206,5 K], добавлен 26.06.2009
Понятие редкоземельных элементов. Их физические и химические свойства. Экстракция легких РЗЭ в присутствии азотной кислоты, аммиачной селитры и трибутилфосфата. Определение термодинамических констант и параметров неидеальности экстрагируемых комплексов.
дипломная работа [2,6 M], добавлен 29.08.2015
Понятие нитратов (солей азотной кислоты) и их химические свойства. Основное применение нитратов: удобрения (селитры) и взрывчатые вещества (аммониты). Биологическая роль солей азотной кислоты. Описание органических нитратов и нитритов. Свойства аммония.
презентация [6,2 M], добавлен 14.03.2014
Состав и свойства основных азотных удобрений. Калийные удобрения, их характеристика. Верховой, низинный и переходный торф. Значение производства минеральных удобрений в экономике страны. Технологический процесс производства. Охрана окружающей среды.
курсовая работа [143,2 K], добавлен 16.12.2015
Физические и физико-химические свойства азотной кислоты. Сырье для производства азотной кислоты. Характеристика целевого продукта. Процесс производства слабой (разбавленной) и концентрированной азотной кислоты. Действие на организм и ее применение.
презентация [1,6 M], добавлен 05.12.2013
Источник