Разложение фосфатного сырья и получение фосфорных удобрений



Природные фосфаты (апатиты, фосфориты) используют в основном для получения минеральных удобрений. Качество полученных фосфорных соединений оценивают по содержанию в них Р2О5 — общего, растворимого в воде, аммиачном растворе цитрата аммония (цитратнорастворимого).
Существует ряд методов переработки природных фосфатов: механические, термические и методы кислотного разложения.
Одним из методов механической обработки является измельчение фосфатов. Полученная фосфоритная мука при использовании в кислых почвах очень медленно растворяется в почвенных водах и таким образом становится долговременно действующим удобрением.
Фосфорные удобрения могут быть получены термическим разложением фосфатов при температурах 1200—1800ºС. Так. получают термофосфаты, обесфторенные фосфаты, плавленые магниевые и термощелочные фосфаты.
Однако основным методом получения фосфорных удобрений является химическое разложение фосфатного сырья минеральными кислотами, чаще всего серной. В результате сернокислотной переработки получают простой суперфосфат и фосфорную кислоту, которую, в свою очередь, перерабатывают в двойной суперфосфат, преципитат и сложные удобрения.
Производство простого суперфосфата. Сущность производства простого суперфосфата состоит в превращении природного фторапатита, нерастворимого в воде и почвенных растворах, в растворимые соединения, преимущественно в монокалыдийфос-фатСа(Н2Р04)2.
Процесс разложения может быть представлен следующим суммарным уравнением:
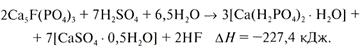
В процессе производства простого суперфосфата разложение протекает в две стадии. На первой стадии примерно 70% апатита реагирует с серной кислотой. Образуются фосфорная кислота и полугидрат сульфата кальция:
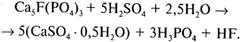
Эта стадия представляет собой химическое растворение, осложненное осаждением на зернах фосфата плотных или сравнительно рыхлых пористых корок сульфата кальция. Плотные корки сильно затрудняют диффузию жидкой фазы к поверхности фосфата и реакция замедляется; рыхлые корки замедляют реакцию в меньшей степени. Структура образующейся корки обусловлена скоростью кристаллизации твердой фазы, зависящей главным образом от пересыщения раствора сульфатом кальция, которое определяется, в свою очередь, концентрацией серной кислоты, температурой и другими факторами.
Выкристаллизовавшиеся микрокристаллы сульфата кальция образуют структурную сетку, удерживающую большое количество жидкой фазы, и суперфосфатная масса затвердевает (схватывается). Первая стадия процесса разложения начинается сразу после смешения реагентов и заканчивается в течение 20—40 мин в суперфосфатных камерах.
После полного израсходования серной кислоты начинается вторая стадия разложения, в которой оставшийся апатит (30%) разлагается фосфорной кислотой:
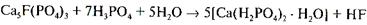
Образующийся монокальцийфосфат в отличие от сульфата кальция не сразу выпадает в осадок. Он постепенно насыщает раствор фосфорной кислоты, после чего начинает выкристаллизовываться в виде Са(Н3РО4)2 • Н2О. Реакция (VI) протекает значительно медленнее, чем реакция (V), что объясняется низкой активностью фосфорной кислоты и кристаллизацией твердых фаз. Она начинается в суперфосфатных камерах и длится еще в течение 5—20 сут. хранения суперфосфата на складе. После дозревания на складе разложение фторапатита считают законченным.
Производство двойного суперфосфата. Двойной суперфосфат — концентрированное фосфорное удобрение, получаемое разложением природных фосфатов фосфорной кислотой. Он содержит 42—50% усвояемого Р2О5, в том числе в водорастворимой форме 27—42% Р2О5 т. е. в 2—3 раза больше, чем простой.
По внешнему виду и фазовому составу двойной суперфосфат похож на простой суперфосфат. Однако он почти не содержит балласта — сульфата кальция.
При разложении природных фосфатов фосфорной кислотой протекает реакция (VI), совпадающая со второй стадией производства простого суперфосфата. Фосфорную кислоту для проведения этой реакции предварительно получают также из фосфатного сырья, например его разложением концентрированной серной кислотой (экстракционная фосфорная кислота), либо высокотемпературным восстановлением элементного фосфора с последующим его окислением и гидратацией (термическая фосфорная кислота).
Двойной суперфосфат можно получать по схеме, аналогичной схеме производства простого суперфосфата. Такой метод называется камерным. Его недостатками являются длительное складское дозревание продукта, сопровождающееся неорганизованными выделениями вредных соединений фтора в атмосферу, и необходимость применения концентрированной фосфорной кислоты.
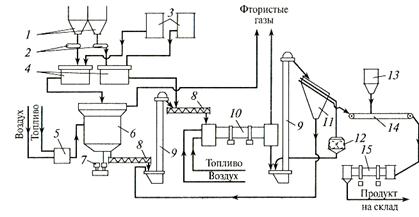
Рис. 3.Схема производства гранулированного двойного суперфосфата из фосфоритной муки и неупаренной экстракционной фосфорной кислоты:
/ — бункер для фосфоритной муки; 2 — весовой дозатор; 3 — напорный бак для фосфорной кислоты; 4 — реактор; 5— топка; 6— распылительная сушилка; 7 — привод гребка; 8 — шнек; 9 — элеватор; 10 — барабанная сушилка; 11 — грохот; 12 — дробилка; 13 — бункер молотого мела; 14 — ленточный транспортер; /5 — барабанный нейтрализатор
Более прогрессивным и экологичным является поточный метод производства двойного суперфосфата. В нем используют для разложения сырья более дешевую неупаренную фосфорную кислоту (рис.3). Метод является полностью непрерывным (отсутствует стадия длительного складского дозревания продукта).
В реакторы 4 подают фосфоритную муку и фосфорную кислоту. В течение примерно 1 ч при 70—90 °С происходит разложение фосфоритов на 55—60%. Вытекающую из реакторов пульпу разделяют на два потока. Часть ее (около половины) высушивают топочными газами в распылительной сушилке. Высушенный мелкозернистый материал подвергают гранулированию. Для этого его смешивают в шнековом смесителе-грануляторе 8 со второй частью пульпы. Сюда же подают небольшое количество ретура. Затем гранулы, содержащие 20—22% влаги, высушивают в прямоточной барабанной сушилке 10 до влажности 3—4%.
В процессе сушки разложение исходного сырья продолжается и общая степень разложения сырья увеличивается до 80—90%.
Источник
Получение фосфорных удобрений реакции
Простые фосфорные удобрения – это кальциевые соли фосфорной (ортофосфорной) кислоты различного состава. В отличии от калийных и азотных удобрений фосфорные удобрения обладают различной растворимостью, которая зависит от природы соли. По растворимости фосфорные удобрения подразделяются на: водорастворимые (группа I), растворимые в органических кислотах или усвояемые (группа II), нерастворимые или растворимые только в сильных минеральных кислотах (группа III).
По содержанию питательного элемента фосфорные удобрения делятся на концентрированные (более 30% P2O5) и неконцентрированные (менее 30% P2O5). В таблице 12.1 приведены характеристики и удельный вес в общем балансе производства основных фосфорных удобрений.
Таблица 12.1 — Ассортимент и характеристики фосфорных удобрений
Формула действующего вещества
Удельный вес по годам, %
Изданных табл. 12.1 следует, что ассортимент фосфорных удобрений существенно меняется. Резко снижается производство низкоконцентрированных удобрений (фосфоритная мука, шлаки, простой суперфосфат), после некоторого роста наметилась тенденция снижения производства двойного суперфосфата. Это можно объяснить существенным увеличением объема производства комплексных (многосторонних) удобрений, содержащих фосфор.
Сырьем для производства фосфорных удобрений, фосфорной кислоты и элементарного фосфора служат природные фосфатные руды: апатиты и фосфориты. Основным фосфорсодержащим компонентом в них являются двойные соли трикальцийфосфата состава 3Ca3(PO4)2 · CaX2, где Х = F, OH, Cl. В соответствии с этим различают фторапатиты (Х = F) и гидроксилапатиты (Х = OH).
Апатиты представляют собой породы вулканического происхождения, имеют крупнозернистую структуру и, помимо фтор(гидроксил)апатита, содержат нефосфатные минералы, основным из которых является нефелин состава Na2O(K2O) · Al2O3 · 2SiO2. Поэтому для производства фосфорных удобрений используется продукт предварительного обогащения апатитовых руд – апатитовый концентрат, содержащий до 40% P2O5, выход которого составляет около 20% от массы апатитово-нефелиновой руды.
Фосфориты – руды осадочного происхождения, высокодисперсны и содержат фосфор в виде фторапатита и апатитоподобных минералов переменного состава. Содержание фосфора в фосфоритах колеблется от 16 до 30% P2O5.
Методы переработки фосфатного сырья существенно зависят от состава руды и могут быть механическими и химическими. Механической обработкой (измельчением) получают простейшие фосфорные удобрения – фосфоритную муку и металлургические шлаки. Задачей химической переработки природных фосфатов в фосфорные удобрения является превращение нерастворимого трикальцийфосфата (ТКФ) в такие соединения фосфора, которые легко усваиваются растениями и являются высококонцентрированными, то есть содержат возможно больше P2O5 в усвояемой форме при минимальном количестве балласта и вредных примесей.
Химическая переработка природных фосфатов может быть осуществлена тремя методами: химическим разложением, восстановлением углеродом и термической обработкой. Наиболее распространенный метод переработки фосфатного сырья – его разложение серной, фосфорной или азотной кислотами, используемое в промышленных масштабах для производства фосфорных удобрений, фосфорной кислоты, фосфора и комплексных удобрений на основе соединений фосфора (рис.12.1).
Рисунок 12.1 — Схема кислотной переработки фосфатного сырья
В результате кислотной обработки нейтральный ТКФ последовательно превращается в гидрофосфат и дигидрофосфат кальция, что сопровождается переходом соли из III группы растворимости во II и в I и повышением содержания в ней P2O5 (табл. 12.2)
Таблица 12.2 — Свойства фосфатов кальция
Гидро-фосфат кальция CaHPO4
pH Ортофосфорная кислота представляет собой бесцветные кристаллы с температурой плавления 42,4ºС, гигроскопичные и расплывающиеся на воздухе. В переохлажденном состоянии – это густая маслянистая жидкость плотностью 1,88 т/м 3 . Смешивается с водой во всех отношениях. При нагревании подвергается дегидратации с образованием полифосфорных кислот различного состава (P2O5 · nH2O), где n 3 и температуру затвердевания 3 — 8ºС. Высокое содержание P2O5 и способность образовывать растворимые комплексные соединения позволяет использовать суперфосфорную кислоту для получения высококонцентрированных жидких и твердых фосфорных удобрений.
Физико-химические основы процесса. Экстракционный метод производства фосфорной кислоты основан на реакции разложения природных фосфатов серной кислотой. Процесс состоит из двух стадий: разложения фосфатов и фильтрования образовавшейся фосфорной кислоты и промывки сульфата кальция водой.
Сернокислотное разложение фосфата кальция представляет гетерогенный необратимый процесс, протекающий в системе «твердое тело – жидкость» и описываемый уравнением
Для удобства записи и упрощения расчетов формула двойной соли фторапатита 3Ca3(PO4)2 · CaF2 записывается в виде Ca5(PO4)3F.
Часть образовавшейся фосфорной кислоты возвращается в процесс. Фактически фосфат разлагается смесью серной и фосфорной кислот. В зависимости от концентрации фосфорной кислоты в системе и температуры образующийся сульфат кальция может осаждаться в виде ангидрита (m = 0), полугидрата (m = 0,5) и дигидрата (m = 2). В соответствии с этим различают три варианта экстракционного метода производства фосфорной кислоты: ангидритный, полугидратный и дигидратный.
В табл. 12.3 приведены условия разложения фторапатита для каждого из вариантов этого процесса.
Температурный режим зависит от варианта экстракционного процесса. В дигидратном методе гидратированный сульфат кальция осаждается в форме дигидрата при 70 – 80ºС и концентрации кислоты в реакционной смеси 20 – 32% P2O5, в полугидратном методе – в форме полугидрата при 90 -100ºС и концентрации кислоты 35 – 42%. На рисунке 12.3 показана зависимость формы кристаллизации сульфата кальция от температуры и
Рисунок 12.3 — Влияние температуры и концентрации кислоты на форму кристаллизации сульфата кальция
концентрации фосфорной кислоты (P2O5). В области ниже кривой 2 сульфат кальция кристаллизируется в виде дигидрата, выше кривой 1 — в виде ангидрита, в области между кривыми 1 и 2 — в виде полугидрата.
Таблица 12.3 — Условия разложения фторапатита
Концентрация P2O5 в жидкой фазе, %
Теплота реакции, кДж/моль
Выделяющийся при кислотном разложении фторапатита фтористый водород частично поступает в атмосферу, а частично вступает в реакцию с кремниевой кислотой, образующейся при разложении примесей, содержащихся в фосфатном сырье:
Образовавшаяся кремнефтористоводородная кислота частично разлагается, и в газовую фазу выделяется тетрафторсилан
Одновременно протекает реакция взаимодействия тетрафторсилана с фтористым водородом с образованием кремнефтористоводородной кислоты
Выделение фтористых соединений в газовую фазу возрастает с повышением температуры.
Скорость кислотного разложения фторапатита возрастает с повышением температуры, степени измельчения сырья и интенсивности перемешивания реагентов.
Рисунок 12.4 — Зависимость степени разложения фосфата от концентрации кислоты
Существенное влияние на скорость процесса кислотного разложения фосфатов оказывает концентрация серной кислоты. От нее зависит не только скорость химической реакции, но и структура кристалличес-кого сульфата кальция, осаждающегося на повер- хности частиц фосфата и скорость диффузии кислоты к твердой фазе.
При низкой концентрации кислоты образуются крупные кристаллы, не препятствующие диффузии. При высокой концентрации кислоты в результате пресыщения жидкой фазы сульфатом кальция выпадают мелкие кристаллы, препятствующие диффузии кислоты и замедляющие скорость процесса. Поэтому зависимость скорости и степени разложения от начальной концентрации серной кислоты имеет сложный характер (рис.12.4).
Скорость и степень разложения фосфата кислотной низкой концентрации (максимум 1) достаточно высоки. Однако большое количество воды, вводимой с кислотой, затрудняет кристаллизацию продукта. Максимум 2, также отвечающий высокой скорости разложения, достигается при концентрации кислоты в реакционной системе 5 – 10%, что соответствует концентрации исходной кислоты около 60% при соотношении жидкой и твердой фаз 3:1, которое обеспечивает необходимую подвижность пульпы.
Высокая степень разложения фосфатов, равная 0,99 дол.ед., достигается всего за 1 – 1,5 часа. Практически процесс экстракции продолжается 4 – 8 часов. Это необходимо для образования крупных кристаллов сульфата кальция, которые легко фильтруются и промываются для извлечения фосфорной кислоты небольшим количеством воды. Образованию крупных кристаллов способствует также перемешивание системы, незначительный избыток серной кислоты, снижающий степень пресыщения раствора и постоянство температуры процесса.
Принципиальная и технологическая схемы производства. Принципиальные схемы производства экстракционной фосфорной кислоты дигидратным и полугидратным методами идентичны. Однако полугидратный метод позволяет получать более концентрированную кислоту (см. табл.12.3), снизить потери сырья и обеспечить более высокие интенсивность и производительность аппаратуры. Принципиальная схема производства экстракционной фосфорной кислоты одностадийным полугидратным методом приведена на рис. 12.5. На рис..12.6 представлена технологическая схема того же процесса.
Рисунок 12.5 — Принципиальная схема производства экстракционной фосфорной кислоты
Смесь серной кислоты и оборотного раствора фосфорной кислоты из сборника 2 и фосфат из бункера 1 подают в многосекционный экстрактор 3. По мере движения пульпы в экстракторе образуется фосфорная кислота и завершается процесс кристаллизации сульфата кальция. Из последней секции экстрактора пульпа поступает на трехсекционный вакуум-фильтр 4. Основной фильтрат Ф-1 из первой секции фильтра отводится как продукционная фосфорная кислота, причем часть ее добавляется к оборотному раствору, направляемому в сборник кислоты 2. Осадок сульфита кальция на фильтре промывается противотоком горячей водой, при этом промывной раствор Ф-3 используется для первой промывки во второй секции фильтра. Фильтрат первой промывки Ф-2 направляется в виде оборотного раствора в сборник 2. Образовавшаяся фосфорная кислота (Ф-1) подогревается в подогревателе 5 паром и поступает в концентратор 6, где упаривается до заданной концентрации за счет прямого контакта с топочными газами и направляется на склад. Выделяющиеся из концентратора газы проходят промывной скруббер 7, в котором улавливаются соединения фтора и выбрасываются в атмосферу. Газы, выделяющиеся из экстрактора и содержащие фтористый водород и тетрафторсилан, поступают на абсорбцию в абсорбер, орошаемый водой или разбавленной кремнефтористоводородной кислотой.
Рисунок 12.6 — Технологическая схема производства экстракционной фосфорной кислоты полугидратным методом: 1 – бункер фосфата; 2 – сборник серной кислоты; 3 – экстрактор; 4- вакуум-фильтр; 5 – подогреватель фосфорной кислоты; 6 – концентратор; 7 – промывной скруббер; 8 – сборник промывной жидкости
Основные аппараты в производстве экстракционной кислоты – экстрактор и вакуум-фильтр. Экстрактор – это железобетонный аппарат прямоугольного сечения, разделенный на 10 секций с мешалками, в котором пульпа последовательно перетекает из одной секции в другую. В другом варианте экстрактор составляет два сблокированных стальных экстрактора 730 м 3 , производительность его равна 340 т/сутки P2O5 при интенсивности около 25 кг/м 3 ·ч.
12.3. Производство двойного суперфосфата
Двойной суперфосфат — концентрированное безбалластное простое фосфорное удобрение, получаемое разложением природных фосфатов фосфорной кислотой. Он представляет твердый гигроскопичный продукт серого цвета и выпускается в гранулированном виде. В отличие от простого суперфосфата не содержит балласта – сульфата кальция (СаSO4) и поэтому, обладая той же агрохимической активностью, имеет большую концентрацию фосфорсодержащего компонента. Двойной суперфосфат содержит 45 – 51% общего P2O5, в том числе 42 – 49% в усвояемой форме в виде водорастворимых соединений (H3PO4)2; Ca(H2PO4)2; Mg(H2PO4)2; и цитратно-растворимых соединений (CaHPO4;Mg HPO4; фосфаты железа).
Физико-химические основы процесса. Разложение природных фосфатов фосфорной кислотой представляет гетерогенный необратимый процесс, протекающий по уравнению
В этом процессе фосфорная кислота является не только реагентом кислотного разложения, но и носителем фосфора, что обеспечивает получение продукта с высоким содержанием усвояемого Р2О5.
Процесс взаимодействия фосфорной кислоты с трикальцийфосфатом протекает в две стадии. На первой стадии компоненты реагируют в подвижной суспензии, жидкая фаза которой содержит фосфорную кислоту, монокальцийфосфат и другие растворимые продукты реакции. Эта стадия, идущая сначала с высокой скоростью, замедляется по мере нейтрализации кислоты и заканчивается при насыщении жидкой фазы фосфатами кальция. Продолжительность этой стадии зависит от организации технологического процесса и типа аппаратуры и колеблется от секунд до нескольких часов.
На второй стадии происходит кристаллизация монокальцийфосфата (дигидрофосфата кальция), приводящая к изменению состава жидкой и твердой фаз реакционной смеси. Выделение кристаллов, отлагающихся на частицах фосфата, затрудняет доступ к ним ионов H + , процесс разложения фосфата резко замедляется и, когда жидкая фаза насыщается дигидрофосфатом и моногидрофосфатом кальция, процесс прекращается.
Скорость растворения фосфатов в растворах фосфорной кислоты, не насыщенных продуктами реакции, лимитируется скоростью диффузии ионов кальция Ca 2+ от частиц фосфата в жидкую фазу. Поэтому высокая степень разложения фосфата на первой стадии может быть достигнута лишь при определенной концентрации фосфорной кислоты, равной 30 -40% Р2О5. На второй стадии, которая является определяющей для процесса разложения фосфата в целом, наибольшая скорость разложения достигается в растворах, содержащих около 45% Р2О5. С учетом этих требований выбирается технологический режим производства суперфосфата.
Так, например, в бескамерном методе сырье обрабатывается при 50 – 100ºС фосфорной кислотой концентрацией 28 – 40% Р2О5, что отвечает оптимальным условиям первой стадии. Так как при этой концентрации кислоты вторая стадия процесса практически не идет, то процесс завершают при сушке реакционной массы, когда вследствие испарения воды повышается ее активность.
Технологическая схема производства. В производстве двойного суперфосфата используются три метода, различающиеся аппаратурным оформлением, концентрацией использованной фосфорной кислоты и температурным режимом процесса.
- Камерный метод с использованием суперфосфатных камер непрерывного действия и выдерживанием продукта для созревания на складе. Для разложения фосфатов используют термическую или экстракционную кислоту концентрацией 50 – 58% P2O5 при избытке 110% от стехиометрического количества. Степень разложения фосфата 0,75 – 0,80 д.ед.
- Камерно-поточный метод с использованием аналогичных камер, но без операции складского созревания. Для разложения фосфатов используется экстракционная кислота концентрацией 47 – 49%, взятая в стехиометрическом отношении. Степень разложения не выше 0,7 дол.ед.
- Поточный (бескамерный) метод с использованием неупаренной кислоты концентрацией 30% P2O5 при степени разложения фосфата до 0,55 дол.ед. В отличие от предыдущих методов здесь разложение сырья осуществляют в две ступени. Первую стадию процесса проводят в реакторах до степени разложения 0,5 дол. ед. Дальнейшее разложение протекает при высокой температуре в сушилках различного типа: распылительных (РС), барабанных грануляторах-сушилках (БГС), распылительных сушилках-грануляторах кипящего слоя (РКСГ). Наиболее распространены схемы с использованием аппаратов БГС, конструкция которых непрерывно совершенствуется. На рисунке 12.7 представлена технологическая схема производства двойного суперфосфата поточным методом с аппаратом БГС производительностью 180 тыс. тонн в год.
Рисунок 12.7 — Технологическая схема производства двойного суперфосфата поточным методом: 1 – бункер фосфата; 2 – сборник фосфорной кислоты; 3 – реактор I ступени; 4 – реактор II ступени; 5 – аппарат БГС; 6 – топка; 7,8 – грохоты; 9 – дробилка; 10 – барабан-аммонизатор; 11 – холодильник «КС»; 12, 13 – циклон
Измельченный фосфат из бункера 1 и фосфорная кислота из сборника 2 подают в реактор I ступени 3. Из него реакционная пульпа перетекает в реактор II ступени 4. В оба реактора подают острый пар, обеспечивающий температуру реакционной массы 90 – 100ºС. Из реактора II ступени пульпа поступает в аппарат БГС 5, где происходят завершающая стадия разложения фосфорита, сушка и грануляция пульпы. В аппарат БГС подается также ретур – тонко измельченный двойной суперфосфат после отделения товарного продукта. Отношение масс ретура и готового суперфосфата равно 3:1. Пульпа, поступающая в аппарат БГС, разбрызгивается форсунками и наслаивается на частицы ретура, образуя гранулы, которые высушиваются при 700ºС топочными газами, поступающими в аппарат из топки 6. Сухой продукт направляется на грохоты 7 и 8, где его разделяют на три фракции. Крупную фракцию после измельчения в дробилке 9 смешивают с мелкой фракцией, прошедшей через грохот 8, и пылью из циклонов 12 и 13 и в виде ретура возвращают в аппарат БГС. Товарную фракцию суперфосфата, прошедшую через грохот 7, с размерами гранул 1 – 4 мм направляют в барабан-аммонизатор 10, где остаточная фосфорная кислота нейтрализуется аммиаком. Из аммонизатора она попадает в холодильник кипящего слоя 11 и затем на склад. Выделяющиеся из аппарата БГС фторсодержащие газы очищаются от пыли в циклоне 12 и направляются на абсорбцию водой, после чего выбрасываются в атмосферу.
Основным аппаратом в поточной схеме является барабанная гранулятор-сушилка , представляющая барабан диаметром 4,5 м и длинной до 35 м, установленный под углом 3º и вращающийся с частотой 4 об/м. Барабан содержит внутри лопастную насадку переменной конфигурации, с помощью которой при вращении барабана создается завеса частиц суперфосфата, ссыпающегося с полок. Теплоноситель (топочные газы) и поток суспензии суперфосфата подаются по оси аппарата, что уменьшает нагрев его стенок и позволяет применять топочные газы, нагретые до 950ºС. Производительность аппарата БГС составляет 40 т/час.
Расходные коэффициенты на 1 т усвояемого Р2O5 составляют:
- фосфорит 0,28 – 0,29 т;
- экстракционная фосфорная кислота 0,80 – 0,83 т.
Себестоимость продукта в поточном и камерном методах практически одинакова. При этом себестоимость Р2O5 в них на 20% выше, чем в производстве простого суперфосфата. Однако, это компенсируется экономией при транспортировке, хранении и внесении в почву более концентрированного удобрения, каким является двойной суперфосфат.
Пример решения задачи
Составить материальный баланс фильтрации экстракционной пульпы, полученной из серной кислоты с массовой долей ω% и апатитового концентрата, содержащего g % P2O5, e % CaO, f % фтора.
Концентрация продукционной фосфорной кислоты а % P2O5, коэффициент разложения апатита b % содержания жидкой фазы в отбросном промытом фосфогипсе с %, отношение ж/т в пульпе 3:1.
Степень выделения фтора в газовую фазу d % от содержания его в сырье. В процессе экстракции испаряется 262 кг H2O на 1 т апатита. Фильтрация осуществляется на карусельном вакуум фильтре с 4–мя зонами фильтрации (одна основная и три промывные). Влажность отмытого гипса по зонам:
Расчет составляем на 1000 кг апатитового концентрата по основным стадиям процесса.
Исходные данные
а = 32% b = 98% c = 40% d = 20% ω = 93 % g = 39,4% e = 52% f = 3 %
Решение
1) Основная фильтрация
Приход
Масса поступающей на фильтрацию пульпы
Gп = 100 • Gч (Ж+Т) = 1,6 • 100(3+1) = 6400 кг
где Gч – гипсовое число; Gч = 1,6
Расход
Выход продукционной фосфорной кислоты
где МH3PO4 – молярная масса фосфорной кислоты, 98 кг/кмоль.
Масса фосфогипса после первой фильтрации:
Гипс Gч • 1000 = 1,6 • 1000 = 1600
Жидкая фаза 3333,3 – 1600 = 1733,3
Масса оборотной кислоты
Gоб.к. = Gч • 1000 • Ж – (Gпрод + 1733,3) = 1600 • 3 – (1182,5 + 1733,3) = 1884,2 кг
Материальный баланс основной фильтрации
| Приход | кг | Расход | кг |
| Пульпа | 6400 | Продукционная фосфорная кислота | 1182,5 |
| Оборотная фосфорная кислота | 1884,2 | ||
| Фосфогипс | 3333,3 | ||
| Всего | 6400 | 6400 |
2) Первая промывка
Приход
Масса фосфогипса, поступающая с основной фильтрации – 3333,3 кг
Масса первого фильтрата
Gф1 = Gпрод + Gоб.к = 1182,5 + 1884,2 = 3066,7 кг
Масса раствора разбавления
где МSiF4 – молярная масса SiF4, кг/моль
n – число атомов фтора в молекуле SiF4
АfF– атомная маса фтора, кг/моль.
Масса второго фильтрата, направляемого в экстрактор
Масса третьего фильтрата, используемого для первой промывки фосфогипса
Расход
Масса второго фильтрата Gф2 составляет 2807,5 кг
Фосфогипса после первой промывки при влажности а2 = 50% получается
Материальный баланс первой промывки
| Приход | кг | Расход | кг |
| Фосфогипс | 3333,3 | Второй фильтрат | 2807,5 |
| Третий фильтрат | 2674,2 | Фосфогипс | 3200 |
| Всего | 6007,5 | 6007,5 |
3) Вторая промывка
Приход
Масса поступающего на промывку фосфогипса с влажностью а2 = 50%, составляет 3200 кг
Масса четвертого фильтрата, используемого для второй промывки фосфогипса
Расход
Масса третьего фильтрата, полученного после второй промывки фосфогипса, составляет 2674,2 кг.
Масса фосфогипса после второй промывки:
Материальный баланс второй промывки
| Приход | кг | Расход | кг |
| Фосфогипс | 3200 | Третий фильтрат | 2674,2 |
| Четвертый фильтрат | 2383,3 | Фосфогипс | 2909,1 |
| Всего | 5583,3 | 5583,3 |
4) Третья промывка
Приход
Масса фосфогипса, поступающего на третью промывку, составляет 2909,1 кг.
Масса воды на 1000 кг апатита, направляемой на промывку фосфогипса
где [TEX]Gгаз=\frac<1000\cdot f\cdot d\cdot MSiF4>
[TEX]Gкисл=\frac<1,75\cdot е\cdot 1000> <0,93>= \frac<1,75\cdot 0,52\cdot 1000><0,93>=978,5 кг [/TEX]– расход 93% серной кислоты на 1000 кг апатитового концентрата
Расход
Масса отбросного фосфогипса
Масса четвертого фильтрата составляет 2383,3 кг
Материальный баланс третьей промывки
Источник