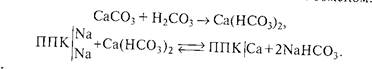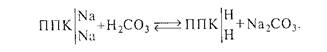ЩЕЛОЧНОСТЬ ПОЧВ
Щёлочность почв – способность почв нейтрализовать компоненты кислой природы и подщелачивать воду. Различают актуальную и потенциальную формы шелочности.
Актуальная щелочность. Актуальная щелочность связана с наличием в почвенном растворе гидролитически щелочных солей, при диссоциации которых образуется гидроксильный нон:
Определенное значение в формировании щелочности почв имеют анионы слабых кислот. Практически все анионы слабых кислот, присутствующие в почвенном растворе, могут участвовать в формировании щёлочности почвы, образуя сопряженные кислотно-основные пары.
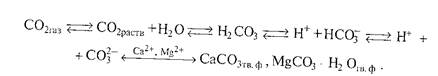
Реальный вклад того или иного соединения в щёлочность почвы определяется не только величиной константы основности, но и концентрацией ионов в почвенных растворах. Обычно при характеристике актуальной щёлочности природных вод, водных вытяжек и почвенных растворов выделяют общую щелочность, щёлочность от нормальных карбонатов и щелочность от гидрокарбонатов, которые отличаются по граничным значениям рН. Их определяют путем титрования вытяжки кислотой в присутствии различных индикаторов. Результаты выражают в мг-экв/100 г почвы. Щёлочность от нормальных карбонатов обусловлена присутствием Na2CO3, СаСО3, МgСОз. Щёлочность от гидрокарбонатов связана с NaНСО3 и Са(НСО3)2. В большинстве почв с щелочной реакцией преобладают карбонаты, которые и обусловливают соответствующую реакцию среды. В связи с этим выделяют карбонатно—кальциевую систему и карбонатно-кальциевое равновесие. Карбонатно-кальциевая система включает СаС03 твердой фазы, ионы в ППК, ноны почвенного раствора: Са 2+ , Са НСО3 + , CO3 2- ОН — , Н + , Н2С03, а также СО2 почвенного раствора, находящегося в равновесии с СО2 почвенного воздуха. Эта система очень подвижная и включает несколько равновесий:
При уменьшении парциального давления СО2 равновесие сдвигается в сторону образования СО-групп. В этом случае образуется труднорастворимое соединение СаСО3, выпадающее в осадок, и увеличивается рН почвенного раствора, так как СО является более сильным акцептором протонов, чем НСО3 — , и в большей степени подщелачивает среду. В итоге на фоне увеличения рН величина карбонатной щелочности снижается. Увеличение парциального давления СО2 приводит к уменьшению рН и росту карбонатной щелочности в результате увеличения раствори-
мости СаСО3.
Расчеты показывают, что рН раствора, находящегося в равновесии с СаС03 твердой фазы и СО2 атмосферы, имеет значение 8,2-8,3. Когда же свободный доступ СО2 затруднен, значения рН достигают 9,8-10,0.
Потенциальная щелочность обусловлена наличием в ППК обменно-поглощённого иона натрия, который при определенных условиях может переходить в почвенный раствор с образованием карбонатов и гидрокарбонатов, вызывая его подщелачивание. Например, при образовании угольной кислоты вследствие дыхания растений и разложения органических остатков происходит переход карбоната кальция в более растворимый гидрокарбонат с последующим ионном обменом:
Угольная кислота может непосредственно взаимодействовать с поглощающим комплексом почв, содержащих обменный натрий, с образованием соды (карбоната натрия):
Почвы с щелочной реакцией среды формируются в регионах с дефицитом атмосферных осадков, где ограничен вынос из почв и почвообразующих пород продуктов выветривания и почвообразования. Щелочная реакция среды типична для каштановых и светло-каштановых, бурых полупустынных и серо-бурых пустынных почв, сероземов карбонатных разностей черноземов и темно-каштановых почв, особенно высокой щёлочностью отличаются содовые солонцы и солончаки.
Высокая щелочность почв неблагоприятна для большинства сельскохозяйственных культур. В условиях щелочной среды в растениях нарушается обмен веществ, снижается растворимость и доступность фосфатов, соединений железа, меди, марганца, бора и цинка. При щелочной реакции в почвенном растворе появляются токсичные для растений вещества, в частности сода и алюминаты натрия. В случае резкого повышения рН корневые волоски растений испытывают щелочной ожог, что негативно отражается на их дальнейшем развитии и может привести к отмиранию. сильнощелочные почвы характеризуются ярко выраженными отрицательными агрофизическими свойствами, что связано с сильной пептизацией почвенных коллоидов и растворением гумусовых веществ. Такие почвы оструктуриваются, приобретают высокую липкость во влажном состоянии и твердость в сухом, отличаются плохой фильтрацией и неудовлетворительным режимом. Сильнощелочные почвы малоплодородны.
Эффективный прием повышения плодородия почв с щелочной реакцией — химическая мелиорация. В качестве мелиоранта широко применяют гипс и различные вещества.
При внесении гипса в щелочные почвы происходит, с одной стороны, нейтрализация солью почвенного раствора, с другой — вытеснение обменного натрия из ППК:
После гипсования содовых почв, а также в натурных карбонатных почвах реакция среды будет находиться на уровне, определяемом наличием СаСОз и МgCОз (рН 8,2-8,6). При необходимости дальнейшего снижения рН применяют кислые мелиорирующие вещества, в частности серную кислоту. Кислование содовых почв высокоэффективный прием. При кисловании происходит не только полная нейтрализация щелочности, но и вытеснение натрия из ППК:
Важное условие эффективного проведения химической мелиорации щелочных почв — удаление продуктов нейтрализации и обменных реакций, чаще всего сернокислого натрия. Хотя сульфат натрия менее вреден для растений, чем, например, сода, его присутствие в почве все же нежелательно. Кроме того, возможно обратное поглощение натрия ППК почвы. Для удаления легкорастворимых солей натрия, образующихся при химической мелиорации, применяют промывки почв.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Научная электронная библиотека
11. Природа почвенной кислотности и щелочности
Реакция среды имеет существенное значение для направления почвенных процессов, зависит от типа почв, количества осадков, ее измеряют величиной рН. Изменение реакции среды – лимитирующий фактор процессов почвообразования.
Кислотность почв – способность почв нейтрализовать растворы с щелочной реакцией и подкислять воду и растворы нейтральных солей (Роде, 1975).
Актуальная кислотность (активная) – кислотность почвенного раствора, суспензии или водной вытяжки почв, обусловленная наличием водорода, концентрация ионов Н+ растворе в г-экв (моль) на 1 литр, выраженная рН. Условия жизни оптимальны при рН от 2,5–3 до 10–10,5.
Потенциальная кислотность (пассивная) – кислотность твердой фазы почвы, обусловлена катионами водорода, находящимися в поглощенном состоянии или появляющимися в результате гидролиза. Ее подразделяют на обменную и гидролитическую.
Обменная потенциальная кислотность – обусловлена наличием в почвенно-поглощающем комплексе ионов водорода и алюминия, способных к замещению, проявляется при взаимодействии с почвой электронейтральных солей, например, КСI. При взаимодействии почв с нейтральной солью не все протоны переходят в раствор, в системе устанавливается динамическое равновесие:
ПК]Н + КСI → ППК]К +НСI
Гидролитическая потенциальная кислотность – обусловлена наличием в почвенно поглощающем комплексе ионов водорода, способных к замещению:
ППК]Н + СН3СОО Nа → ППК]Nа + СН3СООН
Щелочность – способность почвы проявлять свойство оснований. Создается за счет солей слабых кислот, образующих при гидролизе слабо диссоциирующие молекулы.
Nа2CO3 + Н2O→ 2Na + 2ОН +Н2СО3
А. А. Роде (1975) выделяет щелочность карбонатную, бескарбонатную и общую (наличие в водной вытяжке соответственно карбонат и бикарбонат ионов отдельно и в совокупности).
Актуальная щелочность обусловливает присутствие в почве карбонатов и бикарбонатов кальция, магния, натрия, которые увеличивают рН.
Потенциальная щелочность характерна для солонцеватых почв, содержащих обменный натрий:
ППК]2Nа + Н2СО3→ ППК]2Н + Nа2СО3
Для ее устранения используют гипсование, серную кислоту, железный купорос. Гипсование – вытеснение натрия. Сульфаты удаляют промывками
ППК]2Nа + СаSO4 → ППК]Са + Na2SO4
Буферность – способность почвы противостоять изменению реакции среды.
Экологическое значение кислотности и щелочности почв (по Валькову и др., 2006)
Резко кислая, рН 4–5. Часто во влажном климате, у сильноподзолистых и болотных почв, желтоземно- и красноземно-под-золистых. Почвы сильно промыты от извести, калия, бора, серы, цинка, кобальта, йода. Возможно разрушение немногочисленной органики, ухудшение физических свойств.
Сильнокислая, рН 5–5,5. Почвы влажного климата (подзолистые, дерново-подзолистые, бурые лесные ненасыщенные, желтоземы и красноземы). Понижена микробиологическая деятельность, активизирована грибная. При суглинистом и глинистом составе характерна склонность к уплотнению.
Слабокислая, рН 6–6,5. Почвы влажного климата (выщелоченные черноземы, серые и бурые лесные, насыщенные желтоземы и красноземы). Фосфат в доступном состоянии, токсичность алюминия и марганца понижена или ее нет. Дефицит серы, кальция, калия, бора, кобальта. Доля йода невысокая. Склонность к уплотнению, повышенный уровень жизнедеятельности микроорганизмов и нитрификационной активности.
Нейтральная, рН 6,5–7,5. Типична для черноземов. Благоприятные физические условия, прекрасная оструктуренность, интенсивная микробиологическая деятельность, оптимальные условия фосфорного, азотного минерального питания, высокое плодородие.
Слабощелочная, рН 7,5–8,5 (8,7). Характерна для южных черноземов, карбонатных и автоморфных почв сухих и полупустынных степей. Фосфаты, железо, цинк и марганец могут быть в дефиците. Физические свойства – от отличных (карбонатные черноземы) до неудовлетворительных (солонцеватые почвы). Микробиологическая деятельность, нитрификационная способность, условия азотного питания, доступность многих зольных элементов хорошие.
Сильнощелочные, рН 8.5-10. Повышение рН характерно для материнских пород многих черноземов и каштановых почв.
Резкощелочные, рН 10–12. Проявляется локально в аридном климате. Это могут быть солонцы, содовые солончаки. Доступность фосфора понижена, железо и марганец в дефиците, возможен избыток бора. Неблагоприятные физические условия, обесструктуренность, подавлена деятельность микроорганизмов.
Источник
Сельское хозяйство | UniversityAgro.ru
Агрономия, земледелие, сельское хозяйство
Популярные статьи
Кислотность почвы
Кислотность почвы — свойство почвы, обусловленное наличием ионов водорода в почвенном растворе и обменных ионов водорода и алюминия в поглощающем комплексе почвы.
Интервал pH 5,5-7 соответствует наиболее агрономически благоприятной структуре почвы, высокому качеству гумуса и оптимальному водному режиму.
Реакция среды почвенного раствора
Реакция среды почвенного раствора — соотношение концентрации Н + и OH — ионов почвенного раствора, выраженное в виде pH водной или солевой вытяжки. Удобрения, как правило, изменяют реакцию почвенного раствора.
Реакция почвы оказывает влияние на питательный режим почв, рост, развитие и урожайность растений, деятельность микроорганизмов почвы, трансформацию форм питательных элементов удобрений и почвы, агрофизические, агрохимические, физико-химические и биологические свойства почв. Удобрения и мелиоранты позволяют регулировать реакцию почв в желаемую для возделываемых культур сторону.
Реакция почвенного раствора определяется концентрацией ионов водорода (Н + ) и гидроксид-иона (OH — ). В чистой воде с нейтральной реакцией, концентрация ионов водорода совпадает с концентрацией гидроксид-иона и равна 1⋅10 7 моль/л. При добавлении 1 ммоль соляной и азотной кислоты к 1 л воды, которые полностью диссоциируют в водном растворе, концентрация ионов водорода составит 1 ммоль Н + , или 1⋅10 3 моль/дм 3 . Концентрацию ионов водорода выражают через показатель pH, равный:
где CH + — концентрация ионов водорода в растворе, моль/дм 3 .
В растворе с нейтральной реакцией концентрация ионов водорода равна 0,0000001 = 1 · 10 -7 моль/дм 3 , или pH = 7.
По реакции среды (рН) почвы деляться на:
Реакция почвенных растворов может колебаться в широких пределах от pH = 3-3,5, характерная для сфагновых торфов и лесных подстилок сфагновых лесов до pH = 10-11 у солонцов.
Для большинства возделываемых сельскохозяйственных культур благоприятны почвы с нейтральной или близкой к нейтральной реакцией, однако значительные площади сельскохозяйственных угодий характеризуются неблагоприятной реакцией.
Источник
Кислотность, щелочность и буферность почвы
1.Реакция почв и ее природа. рН почвы.
2. Кислотность почв и ее виды.
3. Щелочность почв и ее виды.
4. Буферность почв.
5. Сущность физиологических действий концентраций почвенного раствора на растения.
6. Окислительно-восстановительные процессы, их значение в генезисе и плодородии.
7. Методы регулирования реакции почв.
1. Кислотно-основные свойства (реакция среды) почвы имеют важное генетическое и агротехническое значение. Они определяют интенсивность внутрипочвенного выветривания, подвижность химических элементов и соединений, биологическую активность почвы, трансформацию органического вещества. Для выращивания с/х растений важно соответствие реакции среды почвенного раствора диапазону оптимальных значений рН, который различен для разных видов.
В почвенном растворе и ППК все катионы находятся в динамическом равновесии. Вода в почвенном растворе подвергается электролитической диссоциации и распадается на два иона: Н + и ОН — . В идеальных условиях концентрация Н и ОН равна 10 -7 , т.е. реакция среды нейтральна. При добавлении к этому раствору кислоты, концентрация Н + увеличивается и раствор будет подкисляться. При добавлении щелочи повышается концентрация ОН — и раствор подщелачивается. рН – показатель концентрации водородных ионов рН = — lg 10 -7 .
Реакция почвы зависит от многих факторов, и, прежде всего, от химического состава, состава обменно-поглощенных катионов, наличия солей, органических и минеральных кислот, жизнедеятельности организмов.
2. Под кислотностью почвы понимают ее способность подкислять почвенный раствор имеющимися в почве кислотами и обменно-поглощенными катионами Н, а так же Al способного при вытеснении из ППК образовывать гидролитически кислые соли.
В зависимости от реакции почвенного раствора различают строго определенные уровни кислотности и щелочности:
В зависимости от того, в каком состоянии находятся в почве ионы Н и Al, кислотность может быть активной или актуальной и потенциальной.
Под активной (актуальной)понимают концентрацию свободных водородных ионов в почвенном растворе.
Источником свободного Н в почвенном растворе могут быть растворимые органические кислоты, образующиеся после разложения органических остатков, и углекислота, при растворении углекислого газа в воде. Активная кислотность частично вызывается и десорбцией обменных ионов водорода поглощающим комплексом.
Факторами активной кислотности в почве могут быть и некоторые минеральные соли Al и Fe. Известно, что соли слабых оснований и сильных кислот в водных растворах гидролитически расщепляются освобождая кислоту. Примером может служить хлористый Al , который при взаимодействии с водой расщепляется специальным образом:
Образующаяся соляная кислота придает раствору кислую реакцию. Это явление наблюдаются в почвах, ненасыщенных основаниями. В почвах, насыщенных основаниями, активной кислотности нет.
Активная кислотность определяется в лабораториях в водной вытяжке из почвы. Количественно выражается символом рНH2OилирНвод.
Кислую реакцию имеют подзолистые, дерново-подзолистые и болотные почвы; нейтральную – главным образом чернозёмы; щелочную – каштановые, серозёмы и солонцы.
Потенциальная кислотность –обусловлена ионами Н и Al, находящиеся в поглощенном состоянии.
Потенциальная кислотность подразделяется на обменную и гидролитическую.
Обменная кислотность –та часть потенциальной кислотности, которая определяется при взаимодействии с почвой раствора гидролитически нейтральной соли КCl. При этом катион К вытесняет из ППК обменно – поглощенные катионы, среди которых H, Al, Fe подкисляют солевую вытяжку, образуя кислоту HCl.
ППК) Н, Al, Fe + 7KCl = ППК) K + HCl + AlCl3 + FeCl3
Уровень обменной кислотности определяется значением рН солевой вытяжки (рНKClилирНсол). Отмечено, что при рНКCl
ППК)Н, Al + 4CH3COONa + 3H2O = ППК)Na, 3Na + Al(OH)3 + 4CH3COOH
Нг выражается в мг экв/100 г почвы. Нг больше обменной.
3. Почвы, в поглощенном комплексе которых, находится Na имеют щелочную реакцию. Она обусловливается главным образом содой, образующейся в результате обмена поглощенного почвой Na на Н углекислоты.
Аналогично почвенной кислотности различают актуальную и потенциальную щелочность почвы. Актуальная щелочность обусловлена содержанием в почве гидролитически щелочных солей, это преимущественно карбонаты щелочных и щелочноземельных металлов: сода, гидрокарбонаты Са и Mg. Определяется актуальная щелочность значением рН водной вытяжки или путем титрования водной вытяжки кислотой с последующим выражением результатов в мг экв/100 г почвы.
Потенциальная щелочность определяется содержанием обменно-поглощенного катиона Na, который, переходя в раствор, подщелачивает его.
Потенциальную щелочность отдельно не оценивают и щелочность почвы выражают по значению актуальной щелочности. При мелиорации солонцеватых и засоленных почв оценка щелочности почвы является одним из условий, учет которого необходим для эффективного повышения плодородия.
4. Под буферностью почвы понимают ее способность как полифункциональной системы, противостоять изменению концентрации почвенного раствора, особенно ее щелочно-кислотного и окислительно-восстановительного состояния. Буферные свойства почвы связаны с процессами физико-химического (обменного) поглощения ионов, перехода различных соединений в ионные или молекулярные формы, с нейтрализацией и выпадением в осадок вновь образующихся соединений. В основном буферность почвы определяется качеством ее твердой фазы, однако механизм работы буферных систем почвы весьма разнообразен и может обходиться без вовлечения элементов твердой фазы. Наиболее простым примером проявления буферности почв является нейтрализация попадающих в почву кислых и щелочных соединений в результате реакции обмена между ионами почвенного раствора и катионами ППК.

Изменение концентрации почвенного раствора проявляется при внесении в почву в виде удобрений водорастворимых солей, которые локально могут создавать токсичные для растений концентрации. Благодаря буферности почв это отрицательное действие высоких концентраций блокируется. В целом, чем большей емкостью поглощения обладает почва, тем выше ее буферная способность. Наименьшая буферность свойственна песчаным почвам и пескам. Величина буферности почв зависит от содержания почвенных коллоидов их качества (чем больше гумусовых веществ, тем больше), состава обменно-поглощенных катионов (наличие в ППК катионов Са, К, Na препятствует подкислению, Н – подщелачиванию.)
5. Реакция почв зависит от концентрации и состава почвенного раствора. При наличии в почвенном растворе большого количества кислот, она будет более кислой, а при наличии соды – щелочной. По отношению к концентрации солей в почвенном растворе растения делят на гликофиты и галофиты.
Гликофиты — растения, не приспособленные к высокой концентрации солей.
Галофиты — растения, которые выдерживают высокую концентрацию солей и осмотическое давление (солярос, солянка).
Повышенная концентрация солей приводит к разрушению дыхательной функции растений, к появлению травматических пятен на корнеплодах и корнях, т.к. разрушаются клетки.
Наличие в почвенном растворе одних элементов способствует или усилению проникновения других элементов или снижению. Процесс усиления поступления одних элементов в почвенном растворе при наличии других называется синергизмом.
Так при наличии катионов NH4 усиливается поступление в растения фосфат иона, а при преобразовании нитрат иона усиливается поступление катионов Са. Повышенное содержание Са в растениях сдерживает поступление в них К и St.
Антогонизм ионов проявляется только при некотором избытке концентраций некоторых ионов. Уравновешенным составом почвенного раствора является состав, соответствующий требованиям растений и без большого избытка других элементов.
6. Почвенный раствор, содержащий различные органические и минеральные соединения, способен их окислять и восстанавливать, поэтому состав и свойства его изменяются. Окислительные процессы усиленно развиваются при превращении органических соединений.
К основным окислителям относятся молекулярный кислород почвенного воздуха и раствора, а также продукты жизнедеятельности почвенных организмов. Их содержание тесно связано с аэрацией почвы, поэтому окислительно-восстановительные процессы зависят от свойств почв, определяющих газообмен и влажность. Уплотнение почв и повышенная влажность ухудшают аэрацию и приводят к ослаблению окислительных процессов. Наименее выражены окислительные процессы в сильно увлажненных почвах, для этих почв характерны процессы восстановления.
Для количественной характеристики окислительно-восстановительных процессов в почве определяют величину окислительно-восстановительного потенциала Е, которая выражается в милливольтах, используя потенциометрический метод, как и при определении рН. В дерново-подзолистых почвах нормального увлажнения величина ОВ-потенциала в течение лета колеблется в пределах 550-750 мв, в черноземах 400-600, в сероземах 350-450 мв.
ОВ условия влияют на жизнедеятельность микроорганизмов, превращение растительных остатков, темпы накопления и состав образующихся органических веществ, превращение соединений N2, фосфаты Se, Fe, Al и формирования почвенного профиля. При величине потенциала 200 мв и ниже интенсивнее развиваются восстановительные процессы, что приводит к образованию закисных соединений Fe и подвижных форм марганца, который может накапливаться в растворе в токсичных для растений концентрациях. Низкое значение ОВ-потенциала способствует замедленному разложению растительных остатков, образованию подвижных и активных форм органических веществ, превращению гуминовых кислот в фульвокислоты. Кроме того, если восстановительные процессы сочетаются с промывным водным режимом, происходит разрушение почвенных минералов и вымывание продуктов разрушения.
Таким образом, ОВ-потенциал 200 мв и ниже неблагоприятно влияет на плодородие почв и указывает на необходимость проведения мероприятий по регулированию ОВ-режима почвы.
7. Почвы, в коллоидном комплексе которых значительное количество занимают катионы Н и Al или Na отличаются плохими агрономическими свойствами и нуждаются в химической мелиорации. Для улучшения почв необходимо обменно-поглощенные катионы Н, Al, Na заменить на катионы Са, которые во – первых: снизят кислотность кислых почв подзолистого типа почвообразования и уменьшает щелочность солонцовых почв; во – вторых: закрепляет гумусовые вещества и другие коллоиды, сформируют агрономически ценную водопрочную структуру и улучшают агрофизические свойства почвы; в – третьих повысят биологическую активность почв, улучшают в целом и питательный режим растений. Обогащение Са нуждающихся в улучшении почв на практике осуществляют при помощи известкования и гипсования.
Известкование –это прием внесения извести, доломитовой муки, дефеката и др. известковых материалов на кислых подзолистых и дерново-подзолистых, а также на серых и бурых лесных почвах.
Помимо перечисленного положительного влияния на почву, известкование, устраняя избыточную кислотность, так же снижает подвижность и токсичность Al, повышает эффективность удобрений.
Гипсование –внесение гипса и фосфогипса на щелочных и солонцеватых почвах и солонцах для замены Na на Са.
Са, входя в коллоидный комплекс солонцовых почв, обусловливает коагуляцию почвенных коллоидов, улучшает агрофизические и химические свойства, а вытесненный Na образует с анионами SO4 гидролитически нейтральную и хорошо растворимую соль. В результате снижается щелочность почвенного раствора и Na вымывается.
Лекция 10 (2 часа)
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник