Методические указания по выполнению лабораторных работ ОП.08 «Основы микробиологии, санитарии и гигиены» ПО СПЕЦИАЛЬНОСТИ 35.02.06 Технология производства и переработки сельскохозяйственной продукции

Данные методические указания предназначены для выполнения практических работ по дисциплине ОП.08 «Основы микробиологии, санитарии и гигиены» для обучающихся специальности: 35.02.06 Технология производства и переработки
Практические занятия дополняют теоретический курс, позволяют лучше усвоить его, знакомят с фактическим материалом на практике. практических работ по дисциплине ОП.08 «Основы микробиологии, санитарии и гигиены»
Просмотр содержимого документа
«Методические указания по выполнению лабораторных работ ОП.08 «Основы микробиологии, санитарии и гигиены» ПО СПЕЦИАЛЬНОСТИ 35.02.06 Технология производства и переработки сельскохозяйственной продукции»
министерство образования нижегородскобй области
ГБпоу «сеченовский агротехнический техникум»
по выполнению лабораторных работ
ОП.08 «Основы микробиологии, санитарии и гигиены»
35.02.06 Технология производства и переработки
Методические указания для практических занятий по учебной
очной или заочной формы обучения разработаны на основе рабочей программы учебной
дисциплины/раздела МДК.
Протокол № от « »_____________
Составитель: Алимова В.А. преподаватель 1 категории
1.Пояснительная записка 4
2.Перечень лабораторных работ 6
3.Критерии оценивания лабораторной работы 7
4.Список литературы 20
Данные методические указания предназначены для выполнения практических работ по дисциплине ОП.08 «Основы микробиологии, санитарии и гигиены» для обучающихся специальности: 35.02.06 Технология производства и переработки
Практические занятия дополняют теоретический курс, позволяют лучше усвоить его, знакомят с фактическим материалом на практике. практических работ по дисциплине ОП.08 «Основы микробиологии, санитарии и гигиены»
Цели и задачи учебной дисциплины – требования к результатам освоения учебной дисциплины:
В результате освоения учебной дисциплины обучающийся должен:
-обеспечивать асептические условия работы с биоматериалами;
-проводить простые микробиологические исследования и давать оценку полученным результатам;
-пользоваться микроскопической оптической техникой;
-соблюдать правила личной гигиены и промышленной санитарии, применять необходимые методы и средства защиты;
-готовить растворы дезинфицирующих и моющих средств;
-дезинфицировать оборудование, инвентарь, помещения, транспорт и др.;
-основные группы микроорганизмов, их классификацию;
-значение микроорганизмов в природе, жизни человека и животных;
-методы стерилизации и дезинфекции;
-санитарно-технологические требования к помещениям, оборудованию, инвентарю, одежде, транспорту и др.;
-правила личной гигиены работников;
-нормы гигиены труда;
-классификацию моющих и дезинфицирующих средств, правила их применения, условия и сроки хранения;
Проведение лабораторных работ
На практических занятиях обучающиеся овладевают первоначальными профессиональными умениями и навыками, которые в дальнейшем закрепляются и совершенствуются в процессе учебной и производственной практики.
О проведении практической работы обучающимся сообщается заблаговременно: когда предстоит практическая работа, какие вопросы нужно повторить, чтобы ее выполнить. Просматриваются задания, оговаривается ее объем и время ее выполнения. Критерии оценки сообщаются перед выполнением каждой практической работы.
Перед выполнением практической работы повторяются правила техники безопасности. При выполнении практической работы обучающийся придерживается следующего алгоритма:
1.Записать дату, тему и цель работы.
2.Ознакомиться с правилами и условиями выполнения практического задания.
3.Повторить теоретические задания, необходимые для рациональной работы и других практических действий.
4.Выполнить работу по предложенному алгоритму действий.
5.Обобщить результаты работы, сформулировать выводы по работе.
6.Дать ответы на контрольные вопросы.
Критерии оценивания работы обучающихся на практическом занятии:
Оценка «отлично» ставится, если обучающийся:
— самостоятельно и правильно выполнил все задания;
— правильно, с обоснованием сделал выводы по выполненной работе;
— правильно и доказательно ответил на все контрольные вопросы.
Оценка «хорошо» ставится в том случае, если:
— правильно выполнил все задания;
— сделал выводы по выполненной работе;
— правильно ответил на все контрольные вопросы.
Оценка «удовлетворительно» ставится, если обучающийся:
— правильно выполнил задание, возможно кроме одного;
— сделал поверхностные выводы по выполненной работе;
— ответил не на все контрольные вопросы.
Оценка «неудовлетворительно» ставится, если обучающийся:
— неправильно выполнил задания;
— не сделал или сделал неправильные выводы по работе;
— не ответил на контрольные вопросы.
Перечень лабораторных работ по «Основам микробиологии, гигиены и санитарии»
35.02.06 «Технология производства и переработки сельскохозяйственной продукции»
Название лабораторных занятий
Практическая работа №1
Устройство микроскопа, правила работы с ним
Практическая работа №2
Изготовление и окрашивание мазков
Практическая работа №3
Отбор, доставка и хранение биоматериалов.
Практическая работа №4
Работа с лабораторной посудой, ее подготовка к работе.
Приготовление простых питательных сред.
Наследственность и изменчивость микроорганизмов.
Микробиологическое исследование питьевой воды
Практическая работа № 8
Микробиологическое исследование почвы, растений.
Практическая работа № 9
Микробиологическое исследование навоза.
Практическая работа№ 10
Микробиологическое исследование мяса и яиц.
Практическая работа № 11
Микробиологическое исследование молока и молочных продуктов.
Практическая работа № 12
Микробиологическое исследование зерна и круп.
Практическая работа № 13
Микробиологическое исследование овощных и плодовых культур.
Практическая работа № 14
Санитарно-бактериологическое исследование смывов с инвентаря и оборудования.
Практическая работа № 15
Санитарно-гигиеническое обследование животноводческой фермы.
Практическая работа № 16
Санитарно-гигиенические исследования смывов с рук, одежды.
Практическая работа № 17
Приготовление растворов моющих средств.
Практическая работа № 18
Приготовление дезинфицирующих растворов, дезинфекция оборудования, инвентаря, одежды, транспорта.
Практическая работа № 19
Приготовление дезинфицирующих растворов, дезинфекция оборудования, инвентаря, одежды, транспорта.
Практическая работа № 20
Санитарно-гигиенические исследования смывов с рук, одежды, инвентаря, оборудования.
Практическая работа № 21
Санитарно-гигиенические исследования смывов с рук, одежды, инвентаря, оборудования.
ЛАБОРАТОРНАЯ РАБОТА № 1
ТЕМА : Устройство микроскопа, правила работы с ним. Основы классификации и морфология микроорганизмов.
НАИМЕНОВАНИЕ РАБОТЫ : Основные правила работы с микроскопом.
ЦЕЛЬ РАБОТЫ: Научить студентов правилам работы с микроскопом.
ПРИОБРЕТАЕМЫЕ НАВЫКИ И УМЕНИЯ :пользоваться микроскопической оптической техникой.
НОРМА ВРЕМЕНИ : 2 часа
ОСНАЩЕНИЕ РАБОЧЕГО МЕСТА : микроскопы, предметные стекла, методические рекомендации для выполнения лабораторных работ.
ЛИТЕРАТУРА:Бакулов А.И. «Эпизоотология с микробиологией»
Контрольные вопросы при допуске к занятию
1.Что называют микроскопом?
2.Какие части микроскопа входят в его механическую, оптическую и осветительную часть?
3. Правила работы с микроскопом
Перед началом работы следует ознакомиться с содержанием лабораторной работы.
По ходу работы необходимо вносить в рабочую тетрадь записи и зарисовки наблюдений.
Все использованные инструменты (иглы, петли, пипетки ит.д.), а также предметные и покровные стекла должны опускаться в сосуд с дезинфицирующей жидкостью.
По окончании работы необходимо привести в порядок рабочее место.
1.Ознакомление с устройством микроскопа.
2.Ознакомление с правилами работы с микроскопом
3.Ознакомление с правилами ухода за микроскопом
4.Написать отчет о проделанной работе
Порядок выполнения работы:
1. Ознакомление с устройством микроскопа.
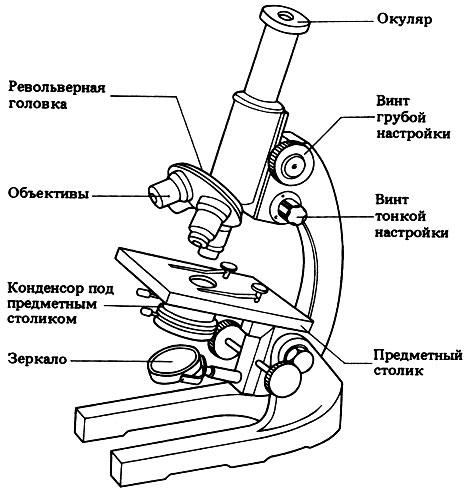
Микроскоп — это оптический прибор для получения увеличенных изображений очень малых тел. Рассмотрим устройство на примере микроскопа серии «Биолам».
Микроскоп состоит из оптической системы и механической части. Оптическая система предназначена для увеличения изображения предмета. Она включает увеличительную (объектив и окуляр) и осветительную системы (зеркало и конденсор с ирисовой диафрагмой и откидной линзой).
Объектив представляет собой систему линз, заключенных в трубку. В микроскопах серии «Биолам» используются объективы с увеличением х 3; х 5; х 9; х 10; х 20; х 40; х 60; х 85; х 90. Объективы малого увеличения (х 3; х 5; х 8; х 9) применяют для предварительного осмотра препарата; объективы среднего увеличения (х 20; х 40; х 60)—для изучения крупных клеток микроорганизмов; объективы большого увеличения (х 85; х 90)—иммерсионные — для изучения внутренних структур клеток. Окуляр служит для увеличения изображения, полученного от объектива. Окуляры обычно имеют увеличение х 7, х 10 и х 15. Увеличение объектива и окуляра указано на их оправе. Общее увеличение микроскопа равно произведению увеличений окуляра и объектива.
Осветительное устройство состоит из зеркала и конденсора. Зеркало имеет плоскую и вогнутую отражающие поверхности. Обычно при работе зеркало повернуто к свету плоской стороной. Конденсор состоит из двух линз. Конденсор укреплен на кронштейне и может передвигаться вверх и вниз с помощью рукоятки. На нижней части конденсора имеется ирисовая диафрагма, с помощью которой регулируют интенсивность освещения препарата. Объектив дает увеличенное изображение препарата в плоскости окуляра.
Механическая часть микроскопа состоит из основания и тубусодержателя, на котором укреплены предметный столик, кронштейн конденсора и зеркало. В верхней части находятся головка для насадки с окуляром и револьвер с объективами. Предметный столик служит для закрепления на нем исследуемого препарата. Фокусировка осуществляется при перемещении тубуса с помощью механизма, приводимого в движение двумя винтами — макрометрическим (грубая фокусировка) и микрометрическими (тонкая фокусировка).
2. Ознакомление с правилами работы с микроскопом.
Сначала ставят объектив с малым увеличением (х 8) и при этом увеличении устанавливают наилучшее освещение. Наилучшее освещение достигается при регулировке положения зеркала, конденсора и диафрагмы. При просмотре неокрашенных препаратов применяют суженную диафрагму и опущенный конденсор, при наблюдении окрашенных препаратов — открытую диафрагму и поднятый конденсор.
Затем помещают препарат на предметный столик микроскопа, под объектив и укрепляют зажимами. Опускают объектив (8) при помощи макрометрического винта почти до соприкосновения с предметным стеклом на расстояние около 0,5 см от предметного столика. Медленно вращают макровинт против часовой стрелки до появления четкого изображения препарата, после чего наводят на резкость микрометрическим винтом, который вращают в пределах одного оборота макровинта. Повернув револьвер, устанавливают объектив со средним увеличением (х 20; х 40 или х 60).
3. Ознакомление с правилами ухода за микроскопом.
Микроскоп является сложным оптическим инструментом и требует осторожного обращения и тщательного ухода. Он должен постоянно храниться в футляре или ящике, предохраняющем его от толчков и прямых солнечных лучей. Перед работой механические и оптические части микроскопа надо очистить кисточкой или мягкой сухой тканью. Оптические части касаться пальцами не следует. При необходимости линзы очищают тканью, смоченной в бензине. Объективы очищают только с наружней стороны, категорически запрещается развинчивать их и разбирать.
4. Написать отчет о проделанной работе.
Каков порядок просмотра препарата в биологическом микроскопе?
Как проводится подготовка предметных и покровных стекол к работе?
Лабораторная работа № 2
ТЕМА: Приготовление микроскопических препаратов и их окраска.
Оборудование:микроскоп, лабораторная посуда, культура дрожжей, микробиологическая петля,спиртовки, красители, покровное и предметное стекло.
Вопросы для рассмотрения
Приготовление прижизненных (нативных) препаратов.
Приготовление мазков и их фиксация.
Красители, используемые в микробиологии.
Простые и сложные методы окраски.
Задание для выполнения лабораторной работы
Приготовить фиксированный препарат из молодой культуры дрожжей, окрасить его в течение 2-3 мин метиленовым синим и микроскопировать без иммерсии.
Приготовить фиксированный препарат из почвенной суспензии, окрасить по методу Грама, микроскопировать его и зарисовать.
Выполнить схематическое изображение клеточной стенки грамотрицательных и грамположительных прокариот.
Материалы для исследования и техника взятия
культуры для приготовления препарата.
Для приготовления препарата исследуемый материал берут из пробирки, колбы или чашки Петри бактериологической петлей, обоженной в пламени спиртовки или стерильной пипеткой.
Пробирку с бактериальной культурой берут в левую руку, а петлю за петледержатель в правую. Правой рукой вращательным движением вынимают из пробирки ватную пробку, зажимая ее между мизинцем и ладонью, а края пробирки обжигают в пламени спиртовки. Осторожно вводят петлю в пробирку, охлаждая ее о внутреннюю поверхность стекла, после чего легким скользящим движением берут материал. Затем вынимают петлю из пробирки, снова обжигают ее край и ватную пробирку и закрывают пробирку. После приготовления препарата петлю обязательно прожигают (стерилизуют) в пламени спиртовки.
Приготовление прижизненных (нативных) препаратов.
Для исследования живых клеток микроорганизмов применяют методы «раздавленной и висячей капли». В обоих случаях возможно окрашивание объекта “прижизненными” красителями – “витальная” окраска.
Метод раздавленной капли.
На чистое предметное стекло наносят каплю воды. В каплю вносят культуру и смешивают с водой. Накрывают каплю покровным стеклом так, чтобы не образовались пузырьки воздуха. Стеклянной палочкой прижимают покровное стекло к предметному. Капля должна быть небольшой, не выходящей за края покровного стекла, но если суспензия попала за край — удаляют фильтровальной бумагой. Микроскопируют препарат с объективом 40Х. Метод удобен для исследования подвижности бактериальных клеток, а также просмотра крупных объектов — плесневых грибов, дрожжей. Применяют при изучении запасных веществ клетки. Метод “висячей” капли – используются для длительных наблюдений за клетками микроорганизмов. Препарат готовят на покровном стекле, в центр которого наносят одну каплю бактериальной культуры. Затем предметное стекло с лункой, края которой предварительно смазывают вазелином, прижимают к покровному стеклу так, чтобы капля находилась в центре лунки. Быстрым движением переворачивают препарат покровным стеклом вверх. В правильно приготовленном препарате капля должна свободно висеть над лункой, не касаясь её дна или края. Для микроскопии вначале используют малый сухой объектив 8Х, под увеличением которого находят край капли, а затем устанавливают иммерсионный объектив.
Прижизненная (витальная) окраска. Взвесь микроорганизмов вносят в каплю раствора метиленового синего или нейтрального красного в концентрациях от 0,001 до 0,00001%. Затем готовят препарат по одному из выше указанных методов и микроскопируют. После микроскопии препараты, «раздавленной» или «висячей» капли опускают в дезинфицирующий раствор.
Приготовление мазков и их фиксация
Приготовление окрашенного препарата состоит из следующих этапов:
1) приготовление мазков;
2) высушивание мазка;
3) фиксация мазка;
Для приготовления препарата, на обезжиренное предметное стекло, наносят каплю воды или физиологического раствора, в которую петлей вносят исследуемый материал и распределяют тонким равномерным слоем по стеклу на площади приблизительно 1 см 2 . Если исследуемый материал находится в жидкой среде, то его непосредственно наносят петлей на предметное стекло и готовят мазок. Мазки высушивают на воздухе или в струе теплого воздуха над пламенем спиртовки, не давая капле закипать.
Для фиксации мазка предметное стекло (мазком вверх) медленно проводят 3-4 раза через пламя спиртовки. Микроорганизмы при фиксации погибают, плотно прикрепляются к поверхности стекла и не смываются при дальнейшей обработке. Более длительное нагревание может вызвать деформацию клеточных структур.
При фиксации с помощью химических веществ используют хромовые соединения, формалин, осмиевую кислоту, ацетон. Один из распространенных приемов фиксации — обработка препарата метиловым или этиловым спиртом, или смесью Никифорова (равные объемы этилового спирта и эфира). При этом препарат погружают на 5-20 мин. в фиксирующую жидкость.
Методы окраски мазков и красители, используемые в микробиологии.
Существуют простые и сложные методы окраски. При простой окраске используют какой-либо один из красителей, например, фуксин водный (1-2 мин.), метиленовый синий (3-5 мин.). При окрашивании мазка препарат помещают на препаратодержатель. На мазок наносят несколько капель красителя. После истечения времени окрашивания препарат промывают водой, фильтровальной бумагой удаляют излишки воды, высушивают на воздухе и микроскопируют.
При сложной окраске последовательно наносятся на препарат определенные красители, различающиеся по химическому составу и цвету. Это позволяет выявить определенные структуры клеток и дифференцировать одни виды микроорганизмов от других. Таковы методы окраски по Грамму, по Цилю-Нильсену, окраска спор по методу Ожешки.
Красители, у которых при диссоциации выделяются водородные ионы, придающие красителю кислый характер, называются кислыми. Они окрашивают (в виде аниона) вещества основной природы. Красители, у которых при диссоциации выделяются гидроксильные ионы, — основными.
В микробиологической практике кислые и основные красители используются в виде солей, так как они способны вступать в реакцию с кислотами и основаниями. Основные красители чаще применяются в виде солей соляной, реже уксусной и серной кислот; кислые красители – в виде натриевых или калийных солей.
Красители основной природы
нейтральный красный генциан фиолетовый
пиронин кристаллический фиолетовый
сафранин метиловый фиолетовый
фуксин метиловый зеленый
гематоксилин малахитовый зеленый
метиленовый синий хризоидин.
янус зеленый индулин
Красители кислой природы
Красные и розовые Черные Желтые
кислый фуксин нигрозин конго
эритрозин пикриновая кислота
Интенсивность окрашивающей способности красителя завистит от рН среды: основные красители окрашивают объект тем интенсивнее, чем более щелочная среда, кислые – чем более кислая.
Красители можно разделить на: позитивные и негативные. Позитивные красители окрашивают непосредственно клетки микроорганизмов. Они окрашивают клетки при комнатной температуре в течение 30-60 секунд. Негативные красители окрашивают пространство, окружающее клетки микроорганизмов. В результате клетки выглядят силуэтами на фоне красителя.
Простой метод окраски
На приготовленный и фиксированный мазок нанести несколько капель водного раствора фуксина. Окрашивать 1-2 мин. Смыть краску водой, промокнуть препарат фильтровальной бумагой, досушить на воздухе и микроскопировать.
Окраска по методу Грама.
На фиксированный мазок нанести карболово – спиртовый раствор генцианового фиолетового через полоску фильтровальной бумаги. Через 1 –2 мин бумагу снять, а краситель слить.
Нанести раствор Люголя на 1 –2 мин.
Обесцветить этиловым спиртом в течение 30 –60с до прекращения отхождения фиолетовых структур красителя.
5. Докрасить водным раствором фуксина в течение 1- 2 мин., промыть водой, высушить фильторовальной бумагой и на воздухе, и микроскопировать.
Грамположительные бактерии окрашиваются в темно – фиолетовый цвет, грамотрицательные — в красный.
Отношение бактерий к окраске по Граму определяется их способностью удерживать образовавшиеся в процессе окраски комплекс генцианового фиолетового с йодом. Это зависит от различий в химическом составе и проницаемости клеточной стенки грамположительных и грамотрицательных бактерий пептидогликан многослоен, с ним связаны тейхоевые кислоты.
У грамотрицательных бактерий пептидогликан однослоен, имеется наружная мембрана, в состав которой входят фосфолипиды, липопротеиды, белки и сложный мепополисахарид (ЛПС). Всю наружную мембрану пронизывают белки – порины, обеспечивающие диффузию различных соединений. Таким образом, у граммположительных бактерий создаются оптимальные условия для прочной фиксации красителя и резистентности к обесцвечиванию спиртом.
К грамположительным бактериям относятся старилококки, стрептококки, коринебактерии дифтерии, микобактерии туберкулеза и др., к грамотрицательным – гонококки, менингококки, кишечная палочка и др. Некоторые виды бактерии могут окрашиваться по Грамму вариабельно, в зависимости от возраста, особенностей культивирования и других факторов, воздействующих на структуру клеточной стенки. Поэтому для окраски нужно брать всегда молодые, 1- суточные культуры.
Основная ошибка, допускаемая при окраске по Грамму, состоит в “переобесцвечивании” мазка этиловым спиртом. Грамположительные бактерии при этом могут утрачивать первоначальную окраску генциановым фиолетовым и приобретать красный цвет (характерный для грамотрицательных бактерий) в результате последующей докраски мазка фуксином грамотрицательные бактерии в свою очередь могут сохранять сине–фиолетовый цвет генцианового фиолетового. Для правильной окраски следует строго соблюдать технику обесцвечивания.
Методы приготовления прижизненных препаратов.
Из каких этапов состоит приготовление окрашенного препарата?
Методы окраски мазков.
Методика окраски по методу Грама.
Красители основной природы.
Красители кислой природы.
ЛАБОРАТОРНАЯ РАБОТА №3
ПРИНЦИПЫ МИКРОБИОЛОГИЧЕСКОГО КОНТРОЛЯ
НА ПРЕДПРИЯТИЯХ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ.
МИКРОБИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ПИЩЕВЫХ
ПРОДУКТОВ
(выполняется на 2-х занятиях)
Цель работы: Ознакомиться с принципами проведения микробиологического контроля сырья, полуфабрикатов и готовой продукции. Освоить методы определения микроорганизмов в пищевых продуктах в соответствии с требованиями нормативной документации. Изучить качественный состав микрофлоры исследуемого продукта.
Оборудование, материалы: Исследуемые пищевые продукты (крем, маргарин, майонез, питьевое молоко, колбасное изделие, детская молочная смесь, овощные консервы, пиво); пробирки с 9 см 3 стерильной воды; стерильные пипетки на 1 см 3 и чашки Петри; пробирки со стерильными питательными средами: бактериологические петли и препаровальные иглы; фильтровальная бумага; предметные и покровные стекла; микроскоп; спиртовка; промывалка;
6.1 КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
Задача микробиологического контроля — возможно быстрое обнаружение и выявление путей проникновения микроорганизмов-вредителей в производство, очагов и степени размножения их на отдельных стадиях технологического процесса, предотвращение развития посторонней микрофлоры путем использования различных профилактических мероприятий.
Микробиологический контроль проводится заводскими лабораториями систематически. При отсутствии микробиологической лаборатории на предприятии указанный контроль может осуществляться по хоздоговору с органами Госсанэпиднадзора или лабораториями, аккредитованными для проведения микробиологических исследований. Он осуществляется на всех этапах технологического процесса, начиная с сырья и кончая готовым продуктом на основании утвержденных государственных стандартов (ГОСТ), технических условий (ТУ), инструкций, медико-биологических требований и санитарных норм качества продовольственного сырья и пищевых продуктов, а также другой нормативной документации. Для отдельных производств имеются свои схемы микробиологического контроля, в которых определены объекты контроля, точки отбора проб, периодичность контроля, указаны микробиологические показатели, которые необходимо определять, приводятся нормативы по этим микробиологическим показателям.
Многие пищевые продукты являются благоприятной средой для роста и развития посторонних микроорганизмов. Несоблюдение и нарушение технологических режимов переработки сырья, санитарно-гигиенических условий на производстве, нарушение режимов хранения и сроков реализации пищевой продукции может привести к интенсивному накоплению в них микроорганизмов, способных образовывать токсины, что является причиной пищевых отравлений.
Кроме того, при несоблюдении санитарных правил и норм работниками пищевого предприятия в продукты могут попасть патогенные микроорганизмы – возбудители пищевых инфекций. Поэтому важнейшими характеристиками продовольственных товаров являются их безопасность и микробиологическая стойкость.
Под безопасностью понимают отсутствие вредных примесей химической и биологической природы, в том числе патогенных микроорганизмов и ядовитых продуктов их жизнедеятельности. Понятие «микробиологическая стойкость» подразумевает потенциальные возможности сохранения продукта без порчи.
Микрофлора пищевых продуктов представляет собой сложную динамическую систему, связанную с внешней средой. Это значительно осложняет способы ее исследования и трактовку полученных результатов.
Для оценки качества пищевых продуктов, а также условий их производства и хранения пользуются количественными и качественными показателями. Количественные показатели указывают общее число микроорганизмов определенных групп в 1 г (см 3 ) продукта. Качественные показатели указывают на отсутствие (присутствие) микробов конкретных видов в определенной массе продукта.
Группы микробиологических критериев безопасности
1. Группа показателей санитарного состояния
Непосредственное выявление патогенных микроорганизмов (возбудителей пищевых инфекций) в пищевых продуктах невозможно из-за низкого их содержания в продукте по сравнению с содержанием сапрофитной микрофлоры. Поэтому при санитарной оценке пищевых продуктов используют косвенные методы, позволяющие определить уровень загрязнения продукта выделениями человека. Чем выше этот уровень, тем вероятнее попадание в объект патогенных микроорганизмов – возбудителей кишечных инфекций.
Санитарная оценка пищевых продуктов проводится по двум микробиологическим показателям: общей бактериальной обсемененности (КМАФАнМ) и наличию бактерий группы кишечной палочки (БГКП).
Общая бактериальная обсемененность (КМАФАнМ) — количество мезофильных аэробных и факультативно-анаэробных микроорганизмов в 1 г или 1 см 3 продукта. В нормативной документации указывают предельное содержание этих микроорганизмов в единицах КОЕ (колониеобразующих единицах).
Высокая бактериальная обсемененность пищевых продуктов свидетельствует о недостаточной термической обработке сырья, недостаточно тщательной мойке и дезинфекции оборудования, неудовлетворительных условиях хранения и транспортировки продукции.
Общую бактериальную обсемененность определяют в продуктах, в которых отсутствует технически полезная микрофлора (микрофлора заквасок). Для определения этого показателя используют универсальные питательные среды: мясопептонный агар (МПА) или среду для определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов.
Наличие бактерий группы кишечной палочки (БГКП) определяется во всех жидких продуктах, во всех продуктах животного происхождения (за исключением стерилизованных), во многих продуктах растительного происхождения. БГКП объединяют представителей нормальной микрофлоры кишечника человека и относятся к семейству Enterobacteriaceae родов Escherichia, Citrobacter, Enterobacter, Klebsiella, Serratia. БГКП выполняют функцию индикатора фекального загрязнения и относятся к санитарно-показательным микроорганизмам.
Выбор БГКП в качестве санитарно-показательных микроорганизмов для оценки санитарного состояния пищевых продуктов не случаен. Санитарно-показательные микроорганизмы должны отвечать следующим требованиям:
Эти микроорганизмы должны являться представителями нормальной микрофлоры организма, в нем развиваться и размножаться;
Они должны в больших количествах выделяться из организма;
В окружающей среде они должны длительное время сохранять свою жизнеспособность, но не размножаться;
Они не должны изменяться под действием факторов внешней среды, подавляться или стимулироваться другими микроорганизмами;
Эти микроорганизмы должны равномерно распределяться в исследуемых объектах внешней среды;
Определение этих микроорганизмов должно осуществляться простыми методами.
В нормативных документах обычно указывается количество продукта, в котором БГКП не допускаются. При высоком уровне загрязнения продукта БГКП возрастает вероятность нахождения в нем патогенных микроорганизмов – возбудителей кишечных инфекций (дизентерии, брюшного тифа, холеры и др.). Для определения БГКП применяют накопительную среду Кесслера, а идентификацию этих бактерий проводят с использованием дифференциально-диагностической среды Эндо.
2. Группа условно-патогенных микроорганизмов. К этой группе относятся микроорганизмы – возбудители пищевых отравлений, таких как Proteus vulgaris, Clostridium perfringens, Bacillus cereus, Staphylococcus aureus, Clostridium botulinum.
Условно- патогенные микроорганизмы являются микроорганизмами, которые постоянно присутствуют в окружающей среде и в живых макроорганизмах. Благоприятной средой для роста и развития этих микроорганизмов является мясо и мясопродукты, поэтому именно эти продукты чаще всего являются причиной пищевых отравлений. Таким образом, многие из вышеперечисленных микроорганизмов нормируются в колбасных изделиях и других мясных продуктах.
В мясных и многих растительных консервах нормируют содержание сульфитредуцирующих клостридий, которые развиваются в анаэробных условиях.
В молочных продуктах, богатых белком (например, твороге, сыре) нормируется содержание коагулазоположительного золотистого стафилококка (Staphylococcus aureus) – возбудителя пищевой интоксикации.
При определении условно-патогенных микроорганизмов используют элективные питательные среды. Например, наличие золотистого стафилококка выявляют с помощью молочно-солевого (МСА) или желточно-солевого (ЖСА) агара.
Группа патогенных микроорганизмов
Из патогенных микроорганизмов в пищевых продуктах определяют сальмонеллы. Проводят исследования на наличие сальмонелл органы Санэпиднадзора. Обычно, сальмонеллы не допускаются в 25 г (см 3 ) продукта. В некоторых продуктах детского и диетического питания не допускается наличие сальмонелл в 50 и даже в 100 г (см 3 ).
Для определения сальмонелл используют накопительные питательные среды (селенитовую, Кауфмана, Мюллера) и дифференциально-диагностические среды (Плоскирева, Левина).
4.Группа показателей микробиологической стабильности продукта. К этой группе относятся микроскопические грибы и дрожжи, которые, как известно, являются возбудителями порчи продукта. Этот показатель нормируется многих продуктах из растительного сырья, а также в продуктах животного происхождения с растительными добавками. Динамику роста грибов и дрожжей обязательно исследуют при установлении сроков годности и режимов хранения новых видов продуктов. Плесени и дрожжи определяют с использованием сусло-агара или среды Сабуро, причем количество колоний грибов и дрожжей, выросших на плотных средах подсчитывают отдельно.
Кроме вышеперечисленных нормируемых микробиологических показателей для прогнозирования качества выпускаемой пищевой продукции целесообразно определять отдельные группы микроорганизмов, которые являются представителями технически полезной и технически вредной микрофлоры.
Так, в производстве сыров периодически определяют гнилостные бактерии как основные возбудители порчи сыров, а также следят за развитием полезных микроорганизмов (молочнокислых и пропионовокислых бактерий) в процессе выработки сыров.
6.1.2 Понятие о системе критических контрольных точек (НАССР)
В целях гарантии качества выпускаемой пищевой продукции, ее безопасности за рубежом активно внедряется система критических контрольных точек (НАССР) в качестве основы экспертизы пищевых продуктов. НАССР расшифровывается как Hazard Analysis Critical Control Paint (критические пределы надзора вредных факторов).
Характерной особенностью данной системы является планомерный надзор и контроль пищевых продуктов при предварительном определении всех возможных факторов, связанных с полным циклом обращения с пищевыми продуктами. Этот надзор начинается с контроля условий выращивания животных и контроля условий произрастания растений; с контроля среды обитания промысловых животных и гидробионтов. Далее проводят контроль условий получения сырья, и контроль производства определенного продукта из этого сырья. Заканчивается надзор исследованием готового продукта после его приготовления, хранения, транспортировки и реализации.
Эта система существенно отличается от ранее применявшегося метода санитарно-гигиенического контроля и надзора, в котором основное внимание было уделено надзору лишь конечных продуктов.
Хотя система критических контрольных точек была разработана для микробиологического контроля пищевых продуктов, в последнее время она успешно применяется и для контроля и предотвращения остаточных химических веществ, в том числе и химикатов сельскохозяйственного назначения (удобрений, гербицидов, пестицидов и др.), антибактериальных веществ, гормонов, а также включений инородных веществ в пищевые продукты.
Международным комитетом по стандартизации микроорганизмов пищевых продуктов (ICMSF) рекомендовано Всемирной Организации Здравооохранения (ВОЗ) внедрить НАССР в международный стандарт. В настоящее время в странах ЕС считается обязательным обработка и производство импортированных мяса и морепродуктов с применением системы НАССР.
Микробиологический контроль качества некоторых
При проведении микробиологического исследования пищевых продуктов в можно руководствоваться медико-биологическими требованиями и санитарными нормами качества продовольственного сырья и пищевых продуктов (СанПиН 2.3.2.560-96). Микробиологические нормативы для продуктов детского питания представлены в методических указаниях (МУК 4.2.577-96) «Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов». Выписка из этих документов по отдельным группам пищевых продуктов представлена в приложении данного лабораторного практикума.
Кремовые кондитерские изделия
Кремы, используемые для изготовления тортов и пирожных, является скоропортящейся продукцией, которая может послужить причиной пищевых отравлений. Помимо различных споровых и неспоровых бактерий, дрожжей, спор плесеней, в кремах могут присутствовать патогенные микроорганизмы. Особенно опасен заварной крем, который отличается от других кремов низкой концентрацией сахара, повышенной влажностью и содержанием муки. Помимо того, что заварной крем быстро закисает в результате развития кислотообразующих бактерий, в нем могут развиваться токсигенный золотистый стафилококк (Staphylococcus aureus) и некоторые условно-патогенные микроорганизмы (например, энтеропатогенные кишечные палочки). Следует помнить, что накопление токсинов в кремовых изделиях происходит при температуре от 15 до 22 0 С.
Причинами инфицирования крема может быть сырье (молоко, сливки, сахар, масло, яйца). Нарушение технологического режима и санитарных правил при изготовлении и хранении крема и кремовых изделий приводит к интенсивному развитию микроорганизмов, внесенных с сырьем и микроорганизмов, попадающих в крем в процессе его производства и хранения. Поэтому, в соответствии с требования ми по хранению и реализации скоропортящихся продуктов торты и пирожные с различными кремами разрешается хранить при температуре не выше 6 0 С в течение ограниченного времени (например, с белково-сбивным кремом не более 72 часов).
Готовые кремовые изделия подвергают микробиологическому контролю. КМАФАнМ в зависимости от вида крема должно быть не выше значения 1×10 4 — 1×10 5 КОЕ/г; БГКП не допускаются в 0,01 г; золотистый стафилококк – в 1 г заварного и в 0,01 г сливочного крема. Патогенные микроорганизмы, в том числе сальмонеллы должны отсутствовать в 25 г крема (приложение ).
Маргарин. Микроорганизмы в производстве маргарина играют двоякую роль. Молочнокислые бактерии, которые входят в состав водно-молочной фазы являются полезной микрофлорой маргарина, так как придают ему специфический вкус и аромат. Все остальные микроорганизмы, которые попадают с сырьем, из внешней среды являются вредителями производства, снижающими качество маргарина и его стойкость при хранении. Основными источниками посторонней микрофлоры маргарина являются компоненты водно-молочной фазы, так как жиры и растительные масла являются неблагоприятной средой для развития микроорганизмов. Микробную порчу маргарина вызывают гнилостные бактерии, которые попадают в маргарин с молоком (вызывают порок горького вкуса), грибы, дрожжи, флуоресцирующие бактерии (вызывают прогорклый вкус и неприятный запах, грибы также являются причиной образования пигментных пятен на маргарине), термоустойчивые молочнокислые бактерии (вызывают излишне кислый вкус). Качество маргарина оценивается по наличию БГКП – не допускаются в 0,01 г, по содержанию в маргарине дрожжей (не более 5х10 3 КОЕ/г) и плесеней (не более 20 КОЕ/г). Сальмонеллы не допускаются в 25 г маргарина.
Майонез. В производстве майонеза не используются промышленно полезные микроорганизмы. В этом продукте может находиться только технически вредная микрофлора, попадающая в майонез с поверхности оборудования, и остаточная микрофлора компонентов майонеза. Представители технически вредной микрофлоры майонеза вызывают его газообразование (возбудители порчи — гетероферментативные молочнокислые бактерии и дрожжи), бомбаж банок (возбудитель – маслянокислые бактерии рода Clostridium), горький вкус (возбудители порчи гнилостные бактерии). В маргарине нормируется наличие БГКП (не допускаются в 0,1 см 3 ), содержание дрожжей (не более 5х10 2 КОЕ/см 3 ), количество плесеней (не более 10 КОЕ/см 3 ), наличие сальмонелл (не допускаются в 25 см 3 .
Микрофлора питьевого молока состоит из остаточной микрофлоры пастеризованного молока (представлена спорами бацилл и клостридий, а также термойстойчивыми молочнокислыми палочками) и микрофлоры вторичного обсеменения (бактериями группы кишечной палочки, психрофильными гнилостными бактериями, мезофильными молочнокислыми стрептококками и палочками, дрожжами и др.). Микроорганизмы, попадающие в питьевое молоко, могут вызвать пороки консистенции, вкуса и цвета молока. Нормируемые показатели качества питьевого молока представлены в приложении данного лабораторного практикума. Так, для пастеризованного молока в бутылках и пакетах группы А, общая бактериальная обсемененность (КМАФАнМ) не должна превышать значения 5х10 4 КОЕ/см 3 , БГКП и золотистый стафилококк не допускаются в 1 см 3 молока, а патогенные микроорганизмы, в т.ч. сальмонеллы – в 25 см 3 .
Колбасы относятся к продуктам, употребляемым в пищу без предварительной термической обработки. В связи с этим колбасы должны отвечать высоким санитарным требованиям. Источниками микрофлоры колбасных изделий являются сырье и микрофлора вторичного обсеменения, попадающая в колбасные изделия в процессе переработки сырья. Поэтому технологические процессы выработки колбасных изделий направлены на придание им соответствующих свойств и на уничтожение микроорганизмов.
Количественный и качественный состав микрофлоры колбас зависит от вида и сорта колбасы. В вареных колбасах, подвергнутых действию высоких температур (68…70 0 С внутри батона), погибают бесспоровые бактерии, но остаются невредимыми споры и частично кокковые формы и единичные палочки, т.к. они бывают защищены слоем жира. Стойкость колбасных изделий при хранении зависит от содержания в них влаги, поваренной соли, степени пропитки антисептическими веществами дыма, а главное – от микробного загрязнения колбас. При соблюдении в колбасном производстве санитарно-гигиенических требований и использовании доброкачественного сырья бактериальная обсемененность свежевыработанных готовых изделий составляет: вареных колбас – 10 3 в 1 г, полукопченых – 10 2 , ливерных – 10 4 -10 5 . Порчу колбас вызывают молочнокислые бактерии (прокисание колбас), гнилостные не спорообразующие палочковидные бактерии и микрококки (ослизнение оболочек), плесени (плесневение колбас) и другие микроорганизмы.
Производство пива ведется в не стерильных условиях. Поэтому не исключено попадание в сусло, молодое и готовое пиво разнообразных микроорганизмов.
Микроорганизмы, развивающиеся в сусле и пиве, принадлежат к различным группам – к бактериям, микроскопическим грибам и дрожжам. По количеству представителей и по причиняемому ущербу первое место принадлежит бактериям. Это сусловые бактерии (родов Flavobacterium, Zymomonas и др.), бактерии, которые могут развиваться в сусле и пиве (молочнокислые, уксуснокислые бактерии, пивные сарцины и др.). Попав в производство, они постепенно адаптируются к условиям технологического процесса, видоизменяются и так приспосабливаются, что борьба с этими микроорганизмами затруднительна, а наносимый вред может выражаться не только в ухудшении стойкости пива, но и в порче его вкуса вплоть до полной непригодности. Широкое распространение в отечественном пивоварении как вредители получили и дрожжи. Эти микроорганизмы также как и бактерии снижают биологическую стойкость пива и ухудшают его вкус и аромат. Микроскопические грибы, в отличие от бактерий и дрожжей, хотя и часто встречаются в пивоваренном производстве, однако редко вызывают его порчу. Это связано с тем, что грибы относятся к аэробным микроорганизмам, а в процессе сбраживания сусла создаются анаэробные условия.
В зависимости от рН и химического состава овощные консервы можно отнести к четырем группам:
К группе А относятся консервы этой группы подвергаются стерилизации. К этой группе относятся низкокислотные натуральные овощные консервы с рН 4,2…5,2 (зеленый горошек, стручковая фасоль, кукуруза, цветная капуста и др.). В консервируемых продуктах группы А допускается присутствие небольшого количества спор непатогенных микроорганизмов при условии, что эти споры не разовьются в консервах во время хранения.
К группе Б относятся стерилизуемые неконцентрированные томатопродукты и пастеризуемые концентрированные томатопродукты с нерегулируемой кислотностью. Технологический процесс термической обработки томатопродуктов должен быть отрегулирован таким образом, чтобы число спор мезофильных клостридий не превышало в них 1 споры в 2 см 3 , а термофильных анаэробов было не более чем одна спора в 1 см 3 .
К группе В относятся кислотные консервы с рН от 3,7 до 4,2. Такие консервы подвергают термической обработке при 100…110 0 С. Термическая обработка должна обеспечить гибель газообразующих мезофильных бацилл — возбудителей порчи.
К группе Г относятся высококислотные овощные консервы. Такие консервы подвергают пастеризации при 75…100 0 С, поэтому в остаточной микрофлоре этих консервов могут присутствовать микроскопические грибы, молочнокислые бактерии, дрожжи и др. микроорганизмы. Пастеризация этих продуктов должна гарантировать гибель БГКП и сальмонелл.
Таким образом, перед тем как проводить микробиологическое исследование овощных консервов нужно определить к какой их вышеперечисленных групп они относятся. Особо тщательно проверяют консервы с рН более 4,2-4,4 в которых возможно развитие возбудителей пищевых отравлений.
При исследовании готовых консервов проверяют банки на герметичность, термостатируют банки при 37 0 С в течение 5 суток, далее отбирают пробы из банок и проводят микробиологическое исследование. Сохранение нормального внешнего вида тары после термостатирования является одним из показателей микробиологической стабильности консервов. Содержимое дефектных банок с признаками микробной порчи (содержание таких банок допускается не более 0,2 %) анализируют для установления природы дефекта.
Сухие детские смеси
Как видно из табл. приложения, к продуктам детского и лечебного питания предъявляются более жесткие требования, чем к продуктам массового потребления. Соответственно, к промышленному сырью и компонентам, используемым для изготовления продуктов детского питания, также предъявляются повышенные микробиологические требования.
6.2 ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
На первом занятии студенты знакомятся с принципами микробиологического контроля на предприятиях пищевой промышленности; группами микробиологических критериев безопасности пищевых продуктов и системой НАССР; с микрофлорой, особенностями проведения и схемой микробиологического исследования определенного пищевого продукта. Далее они готовят разведения анализируемого продукта и проводят посев этих разведений на плотные и жидкие питательные среды для определения нормируемых микробиологических показателей и определения содержания микроорганизмов, которые в данном продукте не нормируются, но имеют значение при прогнозировании качества исследуемого продукта.
6.2.1 Схема разведения пищевого продукта и проведения
Для приготовления разведений продукта используют пробирки с 9 см 3 стерильной воды. Иногда для приготовления разведений используются стерильные растворы разбавленного фосфатного буфера, изотонического раствора хлорида натрия, пептонной воды или лимоннокислого натрия. В первую пробирку стерильной пипеткой вносят 1 см 3 продукта. Новой стерильной пипеткой тщательно перемешивают содержимое пробирки (разведение 1:10). Затем этой же пипеткой из пробирки с разведением 1:10 отбирают 1 см 3 жидкости и переносят во вторую пробирку с водой (разведение 1:100). Количество разведений рассчитывают таким образом, чтобы в чашках Петри выросло от 30 до 300 колоний.
Так, при исследовании пастеризованного молока рекомендуется готовить I, II и III разведение продукта, так как нормируемое значение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов в питьевом молоке не более 50…200 тыс. КОЕ/см 3 (см. приложение 3).
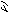
Рис. 12 Схема приготовления разведений продукта
и высева его в чашки Петри
из кондитерских изделий с кремом, из маргарина
1 г крема или маргарина взвешивают с соблюдением правил асептики и вносят в пробирку с 9 см 3 воды. Затем пробирку помещают в водяную баню с температурой 50…55 0 С. Выдерживают пробирку на водяной бане до полного расплавления крема. Содержимое пробирки тщательно перемешивают и для последующих разведений отбирают 1 см 3 жидкости, находящейся под слоем масла;
из продуктов, имеющих плотную и неоднородную консистенцию (например, из колбасных изделий, овощных консервов)
1 г средней пробы исследуемого продукта взвешивают с соблюдением правил асептики, помещают в стерильную ступку. В ступку также вносят 9 см 3 стерильной воды, и материал растирают с песком в течение 10…15 мин вблизи пламени горелки до получения однородной массы. Далее дают взвесям осесть и отбирают 1 см 3 надосадочной жидкости для приготовления разведения 1:100.
Чашечные методы количественного учета микроорганизмов
Сущность чашечных методов количественного учета микроорганизмов заключается в посеве разведений продукта на стерильные плотные питательные среды в чашки Петри с последующим культивированием и подсчетом выросших в чашках колоний. При этом считается, что каждая колония является результатом размножения одной клетки.
Учет результатов при использовании чашечных методов
Количество выросших колоний подсчитывают в каждой чашке, поместив ее вверх дном на темном фоне, пользуясь лупой с увеличением от 4 до 10 раз. При большом количестве колоний и равномерном их распределении дно чашки делят на сектора, подсчитывают число колоний в 2-3 секторах, находят среднеарифметическое число колоний и умножают на разведение (10 – при первом разведении продукта, 100 – при втором разведении и т.д.).
Если инкубированные чашки с первым разведением (1:10) не содержат колоний, то результат выражают так: меньше 1х10 КОЕ/см 3 (КОЕ – колониеобразующие единицы);
Если в чашках Петри с I разведением (1:10) содержится меньше, чем 15 колоний, то результат выражается так: количество микроорганизмов менее Мх10 КОЕ/г, где М – число выросших колоний;
Если количество колоний более15, то подсчитывают количество колоний в чашках, умножают на разведение и полученный результат округляют в соответствии с ГОСТом 26670-91 «Продукты пищевые. Методы культивирования микроорганизмов»:
до числа, кратного 5, если количество колоний в чашке менее 100;
до числа, кратного 10, если количество колоний в чашке более 100.
Пример: Посеяно I разведение продукта 1:10. В чашке Петри выросло 194 колонии. Полученный результат округляем до 200.
Количество микроорганизмов в продукте: 200х10=2,0х10 3 КОЕ/г.
Чашечными методами определяют следующие микробиологические показатели: КМАФАнМ, количество спор грибов и дрожжей, содержание гнилостных бактерий, коагулазоположительных стафилококков.
Определение мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ)
Перед посевом чашки маркируют.
По 1 см 3 разведений продукта вносят в чашки Петри. Пипетку с посевным материалом держат под углом 45 0 С, касаясь концом пипетки дна чашки. Затем в каждую чашку наливают по 12-15 см 3 мясопептонного агара или среды для определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов, расплавленной и охлажденной до 45 0 С. Сразу после заливки агара содержимое тщательно перемешивают путем легкого вращательного покачивания для равномерного распределения посевного материала. Если ожидают ползучий рост микроорганизмов посевы после застывания агара заливают вторым слоем питательной среды или 3…5 см 3 водного раствора агара. После застывания среды чашки Петри переворачивают крышками вниз и помещают в термостат при (30±1) 0 С на 72 часа (допускается предварительный учет через 48 часов с последующим окончательным учетом через 24 часа).
Определение количества грибов и дрожжей
Ведут так же, как и определение КМАФАнМ, только в качестве питательной среды используют сусло-агар или среду Сабуро. Инкубацию посевов ведут при температуре 24 0 С в течение 5 суток с предварительным учетом через 3 суток.
Определение протеолитических (гнилостных) бактерий
Соответствующее разведение продукта засевают на молочный агар инкубацию посевов проводят при 30 0 С в течение 72 часов. Протеолитические бактерии на молочном агаре при своем росте образуют зоны просветления агара (зоны протеолиза). Пептонизирующие бактерии образуют узкие зоны пептонизации.
Определение коагулазоположительных стафилококков
Ведут так же, как и определение КМАФАнМ. В качестве питательной среды используют молочно-солевой или желточно-солевой агар. Культивирование проводят при 37 0 С в течение 24…48 часов. При росте на желточно-солевом агаре вокруг колоний образуются перламутровые зоны помутнения агара, а на молочно-солевом агаре – небольшие зоны пептонизации.3
Определение аэробных спорообразующих бактерий
Исследуемый материал или разведение продукта перед посевом пастеризуют при 75…85 0 С в течение 20 мин. Далее ведут определение так же, как и при определении КМАФАнМ. После пастеризации вегетативные клетки погибают, а споры после посева на МПА и культивирования при 37 0 С прорастают и в течение 24…48 час образуют колонии.
Методы, основанные на накоплении микроорганизмов
с последующей их идентификацией
Эти методы используются для выявления микроорганизмов, содержание которых незначительно в сравнении с общим количеством микроорганизмов. Сущность этих методов заключается в посеве продукта или его разведений на накопительные жидкие среды. Если после культивирования обнаруживают рост микроорганизмов (образование осадка, помутнение среды, накопление газа в поплавках), то в дальнейшем проводят пересев из пробирок, в которых замечен рост на дифференциально-диагностические среды для идентификации выросших на накопительной среде микроорганизмов.
К таким методам относятся определение наличия БГКП, сальмонелл.
Определение бактерий группы кишечной палочки
Для посева используют то количество продукта, в котором предусматривается отсутствие БГКП (1 см 3 молока или 1 см 3 первого разведения молока). Посев проводят в пробирки со средой Кесслера с поплавками. Посевы помещают в термостат с температурой 37 0 С на 24 часа.
При отсутствии признаков роста (газообразования в поплавках, помутнения среды) дают заключение об отсутствии БГКП и соответствии исследуемого продукта нормативу на БГКП.
При положительной бродильной пробе для окончательного заключения о наличии в продуктах БГКП из подозрительных пробирок производят посев на чашки со средой Эндо или Левина. Посев производят петлей из каждой пробирки так, чтобы получить рост изолированных колоний. Чашки помещают в термостат.
Учет результатов. При отсутствии на среде Эндо или Левина колоний, типичных для БГКП (на среде Эндо – красных с металлическим блеском, на среде Левина – черных с металлическим блеском, темных с черным центром, сиреневых с темным центром) считают, что продукт соответствует нормативу. При наличии на среде Эндо или Левина типичных колоний их окрашивают по Граму и микроскопируют. Обнаружение грамотрицательных, не содержащих спор палочек указывает на наличие БГКП в анализируемой пробе и несоответствии продукта по микробиологическому нормативу.
Асептически взвешенные навески сухих компонентов или стерильно отмеренные объемы жидких компонентов (обычно 25 г или 25 см 3 ) засевают в колбы с магниевой средой или средой Мюллера (накопительные среды для сальмонелл), соблюдая соотношение продукта и среды не менее 1 : 9.
Для жидких продуктов допускается использование среды с двойной концентрацией ингредиентов при соотношении продукта и среды 1 : 1.
Колбы с посевами помещают в термостат с температурой 37 0 С на 18…24 часа.
После инкубации в термостате производят высев из колб с накопительными средами на поверхность дифференциально-диагностических сред (среду Плоскирева или висмут-сульфитный агар). Для получения отдельных колоний петлей берут минимальное количество посевного материала и производят посев штрихом. Чашки с посевами помещают в термостат с температурой 37 0 С. Проверку посевов осуществляют дважды: через 24 и 48 ч после инкубации в термостате.
Учет результатов. На среде Плоскирева колонии сальмонелл бесцветные, прозрачные, плоские, на висмут-сульфитном агаре – черные, с характерным металлическим блеском, зеленоватые с черным ободком, при этом наблюдается прокрашивание в черный цвет участка среды под колонией.
При отсутствии типичных колоний сальмонелл на каждой из сред конечный результат анализа записывают как «отрицательный», т.е. в исследуемой массе продукта сальмонеллы отсутствуют.
При наличии на любой из питательных сред на чашках Петри типичных или подозрительных колоний на сальмонеллы, производят их дальнейшее изучение по биохимическим и другим признакам.
Другие методы определения качественных
6.2.4.1 Определение анаэробных сульфитредуцирующих клостридий
В пробирки, содержащие 9 см 3 расплавленной и охлажденной до 45 0 С плотной среды Вильсона-Блера вносят, соблюдая правила асептики, 1 см 3 соответствующих разведений исследуемого продукта. Тщательно перемешивают содержимое пробирки, помещают в термостат и культивируют при 37 0 С в течение 24 часов. За положительный титр принимают то максимальное разведение продукта, в посеве которого произошло почернение среды.
6.2.4.2 Определение бактерий рода Proteus
Ведут методом Шукевича. Для определения 0,5 см 3 анализируемой взвеси (разведения) вносят в конденсационную воду свежескошенного агара, не касаясь поверхности среды.
Вертикально поставленные пробирки термостатируют при 37 0 С в течение 24 часов. На скошенном агаре палочка протея прорастает в виде голубоватого вуалеобразного налета. При микроскопии препарата обнаруживаются грамотрицательные неспорообразующие палочки.
На втором занятии студенты исследуют посевы разведений продукта, подсчитывают количество выросших колоний в чашках Петри на мясопептонном агаре или среде для определения мезофильных аэробных и факультативно-анаэробных микроорганизмов, среде Сабуро и т.д. Учет результатов при использовании чашечных методов ведут согласно п. 2.2.2. Изучают посевы продукта или его разведений в пробирках со средой Кесслера и поплавками. Если в пробирках со средой Кесслера газообразования в поплавках не наблюдается, то делают заключение об отсутствии БГКП во взятом на анализ объеме продукта. Полученные данные сравнивают с нормируемым значением, пользуясь приложением 3. Затем изучают качественный состав микрофлоры исследуемого продукта.
Изучение культуральных свойств выросших в чашках колоний
Чашки с посевами внимательно осматривают. Отмечают колонии микроорганизмов, отличающиеся по культуральным свойствам.
Рассматривая выросшие колонии в проходящем свете невооруженным глазом (макроскопически) и с помощью лупы описывают культуральные свойства по методике, описанной в разделе 5.2.2.
Изучение морфологических свойств микроорганизмов
При изучении морфологии выросших в чашках колоний на предметных стеклах готовят фиксированные мазки (при исследовании колоний одноклеточных микроорганизмов: бактерий, дрожжей) или препараты типа «раздавленная капля» (при исследовании колоний микроскопических грибов).
Фиксированные мазки окрашивают по Граму (см разд. 3.2.1) и микроскопируют с использованием иммерсионного объектива (на х90). При микроскопровании препаратов обращают внимание на форму клеток; их взаимное расположение; наличие спор; отношение к окраске по Граму. Эти признаки позволяют отнести микроорганизмы к определенной группе.
Исследование препаратов микроскопических грибов ведут по методике, описанной в разделе 4.2.1.
Оформление и анализ результатов исследований
В отчете студенты кратко конспектируют теоретический материал. Результаты определения микробиологических показателей записывают, сравнивают с нормируемыми значениями (см. приложение 2). По результатам исследований студенты делают вывод о качестве исследованного продукта.
При изучении качественного состава микрофлоры продукта результаты исследований вносят в таблицу:
Таблица 1. Культуральные и морфологические признаки выросших в чашках колоний
После заполнения таблицы делается вывод о качественном составе микрофлоры исследованного продукта.
Какая главная задача микробиологического контроля сырья, полуфабрикатов и готовой продукции на предприятиях пищевой промышленности?
Кем и на основании каких документов проводится микробиологическое исследование пищевых продуктов?
Дать определение понятиям «безопасность» и «микробиологическая стойкость» пищевых продуктов.
Перечислить группы микробиологических критериев безопасности пищевых продуктов.
Какие микробиологические показатели относятся к группе показателей санитарного состояния пищевых продуктов?
ЛАБОРАТОРНАЯ РАБОТА №4
ПРИГОТОВЛЕНИЕ И СТЕРИЛИЗАЦИЯ ПИТАТЕЛЬНЫХ СРЕД,
ПОСУДЫ ДЛЯ ПРОВЕДЕНИЯ МИКРОБИОЛОГИЧЕСКОГО
Цель работы: Ознакомиться с требованиями, предъявляемыми к питательным средам, с различными классификациями и химическим составом питательных сред, правилами их приготовления и целью использования. Приобрести навыки подготовки посуды для проведения микробиологических исследований. Ознакомиться с различными способами стерилизации питательных сред, посуды, инструментов, с устройством парового стерилизатора и принципом его работы.
Оборудование, материалы: Паровой стерилизатор; сушильный шкаф; посуда: чашки Петри; градуированные пипетки на 1 мл, пробирки, плоскодонные конические или круглодонные колбы разного объема; штатив для пробирок; ватно-марлевые пробки; пергаментная бумага; ножницы; вата, нитки, марля, агар-агар; сухие питательные среды: среда Сабуро, мясопептонный агар (МПА), среды Кесслера, Эндо и др.
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
1.1.1 Питательные среды
Разнообразные питательные вещества, в которых нуждаются микроорганизмы и которые используются ими для синтеза основных компонентов клетки, роста, размножения и для получения энергии называются питательными веществами, а среда, содержащая питательные вещества, является питательной средой.
По типу питания микроорганизмы, которые встречаются в пищевых продуктах, относятся к хемоорганогетеротрофам. Это значит, что органические вещества, содержащиеся в питательной среде, являются источником углерода, энергии и электронов. Потребности микроорганизмов в тех или иных органических веществах зависят от их видовой принадлежности, и, следовательно, от наличия в клетках и активности соответствующих ферментных систем.
В качестве источника углерода микроорганизмы используют углеводы, органические и аминокислоты, спирты, липиды и т.д. Как правило, лучше усваиваются низкомолекулярные органические соединения. Высокомолекулярные органические вещества могут быть использованы для питания только теми микроорганизмами, которые способны синтезировать соответствующие гидролитические экзоферменты. Органические вещества и вода являются также основными источниками водорода и кислорода.
Источником азота для хемоорганогетеротрофов могут быть различные органические и минеральные соединения: белковые вещества, пептоны, аминокислоты, соли аммония, нитраты.
В среде обязательно должны присутствовать макроэлементы (Р, S, Ca, Mg, K, Fe, Na, Cl), которые вносятся в питательную среду в виде катионов питательных солей.
Микроэлементы чаще всего нет необходимости специально вносить в среду, так как большинство микроэлементов является примесью солей макроэлементов или попадают в среду с частицами пыли, из стеклянной посуды или в составе водопроводной воды.
Для многих микроорганизмов нужны в малых дозах факторы роста. Факторы роста обязательно вносят в среды для культивирования ауксотрофных микроорганизмов (микроорганизмов, которые не способны синтезировать сами те или иные органические вещества, которые необходимы для роста и развития), а также добавляют в питательные среды в малых количествах для ускорения роста микроорганизмов, способных эти вещества синтезировать самостоятельно. К факторам роста относятся отдельные аминокислоты, пуриновые и пиримидиновые основания, жирные кислоты, витамины и др., а также природные субстраты, содержащие эти соединения (морковный сок, кукурузный экстракт, автолизат дрожжей, гидролизаты растительного сырья и т.д.).
Питательные среды имеют исключительное значение в микробиологии. Правильный подбор питательной среды обеспечивает возможность выделения микроорганизмов из мест обитания, получения накопительных и чистых культур, изучения их морфологии и биохимических особенностей, способствует быстрой и правильной диагностике инфекционных заболеваний, дает возможность для количественного учета микроорганизмов в различных объектах (в пищевых продуктах, в воздухе, в воде, почве). С помощью питательных сред получают также биомассу полезных для народного хозяйства микроорганизмов и биологически активные целевые продукты.
Требования, предъявляемые к питательным средам
В среде должны быть все необходимые для роста и развития химические элементы;
Среда должна быть сбалансирована по химическому составу. Это значит, что соотношение химических элементов питательной среды и главным образом соотношение органогенных элементов — С:N должно примерно соответствовать этому соотношению в клетке;
Среды должны иметь достаточную влажность, обеспечивающую возможность диффузии питательных веществ в клетку. Для грибов эта влажность обеспечивается содержанием влаги в субстрате не менее 12 %, для бактерий – не менее 20 %.
Среда должна иметь определенное значение рН среды. Среди микроорганизмов различают ацидофилы (кислотолюбивые микроорганизмы), алкалофилы (щелочелюбивые микроорганизмы) и нейтрофилы (лучше всего растут в нейтральной среде с рН около 7,0). К ацидофилам относятся грибы и дрожжи. Большинство бактерий – нейтрофилы, для которых активная кислотность среды около 4 ед. рН является губительной. Следует помнить, что при стерилизации среды и в процессе культивирования микроорганизмов, кислотность среды может сильно изменяться. Во избежание изменения рН в среду добавляют буферные системы (например: фосфатный буфер), СаСО3 (для нейтрализации образующихся в результате культивирования органических кислот), вещества органической природы, обладающие буферными свойствами (например: аминокислоты, полипептиды, белки) и др.;
Среды должны быть изотоничными для микробной клетки, т. е. осмотическое давление в среде должно быть таким же, как внутри клетки.
Среды должны обладать определенным окислительно-восстановительным потенциалом (rh2), определяющим насыщение ее кислородом. По шкале от 0 до 41 этим индексом можно обозначить любую степень аэробности: насыщенный кислородом раствор обозначают rh2=41, насыщенный водородом rh2=0. Облигатные анаэробы размножаются при rh2 не выше 5, аэробы – не ниже 10.
Среды должны быть стерильными, что обеспечивает рост чистых культур микроорганизмов.
Классификация питательных сред
По консистенции питательные среды делятся на жидкие, плотные и сыпучие.
Жидкие среды применяются для накопления биомассы или продуктов обмена микроорганизмов, для обновления долго хранящихся культур, для поддержания и хранения тех чистых культур, которые плохо растут на плотных средах.
Плотные среды необходимы для выделения и описания культуральных свойств чистых культур микроорганизмов, так как на них можно получить изолированные колонии (колония — популяция микроорганизмов, выросших из одной клетки). Плотные питательные среды используются также ля количественного учета микроорганизмов в пищевых продуктах, других объектах внешней среды и для хранения чистых культур.
Плотные среды готовятся из жидких путем добавления гелеобразующих веществ: агар-агара, желатина, геля кремнекислого (силикагеля).
Лучшим гелеобразующим веществом является агар-агар, получаемый из водорослей. Это сложный полисахарид, который образует гель с точкой плавления 96-100 0 С и температурой застывания около 40 0 С. Поэтому на агаризованных средах можно культивировать почти все микроорганизмы. Кроме того, агар-агар очень редко используется микроорганизмами в качестве питательного субстрата. Для уплотнения жидкой среды в нее вносят в зависимости от степени очистки от 1,5 до 2,5 % агар-агара.
В отличие от агар-агара желатин – это вещество белковой природы, которое получается из костей и хрящей животных при их вываривании, поэтому многие микроорганизмы используют желатин в качестве питательного субстрата и к концу культивирования среда с желатином разжижается. Ограниченное использование желатина в качестве уплотнителя для плотных питательных сред связано также с тем, что по сравнению с агар-агаром он образует менее прочный гель, который плавится при 23-25 0 С и застывает при 20 0 С, в то время как большинство микроорганизмов развивается при температуре от 25 до 37 0 С.
Если требуется получить плотные среды, не содержащие, органических компонентов, или синтетические среды с определенным количественным и качественным составом, то в качестве уплотнителя применяют кремневокислый гель. Получают его путем смешивания равных объемов соляной кислоты с удельной массой 1,1 и жидкого стекла (Na2 SiO3 или К2 SiO3) с последующей разливкой по 25-30 мл в чашки Петри и выдержкой 1-2 ч.
Сыпучие среды применяют в основном в промышленной микробиологии. К таким средам относятся разваренное пшено, отруби, кварцевый песок, смоченный питательным раствором. Такие среды используются для культивирования аэробных микроорганизмов.
По происхождению и составу питательные среды делятся на натуральные (естественные), синтетические (искусственные) и полусинтетические.
Натуральные среды готовятся из продуктов животного и растительного происхождения. Они содержат все ингредиенты, необходимые для роста и развития микроорганизмов. Основным недостатком этих сред является то, что они имеют сложный и непостоянный состав. Натуральные среды используют для выращивания микроорганизмов, накопления биомассы, хранения чистых культур, но они мало пригодны для изучения обменных процессов микроорганизмов. Такими средами являются отвары злаков, трав, овощные и фруктовые соки, различные экстракты, мясной бульон, автолизат дрожжей, молоко, молочная сыворотка, гидролизаты из растительного сырья и т.д. Наиболее часто применяемыми натуральными питательными средами являются мясопептонный агар (МПА) и мясопептонный бульон (МПБ), предназначенные для культивирования бактерий, а также не охмеленное пивное сусло и сусло-агар, используемые для выращивания и накопления биомассы грибов и дрожжей.
Синтетические среды имеют в своем составе химически чистые органические и неорганические соединения в строго указанных концентрациях. По набору компонентов синтетические питательные среды могут быть сложными (среды для выращивания молочнокислых бактерий) и довольно простыми. Такие среды применяются для исследования обмена веществ, выяснения закономерностей роста или биосинтеза какого-либо метаболита и т.д. Наиболее часто в практической работе используют синтетическую среду Чапека для выращивания грибов и среду Ридер для дрожжей. Состав этих сред приведен в приложении 2. Основным недостатком синтетических сред является то, что на таких средах микроорганизмы очень долго растут.
Полусинтетические среды в своем составе содержат химически чистые органические и неорганические вещества, (как и в синтетических средах) и вещества растительного или животного происхождения в качестве факторов роста для ускорения роста и развития микроорганизмов. Цель использования полусинтетических сред та же, что и синтетических. Так как натуральные компоненты вносятся в небольших количествах, то их химический состав не учитывается при изучении обменных процессов тех или иных микроорганизмов.
По назначению среды делятся на универсальные (основные), избирательные (накопительные, элективные) и дифференциально-диагностические.
Универсальные среды используются для выращивания многих видов микроорганизмов. К универсальным средам, используемым для выращивания бактерий, относятся мясопептонный агар и бульон (МПА, МПБ), среда для определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов (среда для определения КМАФАнМ). Грибы и дрожжи хорошо растут на не охмеленном пивном сусле, сусло-агаре (СА), среде Сабуро.
Избирательные среды обеспечивают развитие только определенных микроорганизмов или группы родственных видов и непригодны для роста других. В такие среды, как правило, добавляют вещества, избирательно подавляющие развитие сопутствующей микрофлоры. Избирательные среды применяют для выделения определенных микроорганизмов из мест их естественного обитания и для получения накопительных культур. В качестве накопительных питательных используют, например жидкие среды Кесслера (используется для накопления бактерий группы кишечной палочки), Мюллера и Кауфмана (для выявления сальмонелл). Элективными средами могут быть плотные питательные среды, такие как молочно-солевой агар (МСА) и желточно-солевой агар (ЖСА) – для выявления и количественного учета в пищевых продуктах коагулазоположительных стафилококков, кровяной агар – для выявления гемолитических стрептококков, агар с гидролизованным молоком и мелом – для количественного учета молочнокислых бактерий.
Дифференциально-диагностические среды используются для определения видовой принадлежности исследуемого микроба, основываясь на особенностях его обмена веществ. Состав этих сред позволяет четко выделить наиболее характерные свойства изучаемого микроорганизма. Примером таких сред является плотная среда Эндо, применяемая для определения бактерий группы кишечной палочки, в состав которой входит лактоза, насыщенный спиртовой раствор фуксина, обесцвеченного перед добавлением в среду 10 % водным раствором сульфата натрия (образуется бесцветная фуксин-сернистая кислота. Кишечная палочка на такой среде ферментирует лактозу с образованием альдегидов, вследствие чего бесцветная фуксин-сернистая кислота переходит в фуксин-сернистое соединение с образованием фуксина, который окрашивает колонии кишечной палочки в красный цвет с металлическим блеском.
1.1.2 Методы стерилизации питательных сред, посуды, инвентаря
Стерилизацией или обеспложиванием (sterilis – бесплодный) называется полное уничтожение микроорганизмов в питательных средах, посуде и других объектах.
Стерилизация должна обеспечивать уничтожение всей микрофлоры, патогенной и непатогенной, присутствующей в данном объекте. Она не должна приводить к порче материала или изменению его физического или химического состояния. Поэтому в зависимости от физических свойств стерилизуемых объектов и цели стерилизации применяют различные методы обеспложивания: горячие (влажная, дробная, сухая стерилизация) и холодные (механическая стерилизация, ионизация, стерилизация ультразвуком, ультрафиолетовыми лучами). Основное значение имеет тепловое воздействие на объект.
Методы, основанные на термической обработке стерилизуемых объектов
Губительное действие высокой температуры обусловливается повреждением коллоидного состояния плазмы, денатурацией белка с последующей коагуляцией его, а также нарушением ферментных систем микроорганизмов.
Различают влажные и сухие способы тепловой стерилизации.
Влажные способы используются, главным образом, для стерилизации питательных сред. К таким способам относятся стерилизация паром под давлением, стерилизация текучим паром (дробная стерилизация) и тиндализация.
Стерилизация паром под давлением – самый эффективный в бактериологической практике способ стерилизации питательных сред и посуды, так как с его помощью быстро достигается полное и надежное обеспложивание. Этот способ стерилизации основан на том, что образующийся при кипячении воды пар не выходит наружу, а, скапливаясь в замкнутом пространстве, повышает давление. При создании избыточного давления возрастает температура кипения воды и температура пара. Стерилизацию паром под давлением осуществляют в паровых стерилизаторах, принцип работы и устройство которого описаны в разделе 1.1.3.
Стерилизация текучим паром используется для сред, которые нельзя нагревать выше температуры 100 0 С. Стерилизация проводится при 100 0 С (температура парообразования) по 30…60 минут в течение 3 дней с промежутками в 18-20 часов, во время которых материал выдерживается в термостате или при комнатной температуре. Поэтому этот способ называют еще дробной стерилизацией. В основу способа дробной стерилизации положен следующий принцип: при нагревании до 100 0 С в течение 30…60 минут погибают все вегетативные клетки, а споры остаются жизнеспособными. В промежутке между стерилизацией споры прорастают в вегетативные клетки. Через сутки проводят повторную стерилизацию. Обычно после третьей стерилизации достигается полное обеспложивание объекта. Стерилизацию текучим паром осуществляют в аппаратах Коха или текучепаровых аппаратах (кипятильниках Коха).
Тиндализация – это дробная стерилизация при низкой температуре – 56…58 0 С. Применяют этот способ при стерилизации сред, которые нельзя нагревать до 100 0 С. Такие среды подвергают нагреванию в течение 5…6 дней подряд по 1 часу ежедневно (в 1-й день – в течение 2 часов). В промежутках между прогреванием стерилизуемая жидкость хранится в термостате. При этом оставшиеся в живых споры прорастают в вегетативные клетки, которые погибают при последующем нагревании. Тиндализацию проводят в специальных приборах с терморегулятором или на водяных банях.
Сухие способы. При работе в микробиологической лаборатории из сухих способов термической стерилизации используются следующие:
Прокаливание на огне (фламбирование) очень быстрый и надежный способ стерилизации бактериологических петель, препаровальных игл перед посевами. Этим способом можно стерилизовать также мелкие металлические предметы (пинцеты, скальпели) и предметные стекла. Осуществляют прокаливание над пламенем горелки.
Стерилизация сухим жаром (сухим нагретым воздухом) используется для стерилизации микробиологической посуды (пипеток, чашек Петри), песка. Осуществляют стерилизацию сухим жаром при температуре 150-170 0 С в течение 1…1,5 часов в печах Пастера или в сушильных шкафах.
Методы холодной стерилизации
Механическая стерилизация (фильтрование). Этот способ применяется для стерилизации сред в тех случаях, когда их нельзя подвергать нагреванию. При механической стерилизации стерилизуемые жидкости фильтруют через специальные фильтровальные приборы, которые имеют настолько мелкие поры, что на своей поверхности задерживают взвешенные в жидкости частицы, в том числе и микробы. Для фильтрации в микробиологической практике применяют различные фильтровальные приборы (фильтры Зейтца, свечи Шамберлана, Мандлера, Беркефельда и др.).
Химическая стерилизация. Этот вид стерилизации в практике приготовления питательных сред имеет ограниченное применение. В лабораторной практике используют некоторые химические вещества, такие как толуол, хлороформ, эфир и другие, для предупреждения бактериального загрязнения питательных сред. Для освобождения от консерванта среду нагревают на водяной бане при 56 0 С.
Химическая стерилизация используется также для дезинфекции оборудования, помещений, использованной посуды и отработанного микробиологического материала. В качестве дезинфицирующих веществ широкое применение нашли химические соединения, содержащие активный хлор (хлорамин, хлорная известь).
Стерилизация ультрафиолетовыми лучами. Этот способ стерилизации используется для стерилизации воздуха в микробиологическом боксе и в лаборатории перед проведением микробиологических исследований. Стерилизацию ультрафиолетовыми лучами проводят с помощью бактерицидных ламп.
1.1.3 Устройство парового стерилизатора и принцип его работы
Основными частями стерилизатора являются: стерилизационная камера -служит для размещения стерилизуемых объектов; парогенератор – служит для выработки пара (в парогенераторе находятся нагревательные элементы — тэны, используемые для нагрева воды и получения пара, и датчики уровня, которые нужны для предотвращения выхода из строя нагревательных элементов); система трубопроводов – для соединения сборочных единиц стерилизатора; электрошкаф – для управления электрической системой стерилизатора; манометр электроконтактный – для наблюдения за давлением в парогенераторе и поддержания его работы в автоматическом режиме; моновакуумметр – для наблюдения за давлением и разряжением в стерилизационной камере; клапан предохранительный — для сброса пара при превышении давления в парогенераторе; колонка водоуказательная (водомерная трубка) – для наблюдения за уровнем жидкости в парогенераторе; вентили – для управления работой стерилизатора.
1.2 ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
Студенты знакомятся с принципами составления и классификацией питательных сред, методами стерилизации питательных сред, посуды, инвентаря, изучают устройство парового стерилизатора и принцип его работы и кратко конспектируют изложенный в теоретической части материал. Затем готовят посуду, питательные среды и ватно-марлевые пробки для проведения микробиологического анализа.
1.2.1 Приготовление посуды для проведения микробиологического
Для проведения микробиологического анализа используют чашки Петри, которые герметично упаковываются в пергаментную бумагу и стерилизуются. Пипетки на 1 см 3 закрывают ватными тампонами и также заворачивают в бумагу. Колбы закрывают ватно-марлевыми пробками и сверху делают колпачки из пергаментной бумаги.
Стерилизация посуды осуществляется в автоклаве при избыточном давлении 0,1 МПа в течение 30-40 минут или сухим жаром в сушильном шкафу или печи Пастера при 165-170 0 С в течение 1-1,5 часа.
Стерильную посуду следует хранить в плотно закрывающихся шкафах или ящиках с крышками в течение не более 30 суток.
1.2.2 Приготовление питательных сред из промышленно
выпускаемых сухих сред
Заключается в растворении определенного количества порошка в воде, доведении полученной смеси до кипения и кипячении в течение 5 минут. Далее (при необходимости) среда фильтруется через ватно-марлевый фильтр и разливается в пробирки или колбы, которые закрываются ватно-марлевыми пробками. Далее среды стерилизуют в автоклаве. С использованием сухих сред готовят мясопептонный бульон (МПБ), мясопептонный агар (МПА), среду Сабуро, среду Кесслера, среду для определения мезофильный аэробных и факультативно-анаэробных микроорганизмов (среда для определения КМАФАнМ), среду Эндо и др.
Что такое питательные среды?
Микроорганизмы, которые встречаются в пищевых продуктах, являются хемоорганогетеротрофами. Что это значит?
Охарактеризуйте пищевые потребности хемоорганогетеротрофов.
Какие требования предъявляются к питательным средам?
Каким образом готовятся плотные питательные среды и для чего они используются?
Почему в качестве уплотнителя для питательных сред лучше использовать агар-агар, а не желатин?
На какие группы делятся питательные среды по происхождению и составу?
Что такое синтетические среды и в каких случаях они применяются?
Для каких целей используются универсальные, избирательные и дифференциально-диагностические среды?
Приведите примеры универсальных, избирательных и дифференциально-диагностических питательных сред.
Что такое стерилизация? Какие методы стерилизации Вам известны?
Какими способами можно стерилизовать посуду?
Какими из известных Вам способов можно стерилизовать питательные среды?
Как готовятся питательные среды и посуда для стерилизации?
Каково устройство и принцип работы парового стерилизатора?
ТЕМА: Приготовление питательных сред.
Вопросы для рассмотрения
Оборудование, используемое в микробиологии для стерилизации.
Питательные среды и их ингредиенты.
Подготовка посуды к микробиологическому анализу.
Задание для выполнения лабораторной работы
Приготовить питательную среду (МПА)
Подготовить посуду к стерилизации
Стерилизация среды в автоклаве
Микроорганизмам для роста, развития и размножения необходимы все входящие в состав микробной клетки элементы. Они также должны быть обеспечены энергией. Синтетические способности микроорганизмов и способы получения ими энергии разнообразны. В связи с этим различны и требования микроорганизмов к источникам питания.
Разнообразие обмена веществ у микроорганизмов связано, в большинстве случаев, с их отношением к источникам углерода и азота, обычно эти соединения определяют специфичность питательных сред. Для одного и того же микроорганизма могут быть использованы разные среды. Это зависит от задач исследования. Особые среды нужны для образования спор. Для получения определенных продуктов обмена необходимы специальные среды, отличны от тех, в которых микроорганизмы культивируются длительное время.
По составу питательные среды подразделяют на две группы: натуральные (естественные) и синтетические. Натуральными называют среды, имеющие неопределенный химический состав, так как они состоят из продуктов растительного или животного происхождения, используемых в виде настоев или экстрактов (овощи, фрукты, их отвары, солод, дрожжи, части растений, молоко, мясо, животные ткани, куриное яйцо). В таких средах трудно учесть потребление микроорганизмами отдельных веществ – продуктов обмена микробных клеток. Поэтому натуральные среды малопригодны для изучения физиологии микроорганизмов.
В синтетические среды входят в точно указанных концентрациях только известные химически чистые соединения. Синтетические среды могут быть простыми по составу или иметь относительно большой набор компонентов. Их широко используют для изучения обмена веществ микроорганизмов.
Существуют и так называемые “полусинтетические” среды, относящиеся к средам с неопределенным составом, они содержат соединениями известной химической природы, наряду с веществами неопределенного состава. Примером полусинтетических сред являются следующие: мясопептонная среда, в которую наряду со сложными и неопределенными по химическому составу веществами (мясной бульон) иногда входят пептон, глюкоза или сахароза, поваренная соль, фосфорнокислый калий; картофельные среды с глюкозой и пептоном. Полусинтетические среды широко используются в промышленной микробиологии для получения витаминов, антибиотиков, аминокислот и других продуктов жизнедеятельности микроорганизмов.
По физическому состоянию среды разделяют на жидкие, плотные и сыпучие.
Жидкие среды используют для накопления биомассы или продуктов обмена при выяснении физиолого – биохимических особенностей микроорганизмов
Плотные среды готовят из жидких, добавляя 1,5-2,5% агар-агара или 10-15% желатины.
Агар-агар – растительный коллоид, состоящий главным образом из полисахаридов с низким содержанием азотистых веществ.
Желатина – кислый азотсодержащий продукт, добываемый путем выварки костей и хрящей.
Основой плотной среды может служить кремнекислый гель, введенный в микробиологическую практику С.Н. Виноградским.
Сыпучие среды – разваренное пшено, отруби, пропитанные питательным раствором, — используют в промышленной микробиологии.
С.Н. Виноградским и М. Бейеринком введены в микробиологическую практику элективные (или избирательные) среды. Эти среды создают условия для преимущественного развития одного вида или группы родственных микроорганизмов и мало пригодны или совсем непригодны для развития других
Приготовленные среды, как правило, стерилизуют (Sterilis — бесплодный). Методы стерилизации (обеспложивания) основаны на двух принципах:
а) уничтожение клеток микроорганизмов и их спор в питательных средах, на посуде, инструментах и других предметах – методы термической и лучевой (холодной) стерилизации;
б) отделение клеток микроорганизмов – метод фильтрования (холодная стерилизация).
стерилизация ультрафиолетовыми лучами;
химическая стерилизация и дезинфекция.
1) прокаливание на пламени (фламбирование);
2) стерилизация сухим жаром;
стерилизация текучим паром – тиндализация;
6)стерилизация насыщенным паром под давлением – автоклавирование.
Приготовление мясопептонного агара (МПА).
Наиболее распространенной средой, на которой растет большинство микроорганизмов, использующих органические формы азота, является МПА.
Для приготовления 1 л среды необходимо сделать следующее:
1) в термостойкую колбу на 1500-2000 мл положить 2 мясных кубика, высыпать 5 г глюкоза (0,5%), 5 г сахара (0,5%), 10г пептона (1%);
2) добавить 1000 мл дистиллированной воды;
3) колбу с ингредиентами поставить на водяную баню для расплавления агар – агара, которого добавляем 20г (2%); (температура плавления агара 100 0 С, застывания — 40 0 С);
4) установить слабо щелочную реакцию среды (большинство микроорганизмов развивается лучше на средах с рН 7,0-7,2), для чего использовать 20%-й раствор Na2Co3; реакцию среды проверить лакмусовой бумажкой, смоченной дистиллированной водой. Более удобно использовать индикатор бромтимолблау, имеющей в нейтральной среде бутылочно-синий, в кислой – желтый цвет. 1-2 капли индикатора внести в фарфорную чашечку и стеклянной палочкой добавить 1-2 капли расплавленного МПА;
5) разлить среду по пробиркам и колбам, закрыть ватными пробками, завернуть плотной бумагой. Посуду со средой поместить в автоклав и стерилизовать 30 мин при давление в 1атм. После стерилизации пробирки с еще не застывшей средой раскладывают на ровной поверхности стола в наклонном (под небольшим углом) положении для получения скошенной поверхности агара. Это так называемые косяки, косые или скошенные среды. Плотная среда, застывая при вертикальном положении пробирки, называется столбиком.
Подразделение питательных сред по: а) составу; б) назначению; в) физическому состоянию.
способы и характеристика.
способы и характеристика.
Подготовка сред к стерилизации и их стерилизация.
Подготовка посуды к стерилизации. Какими способами ее стерилизуют?
ТЕМА: Методы изучения генетики микроорганизмов.
Вопросы для рассмотрения.
1.Меры предосторожности при работе с мутагенами.
2.Мутагены, используемые для получения мутаций у микроорганизмов.
3.Отбор мутантных клеток.
4.Способы переноса генетической информации у бактерий.
Задание для выполнения лабораторной работы
Получить мутантные клетки микроорганизмов с помощью непрямого метода отбора, методом отпечатков. Проводится виртуально с использованием видеоматериалов в виду опасности биоматериала и отсутствия условий проведения.
Меры предосторожности при работе с мутагенами.
Любую работу с химическими мутагенами необходимо проводить в вытяжном шкафу, рабочая поверхность которого застелена фильтровальной бумагой.
Руки должны быть защищены резиновыми или пластиковыми перчатками.
Растворы мутагенов запрещается набирать ртом; пользоваться только пипеткой с грушей, автоматическими пипетками.
Растворы мутагенов запрещается сливать в раковину; можно пропитать ими любую гигроскопичную среду и поместить в герметичный контейнер, подобно другим опасным отходам.
При работе с источниками УФ-лучей следует защищать глаза стеклянными очками.
Генетическая информация у бактерий способна переноситься способами: трансформацией, трансдукцией, конъюгацией.
Трансформация –это непосредственная передача генетической информации или генетического материала (фрагмента ДНК) клетки-донора в клетку-реципиент и наблюдение ее наследственных изменений.
Процесс трансформации бактерий можно разделить на несколько этапов:
адсорбция ДНК донора на клетке-реципиенте;
проникновение ДНК внутрь клетки-реципиента;
соединение ДНК с гомологичными участками хромосомы реципиента с последующей рекомбинацией.
Эффективность спаривания трансформирующей ДНК с соответсвующим участком хромосомы реципиента зависит от степени гомологичности ДНК донора и реципиента. Чем выше гомологичность (комплементарность), тем эффективнее спаривание, что и определяет конечный результат, то есть количество формирующихся рекомбинантов (трансформантов).
Трансдукцией называют процесс переноса генетической информации из клетки-донора в клетку-реципиент, осуществляемый фагом.
Различают три типа трансдукции:
При специфической трансдукции в клетке реципиентного штамма вместе с фаговой ДНК могут быть перенесены любые гены донора. Перенесенный фрагмент ДНК бактерии-донора способен включаться в гомологичную область ДНК клетки-реципиента путем рекомбинации. Фаги являются только переносчиками генетического материала от одних бактерий к другим, поскольку сама фаговая ДНК не участвует в образовании трансдуктантов.
Специфическая трансдукция характеризуется способностью фага переносить определенные гены от клетки-донора к клетке-реципиенту. При воздействии трансдуцирующих фагов с клетками реципиентного штамма, происходит включение гена бактерии-донора вместе с ДНК дефектного фага в хромосому бактерии-реципиента.
При абортивной трансдукции принесенный фагом фрагмент ДНК клетки-донора не включается в хромосому клетки-реципиента, а располагается в ее цитоплазме и может в таком виде функционировать. Во время деления бактериальной клетки трансдуцированный фрагмент ДНК донора может передаваться только одной их двух дочерных клеток, то есть наследоваться однолинейно и в конечном итоге утрачиваться в потомстве.
Конъюгацией называют процесс переноса генетической информации из клетки-донора в клетку-реципиент при непосредственном контакте между собой, при их скрещивании. Процесс конъюгации у бактерий обусловлен наличием в клетках-донорах конъюгативных плазмид (F-плазмид, F + ). F-плазмида контролирует синтез половых ворсинок, которые способствуют эффективному спариванию Бактериальные клетки, не имеющие полового фактора (F-плазмид), не способны быть генетическими донорами, а только реципиентным генетическим материалом и обозначаются как F — клетки. При скрещивании F + с F — клеткой почти все реципиентные клетки получают половой фактор и становятся F + клетками.
Плазмиды выполняют несколько функций:
регуляторную, которая состоит в компенсации нарушений метоболизма ДНК клетки-хозяина;
кодирующую, которая состоит во внесении в бактериальную клетку новой информации, о которой судят по приобретенному признаку.
Важным свойством F –плазмиды является способность включаться в определенные участки бактериальной хромосомы и становиться ее частью. В некоторых случаях F-плазмида высвобождается из хромосомы, захватывая при этом сцепленные с ней бактериальные гены. Такие F-плазмиды обозначаются с указанием сокращенного латинского названия включенного в ее состав гена (например, Flac).
Плазмиды, а также транспозоны, Is-последовательности, эписомы являются внехромосомными факторами наследственности, так как они не являются генетическими элементами, жизненно необходимыми для бактериальной клетки, поскольку не несут информации о синтезе ферментов, учавствующих в метаболизме.
Транспозпны представляют собой нуклеотидные последовательности, вклющающие от 2000 до 20500 пар нуклеотидов (п.н.). При включении в бактериальную ДНК они вызывают в ней дупликации, а при перемещении-делеции и инверсии. Транспопзоны имеют особые концевые структуры нескольких типов, которые являются маркерами, позволяющими отличать от других фрагментов ДНК.
Is-последовательности – это фрагменты ДНК, длиной 100 п.н. и более. В Is-последовательностях содержится информация, необходимая только для их транспозиции, то есть перемещения в различные участки ДНК.
Эписомы еще более крупные и сложные саморегулирующиеся системы, содержащие Is-последовательности и транспозоны; способны реплицироваться в любом из двух своих альтернативных состояний – автономном или интегрированном – в хромосому клетки-хозяина. К эписомам относятся различные умеренные лизогенные фаги. Эписомы имеют собственную белковую оболочку и более сложный цикл репродукции, чем у других внехромосомных факторов наследственности. Собственно эписомы – это вирусы, обладающие способностью переходить из одного генома в другой.
Классификация мутаций: 1) по происхождению; 2) по количеству мутировавших генов; 3) по фенотипическим последствиям.
Какие мутагены используют для получения мутантных клеток микроорганизмов?
Как проводиться прямой отбор мутантных клеток?
Какие способы используются при непрямом отборе мутантных клеток?
Как происходит процесс трансформации у бактерий?
Специфическая, неспецифическая, абортивная трансдукция.
Чем обусловлен процесс конъюгации у бактерий?
Какие внехромосомные факторы наследственности присущи бактериям?
ЛАБОРАТОРНЫЕ РАБОТЫ №7; №8.
Анализ микрофлоры воды и воздуха.
Ознакомиться с методами микробиологического исследования воды и воздуха.
Термостаты на 30°С и 37°С, среда МПА, сусло-агар, стерильные чашки Петри, пипетки на 1 и 10 см3, колбочки для взятия пробы воды, спиртовки, карандаши по стеклу, этикетки, штативы для пробирок, предметные стекла, бактериологические петли, краски для окрашивания микробиологических препаратов, промывная вода, фильтровальная бумага.
В воздухе производственных помещений определяют общее количество бактерий, количество дрожжей и плесеней не реже одного раза в месяц.
Вода на предприятии исследуется не реже одного раза в месяц, где определяется соответствие её ГОСТ 2874-82 «Вода питьевая, Гигиенические требования и контроль за качеством».
На пищевых предприятиях вода, используемая в различных целях, должна соответствовать питьевой.
Рекомендации по выполнению работы.
Лабораторная работа выполняется на двух занятиях.
Первое занятие – посевы микрофлоры анализируемых объектов на питательные среды.
Второе занятие – оценка полученных результатов анализа.
Посев микрофлоры воздуха в учебном заведении можно взять в производственной технологической лаборатории, столовой и др. помещениях.
Воду – из крана водопровода.
1. Ознакомиться с пояснением к работе.
2. Произвести посев микрофлоры воздуха в помещении на питательную среду методом Коха.
3. Произвести посев микрофлоры водопроводной воды для определения её пригодности на производство.
4. Записать содержание занятия в рабочую тетрадь.
Пояснение к работе
Микроорганизмы находятся в воздухе постоянно, несмотря на то, что атмосфера не является благоприятной средой для их развития из-за отсутствия питательных веществ, недостатка влаги, жёсткого ультрафиолетового излучения, радиации. В воздух микроорганизмы попадают из почвы, воды, поверхности растений, тела животных и т. д. Жизнедеятельность микроорганизмов в воздухе обеспечивают взвешенные частицы воды, слизи, пыли.
Микрофлору воздуха можно условно разделить на постоянную и переменную. К постоянной относятся микроорганизмы, устойчивые к свету, высыханию (пигментообразующие кокки, споры бацилл, клостридий, плесневых грибов, актиномицеты), к переменной – болезнетворные микроорганизмы, попавшие в воздух от больных животных и людей, а также от носителей (гноеродные кокки, возбудители столбняка, туберкулеза и т. д.).
Атмосферный воздух и воздух закрытых помещений значительно различаются по количественному и качественному составу.
Состав микрофлоры атмосферного воздуха зависит от интенсивности солнечной радиации, ветра, метеоосадков, покрова почвы, плотности населения. Меньше всего микробов в воздухе над лесами, горами, крупными водоемами, морями, снегами.
Обсемененность воздуха закрытых помещений значительно превышает обсемененность атмосферного воздуха. Особенно много микроорганизмов в помещениях, где находится большое количество людей и животных. Воздух закрытых помещений содержит в основном микрофлору дыхательных путей, кожи, шерстяного покрова животных. Причем многие представители этой микрофлоры способны переживать в воздухе в течение длительного времени, достаточного для инфицирования людей и животных. Микроорганизмы, находящиеся в воздушной среде, могут явиться причиной различных инфекционных заболеваний (гриппа, туберкулеза, ангины, скарлатины, пневмонии и т. д.). В производственных помещениях предприятий пищевой промышленности в воздухе могут содержаться микроорганизмы, вызывающие порчу сырья и продуктов питания.
В связи с этим возникает необходимость в санитарно-бактериологическом исследовании воздуха и его оценке.
Объектами санитарно-бактериологического исследования являются: воздух лечебно-профилактических учреждений, мест массового скопления людей, воздух цехов по изготовлению пищевых продуктов, холодильников и холодильных камер и др.
Исследование воздуха включает:
определение микробного числа, т. е. количества сапрофитных бактерий, плесневых грибов и дрожжей в 1м3 воздуха;
определение количества санитарно-показательных микроорганизмов – гемолитических стрептококков и стафилококков, которые являются показателями биологической контаминации воздуха микрофлорой носоглотки.
Гемолитические стрептококки и стафилококки постоянно обитают в носоглотке человека и животных и выделяются при кашле, чихании. Вместе с ними могут выделяться возбудители респираторных заболеваний, туберкулеза и др. По количеству гемолитических стрептококков и стафилококков косвенно судят о санитарном состоянии воздуха.
Методы отбора проб воздуха подразделяются на седиментационные, аспирационные и фильтрационные.
Седиментационный метод (метод Коха). Это простой метод бактериологического исследования воздуха, который основан на оседании бактериальных частиц и капель под влиянием гравитационных сил на поверхность питательной среды в открытой чашке Петри. При этом используются различные питательные среды.
Аспирационный метод. Этот метод основан на принудительном оседании микроорганизмов на поверхность плотной питательной среды. Для исследования воздуха аспирационным методом используется прибор Кротова, через который пропускают определенный объем воздуха.
Фильтрационный метод. Для исследования атмосферного воздуха используется ряд приборов, в которых аэрозоль улавливается в жидкую среду (прибор Дьяконова) и приборы-бактериоуловители (трубки с размещенными в них плотными фильтрами: хлопчатобумажная или стеклянная вата).
Вода является естественной средой обитания многих видов микроорганизмов. Микроорганизмы попадают в неё в большом количестве из почвы после дождей, со сточными талыми водами, а также из организмов, живущих в водоеме рыб и животных, гниющих растений. Количественный и видовой состав микрофлоры воды зависит от микробного состава почвы около водоема, от содержания в воде органических веществ, от температуры воды, скорости течения, метеорологических и других условий. Микрофлора пресных и соленых водоемов различна.
Микрофлора озер и рек представлена кокками (микрококки, сарцины и др.), палочковидными (псевдомонасы, серо- и железобактерии). Микрофлора морей и океанов представлена кокками, актиномицетами, светящимися бактериями и галофильными (солелюбивыми) микроорганизмами, которые выдерживают концентрацию поваренной соли до 20% и выше.
Со сточными водами в реки и озера попадают микроорганизмы, которые являются представителями нормальной микрофлоры кишечника человека и животных. К ним относятся кишечная палочка, протеи, энтерококки и др. Вместе с ним в воду открытых водоемов от больных животных и людей могут попасть патогенные микроорганизмы, которые являются возбудителями инфекционных заболеваний и сохраняются в течение нескольких дней, недель и даже месяцев. Поэтому вода является одним из факторов передачи и распространения многих инфекций, в том числе кишечных.
Микроорганизмы, в том числе патогенные, могут оказаться в водопроводной воде, в воде родников и скважин, в колодцах и т.д.
В связи с этим возникает необходимость санитарной оценки и контроля качества воды.
В соответствии с действующими нормативными документами контролю подлежат:
— вода питьевая (централизованного и местного водоснабжения, т.е. из водопровода, артезианских скважин, колодцев, родников);
— вода открытых водоемов;
— вода плавательных бассейнов.
Водопроводную воду исследуют не реже одного раза в месяц, артезианскую – не реже одного раза в год, воду открытых водоемов и колодцев – ежедневно.
2. Посев микрофлоры воздуха.
Микрофлора воздуха производственных помещений оценивается по содержанию бактерий, дрожжей, плесеней.
Техника посева микрофлоры. В цехах и холодильных камерах производственных помещений при оценке санитарного состояния воздуха чашки Петри с питательными средами (МПА и сусло-агар) размещают попарно в разных местах и на разной высоте от пола. Выдерживают 5 минут открытыми для посева микроорганизмов из воздуха (метод осаждения по Коху). Затем, закрыв их и подписав, чашку Петри с посевом на МПА помещают в термостат при температуре 30 °С на 72 часа, чашку микрофлоры с посевом на сусло-агар выдерживают при комнатной температуре (20 – 23 °С) в течение 3-5 суток.
Чашки со средой перед посевом микрофлоры выдерживают 3-е суток в термостате для проверки на стерильность.
Рекомендуемая форма обозначения посева микрофлоры:
222 – номер учебной группы;
1 – номер подгруппы;
2 – номер бригады;
0,3;0,3 – дата посева микрофлоры;
Дж и Плс – определение дрожжей и плесеней.
Обозначения выполняют карандашом на стекле. Посевы в пробирках удобнее снабжать этикеткой.
3. Посев микрофлоры водопроводной воды.
При исследовании водопроводной воды определяют её соответствие нормативно-технической документации, где учитывается содержание в ней общего количества микробов (мезофильных аэробных и факультативно-анаэробных микроорганизмов) и количество бактерий группы кишечных палочек.
По действующему ГОСТ 2874-82 в 1см3 питьевой воды не должно содержаться более 100 микроорганизмов, а титр бактерий группы кишечных палочек должен быть не менее 333 (коли-титр).
Количество бактерий группы кишечных палочек в 1 литре воды должно быть не более трех (коли-индекс).
3.1 Посев микрофлоры водопроводной воды для определения общего количества микроорганизмов.
Отбор пробы воды.
Пробы воды для микробиологического исследования отбирают с соблюдением правил асептики в стерильные флаконы вместимостью 0,5 л с притертой, каучуковой или корковой пробкой. При взятии пробы из водопроводного крана воду спускают в течение 10-15 минут, затем кран обжигают пламенем от ватного тампона, смоченного спиртом. Из открытых водоемов пробы отбирают с помощью специальных приборов – батометров с глубины 10 – 15 см от берега и в середине течения. Объем взятой для исследования воды должен быть не менее 500 см3.
Пробы водопроводной воды нужно брать в часы её наибольшего расходования на предприятии. Наполненные флаконы закрывают пробками и стерильными бумажными колпачками. При отборе проб воды оформляют соответствующий документ, в котором указывают номер пробы, дату, час и минуты взятия пробы, точное местоположение крана, из которого отбирали пробу, должность, фамилию, имя и отчество лица, отбирающего пробу. Пробы воды исследуют не позднее, чем через 2 ч. с момента взятия. В вынужденных случаях от данного правила отступают, но не более, чем на 6 ч. при условии хранения проб при температуре 1 – 5 °С. При перевозке проб летом их предохраняют от нагревания, а зимой – от замораживания.
Техника посева микрофлоры.
1 см3 воды стерильной пипеткой вносится на дно стерильной чашки Петри и заливается расплавленным, охлажденным до 45 °С мясопептонным агаром. Содержимое перемешивают легким кругообразным движением чашки, не допуская залива среды за борта чашки, среда отвердевает, посев микрофлоры обозначается. Затем чашки с агаром перевертывают вверх дном (во избежание попадания конденсационной влаги на поверхность питательной среды) и помещают в термостат при температуре 30 °С на 72 часа.
3.2 Посев микрофлоры для определения коли-титра (1-ый этап – определение бродильного титра).
Техника посева микрофлоры.
Посев производят в три колбы с концентрированной лактозо-пептонной средой (ЛПС) по 100 см3 воды в каждую, в 3 пробирки с концентрированной лактозо-пептонной средой (ЛПС) – по 10 см3 воды в каждую и по три пробирки с обыкновенной ЛПС – по 1 см3 воды в каждую (ЛПС с поплавками).
Посев микрофлоры обозначают и культивируют при температуре 37 °С в течение 24 часов.
При посеве микрофлоры строго соблюдать асептические условия. Работать вблизи спиртовки, все (пипетки, горло пробирок, пробки, край чашки Петри) обжигают в пламени спиртовки.
1. Определить число бактерий, дрожжей, плесеней в воздухе контролируемого помещения. Дать санитарную оценку воздуха.
2. Определить общую микробную обсемененность 1 см3 воды.
3. Определить коли-титр и коли-индекс воды. Дать санитарную оценку воды.
4. Записать содержание занятия в рабочую тетрадь.
Ответить на контрольные вопросы.
Определение числа бактерий в воздухе.
Количество выросших колоний подсчитывают на чашке с МПА, поместив её на темном фоне вверх дном и пользуясь лупой с увеличением в 4 – 10 раз.
Каждую подсчитанную колонию отмечают на дне чашки чернилами. При подсчете колоний рекомендуется пользоваться счетчиками.
При большом числе колоний и равномерном их распределении дно чашки Петри делят на четыре и более одинаковых секторов, подсчитывают число колоний на двух-трех секторах (но не менее, чем на 1/3 поверхности чашки), находят среднее арифмитическое число колоний и умножают на общее количество секторов всей чашки.
1.2 Определение дрожжей и плесеней.
Количество выросших колоний подсчитывают на чашке, поместив её на темном фоне вверх дном и пользуясь лупой с увеличением в 4 – 10 раз.
Каждую подсчитанную колонию отмечают на дне чашки чернилами.
Колонии дрожжей на сывороточном агаре БФ имеют серый цвет со стальным блеском, на других средах – колонии бежевато-желтого цвета.
Плесневые грибы имеют различную окраску, поверхности покрыты пушистым мицелием.
Количество колоний плесневых грибов и дрожжей подсчитывается отдельно.
Результаты подсчета занести в таблицу (форма 3).
Количество колоний микроорганизмов
1.3 Санитарная оценка воздуха.
Санитарную оценку воздуха дать согласно таблице.
Примерные микробиологические показатели для оценки воздуха помещений
выросших на чашках Петри
Воздух цеховых помещений предприятий
Воздух остальных помещений предприятий
2. Определение общей микробной обсемененности 1 см3 воды.
Для определения общей микробной обсемененности воды подсчитывается количество колоний микроорганизмов на чашке Петри с МПА (по описанной выше методике).
3. Определение коли-титра и коли-индекса.
Просмотреть бродильные сосуды с исследуемой водой. При отсутствии газа в поплавках и помутнения среды считать водопроводную воду стандартной по коли-титру (коли-титр в этом случае более 333 см3). В случае обнаружения в бродильных сосудах признаков брожения (газ в поплавке, помутнение среды) каплю забродившей жидкости стерильной петлей нанести на среду Эндо штрихом в отдельные сектора из каждого забродившего сосуда (2-й этап).
Посевы обозначить, поставить в термостат на 24 часа при 37 °С.
Если нет характерного роста на среде Эндо (колонии темно-красного цвета с металлическим блеском или без него, красные или розовые с темным центром, бесцветные), считают, что кишечная палочка отсутствует в данном объеме воды.
(3-й этап). При наличии на среде Эндо темно-красных колоний с металлическим блеском и без блеска из них (с трех колоний каждого сектора) делают мазки, окрашивают по Граму и микроскопируют. Если в мазках из колоний обнаруживают мелкие полиморфные, неспоровые, грамотрицательные палочки, то определяют оксидазную активность бактерий из этих колоний (оксидазный тест).
Из секторов на среде Эндо снимают бактериологической петлей по 2 – 3 темно-красные колонии и наносят штрихами на смоченную реактивом фильтровальную бумагу. Если цвет бумаги в месте нанесения бактериальной массы не изменяется, то оксидазный тест считается отрицательным, а если бумага синеет в течение 1 мин. – положительным. Наличие на секторах среды Эндо темно-красных колоний грамотрицательных палочек, не обладающих оксидазной активностью, свидетельствует о присутствии санитарно-показательных бактерий группы кишечных палочек в исследуемом объеме воды.
Если обнаруживают грамотрицательные бактерии, обладающие оксидазной активностью, то дают заключение об отсутствии в воде бактерий группы кишечных палочек.
На оксидазную активность исследуют бесцветные и розовые колонии, выросшие на секторах среды Эндо (при отсутствии там темно-красных колоний). В случае обнаружения в мазках неспорообразующих грамотрицательных палочек. Не обладающих оксидазной активностью, делают посев из 2 – 3 колоний разного типа с каждого сектора в полужидкую среду с глюкозой и индикатором ВР и термостатируют при температуре 37 °С в течение 4 – 5 часов. Наличие кислоты и обязательного газа в среде с глюкозой после термостатирования в течение 3 – 4 ч. позволяет дать заключение о присутствии в исследуемой воде бактерий группы кишечных палочек. Отсутствие кислоты и газа дает отрицательное заключение.
Данные по анализу посева микрофлоры водопроводной воды оформить в виде таблицы и дать заключение о соответствии её ГОСТ.
Общее количество микробов в 1см3
Заключение о соответствии ГОСТу
4. Записать содержание занятия в рабочую тетрадь
1. По каким показателям проводят санитарную оценку чистоты воздуха в производственных цехах мясоперерабатывающих предприятий?
2. По каким бактериологическим показателям оценивают качество воды?
3. Для чего определяют коли-титр и коли-индекс воды?
Лабораторная работа №9
Тема: Микробиология навоза.
Микрофлора навоза. Навоз — ценное удобрение, повышающее плодородие почв и улучшающее их структуру. Ввиду содержания в нем значительного количества органических соединений он служит хорошей средой для развития сапрофитных и некоторых патогенных микробов, которые могут в нем длительное время сохранять жизнеспособность (поэтому свежий навоз в качестве удобрения не применяют). Состав микрофлоры обусловлен теми видами микроорганизмов, которые обитают в кишечнике животных.
В настоящее время приняты два способа хранения навоза — в штабелях и в специальных траншеях-навозохранилищах, что способствует интенсивному размножению в нем термофильных микробов, создающих высокую температуру, за счет которой происходит санирование навоза, т. е. гибель патогенных микробов и гельминтов, что необходимо в проведении профилактических и оздоровительных мероприятий в отношении инфекционных и инвазионных болезней сельскохозяйственных животных. Такой метод обеззараживания навоза называется биотермическим, он повсеместно используется в животноводческой практике.
Бактерии для переработки навоза
Навоз (особенно рогатого скота и помет домашней птицы) имеет очень высокую ценность как удобрение. Главный вопрос при повторном использовании навоза — как сохранить его агрономическую ценность (главным образом, содержание азота). Перед применением навоз необходимо компостировать или перерабатывать его со специальными микробиологическими добавками.
Препараты серии Агростар – это высокоэффективные биологические соединения на основе селекционированных микроорганизмов и энзимов, предназначенные для глубокой переработки навоза и помета в интенсивном сельском хозяйстве.
Для хозяйств, использующих гидросмыв. При хранении в резервуарах навоз имеет тенденцию к отстаиванию. На поверхности образуется корка, жидкость в центре и осадок на дне. Со временем осадок затвердевает, его становится трудно откачивать, и большая часть того, что откачано, является жидкостью, которая имеет наименьшую агрономическую ценность. (Промывка водой частично решает проблему осадка, но все равно происходит потеря агрономических элементов, остаивание на дне, и сокращение объема хранения).
Для обработки в буртах, так как навоз перемешан с соломой, требуется смесь микроорганизмов, способных разлагать лигнин и целлюлозу. Технология внесения зависит от имеющейся техники. Нужно обеспечить в бурты поступление воздуха, необходимую влажность и укрытие от прямых солнечных лучей в течение 6-8 месяцев
Для промышленного использования используются специальные микробиологические препараты. Высокое качество и эффективность.
· улучшает усвоение питательных веществ растениями,
· сжижаются твердые части навоза, и сохраняют их в жидком состоянии.
· предотвращает образование корки на поверхности вещества и осадка на дне отстойников.
· удерживается Азот в навозе,
· жидкость становится более гомогенной
· уменьшаются затраты на откачку и/или перемешивание,
· улучшает равномерность распределения навоза по полям,
· эффективен при высокой влажности навоза,
· уменьшает неприятный запах на 60 % (что особенно важно при внесении навоза на поля),
· после удобрения пастбищ позволяет животным возвращаться раньше на луга, улучшают аппетит рогатого скота,
· значительно снижается количество мух в стойлах.
В хозяйствах, имеющих и животноводство, и растениеводство переработанный навоз может частично заменить до 30% минеральных удобрений. Самый лучший результат дает применение навоза при недостатке азота. Также он добавляет углерод и небольшое количество фосфора (калий не вносит). Навоз перерабатывается и свежий и старый. Обработанный навоз обладает дополнительными преимуществами:
Традиционно куриный навоз считается наиболее ценным, но его нельзя применять без предварительной обработки. Биоактиватор Агрозим очень хорошо перерабатывает его в форму, которая легко усваивается растением.
Свиной навоз наиболее сложен для вторичного применения. Для него есть специально разработанный препарат Липастар, который может работать при анаэробных условиях на дне резервуара хранения
Для достижения высоких результатов обработку необходимо проводить регулярно.
Крупный рогатый скот
(голов)
1 корова производит 35 кг навоза в день. Свинья – 7 кг в день. Кролик или курица – 50 кг в год.
На 100 коров поддержание – 35 кг (навоз за день) х 100 голов х 7 дней в неделю = 24500 кг примерно равно 25 м. куб. Расход препарата 25 кг х 20 г = 500 г. Цена 775 рублей.
Доза препарата для навоза, добавившегося за неделю составляет: 20 г на 1 куб. м. навоза КРС, кур, кроликов; 10 г на 1 куб. м. навоза свиньи (т. к. свиной навоз жиже коровьего).
Перед первым применением биоактиватора необходимо очистить отстойник от навоза, если это не возможно для застарелых загрязнений можно применить шокотерапию из расчета 1 кг препарата на 1 куб. м. навоза.
Способ применения: Хорошо перемешать необходимое количество вещества в воде (температурой от15 до 30 град. С), в соотношении 1 часть вещества на 10 частей воды. Максимально равномерно распределить полученный раствор в навозе. Хранить в сухом, прохладном месте, избегая попадания прямых солнечных лучей.
Лабораторная работа №10
Тема: Микробиология мяса и яиц
Лабораторное исследование мяса и мясных продуктов.
Лабораторное исследование мяса, сырых мясных продуктов, полуфабрикатов и готовых мясных изделий проводят по методикам, изложенным в действующих стандартах и инструкциях.
Бактериологическое исследование мяса и мясопродуктов.
Бактериологическое исследование мяса и мясопродуктов проводят во всех случаях, предусмотренных разделами 3, 4 и 5 настоящих Правил, для решения вопроса их использования.
Бактериологическое исследование также проводят:
• во всех случаях вынужденного убоя животных независимо от причин убоя, в том числе при отравлениях или подозрении на отравление ядами, а также при подозрении, что мясо получено от больных животных или убитых в состоянии агонии;
• при желудочно-кишечных заболеваниях, при тяжело протекающих заболеваниях дыхательных органов, гнойных нефритах, нефрозах, при септико-пиемических заболеваниях, при обнаружении серозных и фибринозных перикардитов у свиней, а также при подозрении на наличие сальмонелл;
• при удалении кишечника из туши позднее двух часов после убоя животного;
• при наличии сомнений в отношении пригодности мяса и невозможности определить пригодность его в пищу путем ветеринарно-санитарного осмотра.
В зависимости от предполагаемого диагноза и характера патолого-анатомических изменений для бактериологического исследования направляют: часть мышцы сгибателя или разгибателя передней и задней конечностей туши, покрытую фасцией длиной не менее 8 см, или кусок другой мышцы не менее 8 х 6 х 6 см; лимфатические узлы — от крупного рогатого скота — поверхностный шейный или собственно подкрыльцовый и наружный подвздошный, а от свиней — поверхностный шейный дорзальный (при отсутствии патологоанатомических изменений в области головы и шеи) или подкрыльцовый первого ребра и надколенный; селезенку, почку, долю печени с печеночным лимфоузлом (или при отсутствии лимфоузла — желчный пузырь без желчи). При взятии части печени, почки и селезенки поверхность разрезов прижигают до образования струпа. При исследовании полутуш или четвертин туш для анализа берут кусок мышцы, лимфатические узлы и трубчатую кость. При исследовании мяса мелких животных (кролики, нутрии) и птицы в лабораторию направляют тушки целиком. При исследовании соленого мяса, находящегося в бочечной таре, берут образцы мяса и имеющиеся лимфатические узлы сверху, из середины и со дна бочки, а также при наличии — трубчатую кость и рассол. При подозрении на рожу, помимо мышцы, лимфатических узлов и внутренних органов, в лабораторию направляют трубчатую кость.
Для бактериологического исследования на листериоз направляют головной мозг, долю печени и почку.
При подозрении на сибирскую язву, эмкар, злокачественный отек для исследования направляют лимфатический узел пораженного органа или лимфатический узел, собирающий лимфу с места локализации подозрительного фокуса, отечную ткань, экссудат, а у свиней, кроме того, подчелюстной лимфоузел.
Взятые для исследования пробы с сопроводительным документом направляют в лабораторию во влагонепроницаемой таре, в запломбированном или опечатанном виде. При направлении проб на исследование в производственную лабораторию того же предприятия, где пробы были отобраны, нет необходимости их опечатывать или пломбировать. В сопроводительном документе указывают вид животного или продукта, принадлежность их (адрес), какой материал направлен и в каком количестве, причину направления материала для исследования, какие установлены в продукте изменения, предполагаемый диагноз и какое требуется произвести исследование (бактериологическое, физико-химическое и т. д.).
При установлении лабораторным исследованием инфекционных болезней, при которых животных не допускают к убою, тушу вместе со шкурой уничтожают, проводят все мероприятия, предусмотренные соответствующими инструкциями.
При обнаружении в продуктах убоя возбудителей инфекционных болезней, тушу и внутренние органы используют, как указано в соответствующих пунктах настоящих Правил.
Если в туше или органах обнаружены сальмонеллы, внутренние органы направляют на утилизацию, а мясо направляют на проварку или переработку на мясные хлеба или консервы в порядке, как указано настоящих Правилах.
Если в мышечной ткани или лимфатических узлах будет обнаружена кишечная палочка, то мясо направляется для переработки на вареную или варено — копченую колбасу. При выделении кишечной палочки только из внутренних органов последние перерабатывают, а туши выпускают без ограничений.
При обнаружении в глубоких слоях мускулатуры или лимфатических узлах бактерий кокковой группы, а также гнилостных микробов (в особенности из группы протея), но при хороших органолептических показателях, свидетельствующих о гнилостном разложении мяса и мясопродуктов, или при несвойственном им запахе, не исчезающем при пробе варки, такое мясо и мясопродукты направляют на техническую утилизацию или уничтожают.
До получения результатов бактериологического исследования мясо и субпродукты подлежат хранению в изолированных условиях при температуре не выше +4(С.
Тема: Микробиология яиц.
Производство каждого продукта обусловливает необходимость химического, физического и микробиологического контроля на базе все более широкого развития науки с той целью, чтобы в процессе производства всегда имелась необходимая информация. Без этого сейчас невозможно создавать новый продукт.
Таким образом, для внедрения технологических линий и всей новой продукции необходим целый ряд мероприятий по контролю за качеством, которые в обязательном порядке должны применяться для постоянного соблюдения всевозрастающих требований к качеству продукции.
Хотя через торговлю реализуют куриные яйца, но в продажу могут попасть яйца других видов птицы. По размеру, форме, цвету скорлупы не представляет больших трудностей распознать гусиные и индюшиные яйца. Особое значение имеет разделение утиных и куриных яиц, ибо очень часто утиные яйца заражены сальмонеллой.
В среднем куриные яйца весят 50—60 г, скорлупа белого или коричневого цвета, на которой поры в большинстве случаев можно увидеть и невооруженным глазом. В противоположность куриным яйцам масса утиных 60—70 г, скорлупа с зеленоватым оттенком, гладкая, блестящая, кажется, что покрыта масляным налетом, поры на скорлупе не видны невооруженным глазом. Однако эти различия не всегда проявляются четко настолько, чтобы на основе объективных особенностей различить между собой куриные и утиные яйца. Однако в составе скорлупы имеются различия (в основном не связанные с кормлением). По методу
Веттзела (1967) с помощью фотометрии определяют содержание магния в скорлупе. Полученный результат позволяет различить утиные и куриные яйца. Разработан метод определения утиных и куриных яиц на основе серологического анализа состава белка. При таком анализе можно достигнуть результата и в том случае, если яйцо подвергнуто небольшой тепловой обработке.
Просвечивание, описанное выше, позволяет определить размер пуги, состояние белка и желтка.
Контроль качества яиц включает и определение факта мойки яиц. При просвечивании ультрафиолетовыми лучами скорлупа флюоресцирует красным и голубым цветом. На ней можно наблюдать серые пятна, с которых было смыто загрязнение. Довольно результативно можно использовать метод погружения яиц в раствор красок, когда окрашенную кутикулу можно отделить от известковой скорлупы, если до этого она не была смыта при мойке (в таком случае это место не окрашивается).
После разбивания яйца органолептическим путем оценивают его содержимое. Определяют показатели сырого яйца: цвет, запах, консистенцию; после варки яйца всмятку без добавления соли — соответствие вкуса, цвета и запаха требованиям стандарта или отмечают какие-либо отклонения от них.
Удельная плотность представляет один из характерных физических свойств яйца, знание которого служит дополнительным показателем при определении качества. Полученное соотношение между объемом и массой указывает на изменение качественных показателей яйца. Удельную плотность определяют следующим образом: яйцо взвешивают с точностью до сотой доли грамма, определяют его объем на основе объема вытесненной воды и массу яйца делят на его объем. Удельную плотность белка или желтка определяют после гомогенизации анализируемого материала с помощью прибора удельной плотности.
О возрасте яйца можно судить по индексу желтка и белка. Содержимое яйца выливают на плоское стекло. Желток свежего яйца сохраняет свой круглый вид, не разливается и лишь на небольшой площади окружается белком, в котором можно отчетливо разграничить плотный и жидкий слой. Индекс яйца определяют по высоте (высотомером) и ширине (штангенциркулем) разлитого на стекле яйца. Для расчета индекса используют следующие соотношения: индекс желтка — высота: ширина; индекс белка — высота плотного белка: средняя ширина.
Для лучшей оценки результат измерения умножают на 10 000.
Величину рН белка и желтка определяют отдельно. За изменением содержимого яйца можно проследить на основе определения коэффициента преломления. На фактический коэффициент преломления влияет много факторов (содержание воды, удельная плотность, возраст яйца и т. п.). Полученный коэффициент можно использовать только для сравнения яиц одного вида и возраста. Измерение производят рефрактометром Авве с использованием натриевой лампы.
Определение окраски желтка в отдельных случаях также необходимо для оценки качества яйца.
При анализе качества яйцепродукции (меланжа, яичного порошка) определяют органолептические показатели.
Проба регулируется предписаниями действующих стандартов. Для лабораторного анализа перед проведением органолеп-тического анализа из взятой пробы готовят водную эмульсию. Для этого к 20 г яичного порошка добавляют 60 мл воды, все растворяют и оставляют на 15 мин в покое. Без добавления жира эмульсию поджаривают на слабом огне горелки. Прожаренный образец после остывания до комнатной температуры анализируется. Необходимо определить, имеются ли отклонения при производстве порошка: его обработке (пастеризации) и изготовлении (распылении).
После пастеризации жидкой яичной массы необходим контроль коллоидного состояния. При отклонении от режима обработки может иметь место определенная коагуляция продукта. Этот дефект пастеризации можно установить на основе сравнения показателей вязкости до и после термической обработки. Вязкость жидких яйцепродуктов целесообразно измерять ротационным вискозиметром. Для этих же целей можно использовать определение содержания растворимого сухого вещества.
Показатель растворимости яичного порошка можно использовать для обнаружения производственного дефекта. В целях получения более достоверных результатов был разработан оригинальный метод: готовят раствор яичного порошка с известным содержанием порошка, определяют коэффициент преломления рефрактометром и по нему количество растворенного сухого вещества. На основании полученного показателя рассчитывают процент растворенного яичного порошка.
Эффективность пастеризации яичной массы, кроме технологического контроля, целесообразно проверить и другими способами, например, используя пробу с альфа-амилазой (тепловая обработка повреждает амилазу, содержащуюся в целом яйце). Следовательно, если тепловая обработка была соответствующей (не менее 64°С в течение 2,5 мин), то из пастеризованной пробы нельзя выделить амилазу. Этот метод контроля очень прост и основывается на том, что альфа-амилаза разлагает крахмал, который не дает характерную йодисто-крахмальную цветовую реакцию.
Во время хранения в меланже в яичном порошке могут происходить нежелательные химические и микробиологические изменения, в результате которых происходит распад белков и жиров. О процессах окисления жировой фазы меланжа или яичного порошка можно получить представление путем определения кислотного и перекисного чисел.
Порча яиц может происходить от чисто ферментативного процесса без присутствия бактерий или от проникновения через скорлупу микроорганизмов. Факт порчи устанавливают просвечиванием. После разбивания яйца анализируют внутреннее содержимое. Микробиологический анализ обычно проводят в соответствии с методами микробиологического контроля других пищевых продуктов. Посев производят на элективной или селективной питательной среде из желтка или белка, а также из их смеси.
Наиболее распространено заражение скорлупы яиц в основном смешанной микрофлорой энтеробактерий: Pseudomonas, Alcaligenes, Aeromonas, Micrococcus, Bacillus. Зародыши бактерий проходят через поры скорлупы и микротрещины, а также попадают внутрь в результате неправильной обработки (неквалифицированная мойка, повреждение кутикулы). Здесь начинается первое размножение микроорганизмов, в результате которого в основном размножаются грамотрицательные бактерии. Какие популяции, какие гнилостные бактерии будут развиваться, зависит от условий хранения, и прежде всего от температуры.
При температуре до 30 °С прежде всего размножаются Pseudomonas, и тем быстрее, чем ниже температура. При высокой температуре размножаются Acinetobacter, а при температуре около 37 °С господствующей флорой станут бактерии Coli. В процессе хранения снижается активность воды, что препятствует развитию грамотрицательных бактерий, поэтому опять на передний план выступают более стойкие Micrococcus. Однако развитие бактерий происходит не всегда, ибо бактерицидные вещества белка (например, кональбумин) подавляют рост грамотрицательных бактерий.
Вместе с температурой на размножение бактерий влияют влажность и среда хранения. Так, при более продолжительном хранении белок яйца расплывается и желток соприкасается со скорлупой. На месте контакта особенно легко растут микроорганизмы или образуется плесень.
Все виды микробного разложения приводят к характерным изменениям в белке, которые легко заметить при просвечивании или разбивании яйца.
Зеленое гниение вызывается микробами группы Rseudomonas. В этом случае белок сильно флюоресцирует под ультрафиолетовыми лучами.
Красное гниение заметно при просвечивании в виде красной окраски. Из этих яиц в большинстве случаев можно выделить бактерии Coli или другие виды энтеробактерий. Белое гниение вызывают Micrococcus. Белок и желток смешиваются между собой. Протеолитические бактерии, которые продуцируют сероводород, образуют черное гниение. Чаще всего здесь группы Proteus.
Липолитические виды (Pseudomonas и отдельные Bacillus) вырабатывают характерные ароматические вещества.
В отдельных случаях в яйца проникают и различные патогенные бактерии.
В данном случае рассматриваются только те патогенные возбудители болезней, которые встречаются в яйцах и представляют интерес с точки зрения здравоохранения.
Часто яйца заражаются различными сальмонеллами. В куриных яйцах иногда встречаются Salmonella sgallindrum или ее другие виды, в то время как в утиных и гусиных яйцах чаще обнаруживают Salmonella typhimurium. Хотя к виду S. gallina человеческий организм малочувствителен, но в яйцах сырого потребления не должно быть этого вида сальмонелл (в майонезах, кремах и т. п.). К тяжелым последствиям может привести игнорирование санитарно-гигиенических требований, когда зараженные яйца после просвечивания в хозяйстве направляют на реализацию в качестве пищевых яиц. В таких яйцах среди микрофлоры могут быть сальмонеллы, вызывающие заболевание человека.
Бесчисленное число научных сообщений свидетельствует о том, что при употреблении утиных яиц возможны пищевые отравления.
На основе проведенных исследований в Венгрии установлено, что сальмонеллы с поверхности скорлупы яйца в течение 24 ч могут проникнуть в желток. Во многих странах запрещено использовать утиные яйца в качестве пищевого продукта. Тепловая обработка с повышенной температурой не гарантирует от отравления.
Согласно наблюдениям даже при употреблении в пищу поджаренной яичницы из утиных яиц возможно пищевое отравление.
Яйцепродукты (меланж, яичный порошок) также могут содержать различные микроорганизмы. Бактериологическая чистота этих продуктов должна проверяться после завершения их производства.
Бацилла птичьего туберкулеза может находиться в яйце. Она вызывает заболевание у человека, но известны такие публикации, которые однозначно подтверждают заболевание человека от бациллы — Micobacterium avium.
Заболевание птичьим туберкулезом кур-несушек в Венгрии встречается только у поголовья в личном приусадебном хозяйстве.
Установлено, что в начальной стадии острого заболевания при отсутствии патологических изменений в яичнике часто находятся бактерии туберкулеза. При хроническом характере болезни снижается яйценоскость или полностью прекращается, поэтому проникновение в яйцо возбудителя болезни в это время наблюдается весьма редко. Яйца от больных туберкулезом кур-несушек при их сыром употреблении могут вызвать заражение потребителя.
В целях предупреждения заражения яйца от больного поголовья кур запрещено реализовать такие яйца.
Лабораторная работа №11
Тема: Микробиология молока и молочных продуктов
Оценка качества молока. Для оценки качества молока берут среднюю пробу в количестве 250 мл. Перед взятием проб молоко тщательно перемешивают в емкостях мутовкой. Пробы молока берут металлической или пластмассовой трубкой диаметром 9 мм. При взятии пробы молока из разных партий пробник каждый раз нужно прополаскивать исследуемым молоком. Взятые пробы охлаждают до 2-4 С. При этой температуре они сохраняются в течение двух суток. Для более длительного хранения проб молока к 100 мл молока добавляют 2-3 капли 30 %-ной перекиси водорода. Молоко, консервированное химическими веществами, нельзя исследовать па кислотность и бактериальную обсемененность.
Примесь в молоке воды можно выявить с помощью пробы Похельсона. Для исследования в пробирку наливают 1 мл исследуемого молока, прибавляют 2 капли 10 %-ного раствора хромовокислого калия и 1 мл 0,5 %-ного раствора азотнокислого серебра. Пробирку с содержимым встряхивают. Кондиционное молоко окрашивается в лимонно-желтый цвет, а молоко, разбавленное водой,- в кирпично-красный. Чтобы определить количество добавленной к молоку воды, исследуют жир.
Определение жира (ГОСТ 5867-69). Для определения содержания жира в молоке используют сернокислотный метод (Гербера). Под действием крепкой серной кислоты вместе с белками молока растворяется оболочка жировых шариков, в результате чего выделяется жир в чистом виде. Затем с помощью изоамилового спирта и центрифугования его отделяют от молока и концентрируют в градуированной части жиромера.
При определении количества жира необходимо строго соблюдать последовательность в исполнении операций, особое внимание обращая па соблюдение правил техники безопасности.
В чистые жиромеры, пронумерованные и установленные в штативы, вливают автоматической пипеткой по 10 мл крепкой серной кислоты (плотность 1,81-1,82), потом специальной пипеткой добавляют 10,72 мл хорошо перемешанного молока. Молоко надо вливать по стенке жиромера, стараясь не смешивать его с серной кислотой. Затем автоматической пипеткой прибавляют еще 1 мл изоамилового спирта (плотность 0,810-0,811) и закрывают жиромеры сухими резиновыми пробками. Жиромер с содержимым встряхивают до полного растворения белков. Затем его ставит пробкой вниз в водяную баню при температуре 65 С на 5 мин. Вынув из бани и обтерев полотенцем жиромер, вставляют в патрон центрифуги пробкой к периферии и центрифугируют в течение 5 мин со скоростью об/мин. Жиромер снова помещают в водяную баню на 5 мин при температуре 65 С. Затем с помощью винтообразных движений пробки устанавливают столбик на делениях шкалы и отсчитывают по нижнему мениску содержание жира в процентах.
Определение чистоты. Чистота молока является показателем санитарных условий на ферме. Ее определяют с помощью прибора «Рекорд», через который фильтруют 250 мл молока, а затем сравнивают осадок на фильтре со специальным эталоном (ГОСТ 8218-56) (рис. 1).
Рис. 1. Эталон для определения степени чистоты молока:
1 — молоко чистое (I группа); 2 — слегка загрязненное (II группа); 3 — загрязненное (III группа).
В зависимости от количества загрязнений молоко по степени чистоты делят на три группы:
I группа — на фильтре нет видимых загрязнений — молоко по чистоте хорошего качества;
II группа — на фильтре имеются отдельные частицы грязи — молоко удовлетворительного качества;
III группа — на фильтре много примесей (волоски, частицы подстилки и т. д.) — молоко плохого качества.
Загрязненность молока, надоенного каждой дояркой, определяют не менее трех раз в месяц. Образцы фильтров с указанием фамилий доярок вывешивают на специальном стенде.
Определение кислотности (ГОСТ 3624-70). Парное молоко имеет кислотность 16-18 Т. Обычно молоко с кислотностью выше 25 Т свертывается при кипячении, а при кислотности выше 60-65 Т наступает самопроизвольное свертывание молока при комнатной температуре.
Для определения кислотности наливают в коническую колбу 10 мл молока, 20 мл дистиллированной воды и 3 капли 1 %-ного спиртового раствора фенолфталеина. Содержимое колбы тщательно перемешивают и прибавляют из бюретки в колбу каплями 0,1 %-ный раствор щелочи до появления слабо-розового окрашивания, не исчезающего в течение минуты. Количество миллилитров, потраченное на титрование щелочи, умноженное на 10, будет показывать градус титруемой кислотности молока.
На мясо-молочных контрольных станциях пользуются методом определения предельной кислотности, равной 20 Т. Для исследования в пробирку наливают 10 мл дистиллированной воды, 1 мл 0,1 н. раствора едкого натра и 3 капли 2 %-ного спиртового раствора фенолфталеина. В пробирку с указанным раствором вносят мл исследуемого молока и смешивают. Если розовое окрашивание смеси не исчезает, то молоко имеет кислотность не более 20 Т. Молоко, имеющее кислотность выше 20 Т, является несортовым.
Определение молока коров, больных маститом. Для выявления маститного молока в луночки специальной пластинки наливают по 1 мл исследуемого молока и добавляют 1 мл димастина, мастидина, маститодиагноста, маститопроба пли другого индикатора и перемешивают стеклянной палочкой. Маститное молоко образует сгусток. Смесь молока с индикатором здоровых коров гомогенная.
Определение степени обсеменения молока микробами. Бактериальную обсемененность молока определяют с помощью редуктазной или резазуриновой пробы.
Редуктазную пробу применяют для определения степени обсеменения молока микрофлорой. Сущность ее основана на установлении биохимической активности микробов, продуцирующих фермент редуктазу, которая способна обесцвечивать некоторые краски, в частности метиленовую синь. Этой способностью обладают также лейкоциты, аскорбиновая кислота и некоторые другие вещества, содержащиеся в молоке. В основу метода положено определение времени, необходимого для обесцвечивания метиленовой сини. Преимущество редуктазной пробы в сравнении с прямым бактериологическим методом состоит в быстроте получения результате (примерно через 5,5 ч). Однако не все микроорганизмы обладают редуцирующей активностью. В большей степени это свойство имеют молочнокислые стрептококки, кишечные палочки, маслянокислые и гнилостные бактерии, несколько меньше — сальмонеллы и стафилококки, а возбудители мастита стрептококковой этиологии лишены этой способности. Поэтому молоко может содержать большое количество стрептококков, вызывающих мастит, а по редуктазной пробе оно будет отнесено к первому классу. Кроме того, эта проба дает завышенные результаты летом и почти бесполезна зимой. Другими словами, молоко II и III класса после двухсуточного охлаждения при 4-5 С по редуктазной пробе дает показатели I класса. Следовательно, редуктазная проба с метиленовой синью дает весьма неточное представление о степени бактериальной обсемененности молока и его санитарном качестве. Поэтому показатели редуктазной пробы необходимо учитывать в комплексе с другими результатами исследований.
Для постановки редуктазной пробы в пробирку 20 мл молока добавляют 1 мл рабочего раствора метиленовой сини и плотно закрывают пробкой. После перемешивания пробирку помещают в водяную баню при температуре 37-40 С, наблюдая за временем обесцвечивания метиленовой сини через 20 мин, 2 и 5,5 ч. Для приготовления рабочего раствора берут 5 мл насыщенного спиртового раствора метиленовой сини и добавляют 195 мл дистиллированной воды.
Молоко относят к I классу, если обесцвечивание метиленовой сини происходит через 5,5 ч. В молоке II класса обесцвечивание происходит за 2-5,5 ч. Молоко III класса обесцвечивается в период от 20 мин до 2 ч. Время наступления обесцвечивания содержимого пробирки указывает на приблизительное количество в исследуемом молоке микроорганизмов, продуцирующих фермент редуктазу.
Резазуриновая проба. Преимущество резазурина состоит в том, что он обладает более высоким окислительно-восстановительным потенциалом, что ускоряет исследование. На показатели резазуриновой пробы температура молока не оказывает заметного влияния. Весьма важно, что этой пробой выявляется молоко коров, больных субклиническим маститом различной этиологии. Существенный недостаток резазуриновой пробы — это светочувствительность индикатора резазурина. Для устранения данного недостатка (1971) предложил раствор резазурина готовить в сочетании с формальдегидом. При этом в 100 мл дистиллированной воды растворяют 0,05 г резазурина и добавляют 0,5 мл формальдегида. Для исследований к 10 мл молока добавляют с помощью автомата-клювика 1 мл индикатора и после перемешивания помещают на час в водяную баню при температуре 44 С. Реакцию учитывают с момента, когда температура в контрольной пробирке достигнет 43 С. Для контроля делают пробу с кипяченым молоком. Учет реакции проводят через час. Если в течении часа не изменился первоначальный серо-голубой цвет смеси, то молоко относят к I классу; фиолетовый цвет соответствует II и розовый — III классу.
Преимущество резазуриновой пробы в указанной модификации состоит в том, что она ускоряет время проведения анализа почти в 5 раз, более чувствительная к выявлению примесей маститного молока в сравнении с редуктазной пробой, не требует периодического наблюдения и более демонстративна при учете результата анализа.
Определение кетоновых тел. В молоке здоровых коров кетоновых тел нет. Появление их в молоке чаще наблюдается у высокопродуктивных коров в первые недели после отела при избыточном кормлении животных концентрированными белковыми кормами и без достаточного количества в рационе углеводистых сочных кормов. Кетоновые тела токсичны для человека и животных.
Для определения кетоновых тел к 10 мл молока добавляют 5 г сернокислого амония, 0,1 мл 5%-ного водного раствора нитропрусида натрия и 2 мл концентрированного аммиака. Пробирку с содержимым встряхивают и через 5 мин читают результат: пурпурная окраска — реакция резко положительная (+++), ярко-розовая — реакция положительная (++), слабо-розовая окраска — реакция слабо положительная (+). При положительной реакции на кетоновые тела молоко бракуют.
Определение соды в молоке. В пробирку с 1 мл молока добавляют равное количество 0,2%-ного спиртового раствора розоловой кислоты. При наличии в молоке соды появляется малиново-красный цвет.
Определение крахмала. В пробирку с 5 мл молока добавляют 3 капли 5%-ного раствора йода. При наличии крахмала молоко окрашивается в синий цвет.
Нитритная проба. Нитриты обнаруживаются в молоке при скармливании лактирующим коровам недоброкачественного свекловичного жома, а также при нарушении правил скармливания свеклы.
Для определения нитрита в пробирку наливают 10 мл исследуемого молока и добавляют по стенке пробирки 0,5 мл 10%-ного водного раствора реактива Грисса. В зависимости от концентрации в молоке нитрита реакция может наступить через 30-40 с в виде розовой или красной полоски в местах соприкосновения реактива с молоком (большая концентрация). При небольшой концентрации в молоке нитритов реакция наступает через 3-5 мин. При положительной реакции на нитраты молоко нельзя допускать в пищу людям. Одновременно необходимо изменить рацион лактирующих коров.
Лабораторная работа №12-№13
Микробиологические исследование зерна и круп
Микробиологическое исследование овощных и плодовых культур.
Микрофлора крупы. В первую очередь микрофлора крупы определяется составом микрофлоры перерабатываемого зерна.
Степень обсеменения микроорганизмами свежеубранного зерна крупяных сельскохозяйственных культур, как и зерна одной и той же культуры, может значительно различаться.
В одном грамме доброкачественного зерна (пшеницы, ячменя, проса, риса, овса, гречихи) насчитывается от тысяч до миллионов бактерий, но по качественному составу микрофлора их близка между собой. Она представлена преимущественно (до 90 % и более) бактериями, количество плесеней (спор) не более 5–7%, дрожжей еще меньше. Среди бактерий преобладает (до 80–90%) бесспоровая, факультативно-аэробная палочковидная бактерия гербикола (травяная палочка Erwinia herbicola) –типичный представитель эгшфитной микрофлоры зерна злаков. В небольших количествах встречаются микрококки, молочнокислые бактерии, а также спорообразующие аэробные бактерии, представленные главным образом картофельной и сенной палочками (по новой номенклатуре обе эти бактерии отнесены к виду Bacillus subtilis). В грибной флоре свежеубранного зерна обычно присутствуют Alternaria, Clado-sporium, Ascochyta. Пенициллы и аспергиллы обнаруживают в небольших количествах.
По мере хранения зерна в условиях, не допускающих развития микроорганизмов, число их на зерне снижается за счет отмирания Erwinia herbicola, хотя она остается преобладающей формой. Принято считать, что большое количество этих бактерий на зерне служит показателем его хорошего качества. Значительно изменяется состав грибной флоры. Доминирующими компонентами становятся пеницилловые и аспергилло-вые грибы (получившие название «плесени хранения»), а типичные представители свежеубранного зерна – «полевые плесени»– сохраняются в единичных количествах.
Микрофлора различных видов крупы непосредственно после выработки близка по составу, но по количеству беднее микро-
флоры перерабатываемого зерна. Имеет значение характер предварительной обработки зерна (степень шелушения, шлифовки и др.). Микрофлора одного и того же вида крупы может быть различной и в зависимости от особенностей технологии ее производства. Например, крупа, полученная из зерна, подвергшегося гидротермической обработке (пропариванию), обсеменена микробами в меньшей степени, чем крупа, полученная* из непропаренного зерна (табл. 23). Помимо микроорганизмов зерна, в крупе имеется вторичная микрофлора, попавшая из окружающей среды в процессе выработки крупы.
Количество бактерий в 1 г крупы составляет 10*–-10 5 , а плесени (споры) – Ю 2 –10 3 , за исключением кукурузной крупы, которая обычно обсеменена спорами грибов в большей степени (табл. 23). Преобладающим компонентом бактериальной флоры крупы, выработанной из непропаренного зерна, является (до 70–90% общего числа) гербикола, а для крупы из зерна, прошедшего гидротермическую обработку, характерно преобладание спороносных бактерий (35–50 %) и микрококков (10– 20%). Из бацилл чаще обнаруживают Bacillus subtilis, В. pumilus. Грибная флора крупы представлена в основном видами Penicillium (P. cyclopium, P. viridicatum и др.) и Aspergillus (A. candidus, A. flavus, A. repens). В небольшом коли-стве встречаются мукоровые грибы.
Многие найденные в крупах бактерии и плесени способны разлагать белки, липиды, крахмал, пектиновые вещества и сбраживать сахара с образованием кислот. Некоторые пенициллы могут, хотя и медленно, расти при температуре до –2, –5°С, аспергиллы сухоустойчивы и способны развиваться при влажности субстрата, равновесной относительной влажности воздуха 70–75%- Некоторые обнаруживаемые в крупах плесени вырабатывают токсичные вещества. Поэтому крупы в период длительного хранения могут подвергаться различным видам порчи под воздействием микроорганизмов и находящихся в крупе ферментов. Возможность и интенсивность развития микробов определяются в первую очередь влажностью крупы, которая меняется при хранении продукции в зависимости от величины относительной влажности воздуха. Имеет значение и температура хранения: чем выше влажность крупы, тем более широк интервал температур возможного развития микроорганизмов.
При опытном хранении товарных образцов различных видов » крупы (пшено, кукурузная, ячневая, перловая, овсяная, рис, овсяные хлопья, ядрица, ядрица быстроразваривающаяся) в различных температурно-влажностных условиях установлено (К- А. Мудрецова-Висс и Е. В. Куликова), что по мере удлинения срока хранения во всех крупах снижается число бактерий главным образом ввиду вымирания эпифита зерна – Ег-winia herbicola. Через полгода хранения при 70–75 %-ной относительной влажности воздуха и температуре 15–16 °С
сохраняется 25–40 % бактерий от их первоначального количества, а через год–10–15%; преимущественно это споровые формы. Число плесеней (спор) на крупах, сохраняемых в тех же условиях, практически не изменяется. На крупах, сохраняемых при той же температуре, но при 80 %-ной относительной влажности воздуха к четвертому – шестому месяцу, а при 85 %-ной – ко второму-третьему месяцу хранения активно развиваются плесени. Плесневение вызывают сухоустойчивые виды Aspergillus: A. repens, A. candidus, A. chevalieri.На крупах, выработанных из пропаренного зерна, плесени развиваются интенсивнее, чем на крупах из непропаренного зерна; при низких положительных температурах (4–5°С) плесневение крупы обнаруживается на несколько месяцев раньше.
Микрофлора муки. Микрофлора свежемолотой муки, как и крупы, в основном представлена микроорганизмами перерабатываемого зерна. Основная масса состоит из бактерий, среди которых преобладает (до 90%) Erwinia herbicola. На втором месте стоят спорообразующие бактерии, доминирующими из которых являются картофельная и сенная палочки. В небольших количествах имеются Bacillus pumilus, В. cereus var. my-coides, различные микрококки, молочнонокислые и уксуснокислые бактерии, а также дрожжи и споры плесеней. Среди плесеней преобладают виды родов Penicillium и Aspergillus, встречаются мукоровые грибы. Микрофлора муки количественно беднее микрофлоры перерабатываемого зерна, так как при его очистке перед помолом и в процессе помола значительное количество микроорганизмов удаляется вместе с загрязнениями и оболочками зерна, которые богаты микробами. Степень обсеменения муки микроорганизмами колеблется в широких пределах и определяется не только степенью обсеменения перерабатываемого зерна, но и характером подготовки его к помолу (способом очистки, применением и режимом кондиционирования– увлажнения с последующим отволаживанием), а также способом помола, выходом муки и ее сортом.
Проведенные (МИНХ имени Г. В. Плеханова) в производственных условиях на нескольких партиях пшеницы исследования изменения микрофлоры зерна в процессе подготовки к помолу показали, что сухая очистка зерна снижает его обсемененность бактериями на 25–40%, спорами плесеней –на 20–30, а сухая очистка с последующей мойкой – соответственно на 45–60 и 30–40%. Холодное кондиционирование (при температуре воды около 20°С) с короткой (до 6–7 ч) отлежкой увлажненного зерна не изменяет состав микрофлоры. Увеличение времени отволаживания (более 10–12 ч) приводит к повышению числа бактерий на зерне и тем больше, чем длительнее оно отлеживается.
В табл. 24 приведены данные по распределению микроорганизмов зерна, поступающего на размол, по конечным продуктам помола при выработке пшеничной хлебопекарной муки по схеме трехсортового помола с общим выходом муки 75– 78.%. Поступающее на размол зерно содержало в 1 г бактерий от 1,2 · 10 5 до 1,1-10 6 , спор плесеней – от 100 до 300.
Чем ниже сорт муки, чем больше в нее попадает периферийных частиц зерна, тем больше содержится в ней микроорганизмов. Количество спор плесеней в муке всех сортов (чем ниже сорт, тем больше) превышает содержание их в перерабатываемом зерне. Продукты помола при прохождении через машины (драные, размольные) обсеменяются спорами плесеней в результате соприкосновения частичек муки с отделяющимися оболочками зерна, с производственной аппаратурой, с потоком воздуха, используемого в производственном процессе.
Мука – продукт менее стойкий по отношению к микробной порче, чем зерно и крупа, питательные вещества в ней более доступны микроорганизмам. Однако развитие их при правильном режиме хранения (при относительной влажности воздуха не более 70%) предотвращается малым содержанием в муке влаги; наблюдается даже постепенное отмирание вегетативных клеток бактерий. С повышением относительной влажности воздуха микроорганизмы, находившиеся в муке в неактивном состоянии, начинают развиваться, и в первую очередь развиваются плесени, так как они способны расти при меньшем содержании влаги (при более низком значении aw), чем бактерии. Многие из обнаруженных в муке плесеней обладают протеолитической и липолитической активностью, способны осахаривать крахмал. Хлебопекарные свойства муки при их развитии снижаются. Она приобретает неприятный затхлый запах, который обычно передается хлебу.
Плесневение муки – наиболее распространенный вид ее порчи. Плесневелая мука небезопасна: на ней обнаруживают Aspergillus и Penicillium, способные продуцировать микоток-сины, многие из которых термостойки и могут сохраниться в хлебе.
Прокисание муки происходит при ее увлажнении в результате развития кислотообразующих бактерий (молочнокислых и др.).
Прогоркание муки часто обусловлено окислением липидов муки кислородом воздуха при участии липоксигеназы муки, но этот дефект может быть и микробной природы.
Допустимым пределом для длительного (2–3 года) хранения зерновых продуктов при 15–20°С принято считать содержание в них влаги, эквивалентное относительной влажности воздуха 65%. Влажность, равновесная относительной влажности воздуха 72–75%, считается предельной для хранения зерновых продуктов в течение нескольких (3–4) месяцев.
Микрофлора хлеба. При производстве хлеба качество муки и состав ее микрофлоры имеют большое значение для нормального процесса тестоведения и отражаются на качестве теста и готового хлеба.
Наряду с физическими и биохимическими превращениями, протекающими в тесте (как из пшеничной, так и из ржаной муки) во время его созревания, большая роль принадлежит дрожжам и молочнокислым бактериям.
В производстве пшеничного хлеба при изготовлении теста применяют пекарские прессованные или сухие дрожжи (см. с. 222), а также жидкие дрожжи и жидкие пшеничные закваски, изготовляемые непосредственно на хлебозаводах.
Хлебопекарные дрожжи должны быть устойчивыми к повышенной концентрации среды, размножаться при повышенной температуре и обладать высокой бродильной мальтазной активностью, так как в тесте накапливается преимущественно сахар мальтоза. Образующийся в процессе брожения углекислый газ разрыхляет тесто, и оно увеличивается в объеме. Другие продукты жизнедеятельности дрожжей придают хлебу своеобразные вкус и аромат.
Жидкие дрожжи представляют собой активную культуру дрожжей, выращенную на мучной питательной среде, предварительно осахаренной и заквашенной (до определенной кислотности) термофильной молочнокислой бактерией палочкой Дельбрюка. Высокая кислотность среды благоприятствует развитию дрожжей исдерживает рост имеющейся в тесте посторонней микрофлоры, угнетающей жизнедеятельность дрожжей.
При изготовлении жидких дрожжей применяют чистые культуры различных производственных рас вида Saccharomyces
ceevisiae, чаще расы Краснодарскую, Щелковскую 4, Ростовскую 2, Московскую 23.
В закваске всегда имеется также некоторое количество молочнокислых бактерий.
Жидкие пшеничные закваски – это смешанная культура на осахаренной мучной среде активных дрожжей S. cerevisiae и мезофильных молочнокислых бактерий гомоферментативной палочки Lactobacillus plantarum и гетероферментативной L. Ьге-vis, развивающихся в среде спонтанно или вносимых в виде чистых культур. Гетероферментативные молочнокислые бактерии, помимо кислот, образуют углекислый газ, поэтому они играют некоторую роль в разрыхлении теста. Выделяемые ими в значительных количествах летучие кислоты способствуют улучшению аромата и вкуса хлеба.
Хлеб, полученный на жидких дрожжах и жидких заквасках, не только обладает более приятным вкусом, но реже болеет тягучей болезнью (см. с. 221) и медленнее черствеет по сравнению с хлебом, изготовляемом с использованием только прессованных дрожжей. В пшеничном тесте на прессованных дрожжах молочнокислых бактерий мало; они попадают в основном из муки, их участие в созревании теста незначительно.
В производстве ржаного хлеба тесто готовят на заквасках, которые, как и пшеничные закваски, являются смешанными культурами дрожжей и молочнокислых бактерий, что обеспечивает разрыхление теста и накопление кислот. Соотношение молочнокислых бактерий к дрожжам составляет 80:1, а в пшеничном тесте 30:1, т. е. в созревании ржаного теста ведущая роль принадлежит молочнокислым бактериям.
Ржаные закваски бывают густыми и жидкими. Жидкие готовят на осахаренной жидкой среде из ржаной муки с применением чистых культур различных рас дрожжей видов S. cerevisiae, S. minor. Из гомоферментативных молочнокислых бактерий применяют Lactobacillus plantarum (иногда вводят L. casei), из гетероферментативных – L. brevis и L. fermentum.
В настоящее время на большинстве заводов и густые закваски готовят на чистых культурах дрожжей (S. minor) и молочнокислых бактерий (L. plantarum и L. brevis).
Дрожжи S. minor несколько уступают по энергии брожения виду S. cerevisiae, но отличаются большей кислотоустойчиво-стью.
Высокая кислотность ржаного теста (рН 4,2–4,3) благоприятно воздействует на белки ржаной муки, улучшает ее хлебопекарные свойства и препятствует развитию в тесте и хлебе микроорганизмов – возбудителей порчи.
В тесте, помимо используемых производственных микроорганизмов, всегда находятся посторонние, попадающие с сырьем и из внешней среды. Их активное развитие нарушает нормальное течение процессов брожения и созревания теста. Таковыми являются, например, поступающие с прессованными дрожжами
и из муки дикие дрожжи рода Candida. Эти дрожжи в брожении не участвуют, но отрицательно воздействуют на бродильную активность производственных дрожжей.
Поверхность хлеба при выходе из печи практически стерильна, но мякиш прогревается только до 95–98 °С и в нем всегда сохраняется какое-то количество бактериальных спор.
Во время охлаждения, последующего транспортирования, хранения и реализации хлеба споры могут прорасти, а размножение в мякише образовавшихся клеток приведет к порче хлеба.
Возбудителями тягучей (картофельной)болезни хлеба являются спорообразующие бактерии Вас. subtilis. Споры этих бактерий термоустойчивы, в муке они всегда присутствуют и в отдельных видах (в муке 2-го сорта и обойной) в немалых количествах. Источником инфекции может быть также оборудование, воздух производственных цехов хлебозаводов. Бактерии вызывают гидролиз крахмала с образованием большого количества декстринов, но они чувствительны к повышенной кислотности среды, поэтому тягучей болезни подвержен преимущественно пшеничный хлеб, имеющий по сравнению с ржаным хлебом невысокую кислотность. В начале развития заболевания хлеб приобретает посторонний фруктовый запах, затем мякиш ослизняется, темнеет, становится липким, тянется нитями. Пораженный хлеб не пригоден в пищу.
Для предотвращения тягучей болезни хлеб после выпечки быстро охлаждают до температуры 10–12 °С и хранят при этой температуре в хорошо вентилируемом помещении.
Рекомендуется подкислять тесто уксусной, пропионовой, сорбиновой кислотами или их солями. В тесто из пшеничной муки предложено вводить закваски чистых культур пропионо-вокислых бактерий или мезофильной молочнокислой палочки Lactobacillus fermentum. Угнетающее действие этой бактерии на Вас. subtilis обусловлено не только подкислением среды, но и выделением антибиотических веществ.
Возбудителями меловой болезни являются дрожже-подобные грибы (из эндомицетовых грибов). Они попадают в тесто с мукой и сохраняются при выпечке хлеба; инфицирование готового хлеба может происходить и извне.
Болезнь сначала проявляется на поверхности хлеба, затем по трещинам распространяется внутрь мякиша в виде белых сухих порошкообразных включений, сходных с мелом. Хлеб теряет товарный вид, приобретает неприятный вкус.
Плесневение – наиболее распространенный вид порчи хлеба – чаще возникает при неправильном режиме хранения. При слишком плотной укладке, повышенной влажности и температуре споры плесеней, попавшие на выпеченный хлеб извне (из воздуха, при контакте с инфицированными предметами), быстро развиваются, особенно если корка хлеба с трещинами. Плесневение хлеба чаще вызывают грибы родов Penicillium,
Aspergillus, Mucor. Многие из них вызывают гидролиз белков, крахмала; хлеб приобретает неприятные затхлый запах и вкус. Заплесневелый хлеб в пищу не пригоден, так как может содержать микотоксины. В хлебе, пораженном аспергилловыми грибами, обнаружены афлатоксины (Г. Шпихер); концентрировались они в основном в наружных слоях хлеба, но выявлялись и в мякише.
Для борьбы с плесневением хлеба предлагают различные методы: обработку поверхности хлеба или упаковочного материала химическими консервантами (этиловым спиртом, солями пропионовой и сорбиновой кислот); стерилизацию упакованного хлеба токами высокой частоты, ионизирующими излучениями. Хороший эффект дает замораживание хлеба. Однако основными мероприятиями на хлебозаводах, обеспечивающими высокое качество хлеба, являются строгое соблюдение установленного режима технологии производства, содержание в должной чистоте оборудования, систематическая дезинфекция производственных помещений.
Хлеб – продукт, употребляемый в пищу без дополнительной кулинарной обработки, поэтому на всех стадиях его производства, при хранении, транспортировании и реализации должны строго выполняться установленные санитарные требования.
Производство пекарских дрожжей. Пекарские прессованные и сухие дрожжи вырабатывают на специализированных дрожжевых заводах. Питательной средой при выращивании дрожжей служит осветленная, очищенная и разбавленная водой свекловичная меласса – отход свеклосахарного производства. В ней содержатся необходимые для дрожжей сахара и многие другие питательные вещества; дополнительно добавляют азот-и фосфорсодержащие соли. Температура мелассной среды при выращивании дрожжей поддерживается на уровне около 30 °С, рН 4,5–5,5. Среда интенсивно аэрируется (непрерывно подается воздух). В таких условиях дрожжи дышат, а не бродят. Большая часть сахара используется ими для синтеза веществ клетки, при этом дрожжи активно размножаются. По накоплении определенного количества дрожжевых клеток их отделяют от среды, промывают водой, сгущают и прессуют до содержания влаги 73–75 %. Полученную дрожжевую массу формуют в виде брикетов с содержанием дрожжевых клеток в количестве 8–12 млрд. в 1 г. Брикеты упаковывают в бумагу и охлаждают до температуры 4°С.
Сушеные дрожжи выпускают с влажностью 8–10%. При производстве пекарских дрожжей используют такие расы Saccharomyces cerevisiae, которые хорошо размножаются в мелассовой питательной среде, обладают высокой бродильной активностью, стойки при хранении в прессованном виде, а также при высушивании. В настоящее время выращивают преимущественно расы Киевскую 21, Одесскую 14 и гибриды № 196–6 и 176, выведенные в Институте генетики АН СССР. Эти расы обладают многими положительными для дрожжевого производства признаками.
В процессе производства дрожжей в дрожжерастительные аппараты вместе с сырьем, задаточными дрожжами и из внешней среды попадают посторонние микроорганизмы. Развиваясь совместно с производственными дрожжами, они неблагоприятно влияют на технологический процесс, снижают выход и качество готовой продукции.
Наиболее нежелательными являются быстро размножающиеся дрожжи родов Torulopsis и Candida, которые не способны к брожению или бродят очень слабо, но интенсивно используют сахар и другие питательные вещества среды. Выход готовой продукции при активном размножении этих дрожжей может даже несколько увеличиваться, но прессованные дрожжи получаются с пониженными хлебопекарными свойствами и менее стойки в хранении.
Из бактерий наиболее опасны гнилостные – сенная и картофельная палочки, а также гетероферментативные молочнокислые бактерии рода Leuconostoc. Лейконостоки могут ослизнять мелассную среду, склеивать дрожжи в комки. В результате выход дрожжей снижается, затрудняется их промывка и прессование, ухудшается товарный вид прессованных дрожжей.
Наличие гнилостных бактерий и диких дрожжей в пекарских прессованных дрожжах выше допустимого количества (20–30%) является показателем их низкого качества.
Прессованные дрожжи – скоропортящийся продукт. Они могут подвергаться гнилостными бактериями порче в виде размягчения, вплоть до разжижения с образованием неприятного запаха. Сохранять прессованные дрожжи следует на холоде.
Основной причиной потерь свежих плодов и овощей в период после сбора являются микробные поражения.
В течение длительного времени свежие плоды и овощи остаются жизнеспособными, в них протекают различные физиологические процессы, свойственные растительным организмам.
Однако в отличие от вегетирующих растений в снятых плодах и овощах преобладают диссимиляционные процессы (дыхание), в них сохраняется также функция транспирации (испарение воды). У разных плодов и овощей в зависимости от их происхождения и видовых особенностей эти процессы протекают с различной интенсивностью.
Чем интенсивнее биохимические процессы, тем быстрее происходят в плодах и овощах глубокие и необратимые изменения,
характеризующие их старение. По мере старения плодов и овощей лежкоспособность их падает, ухудшается внешний вид. Они постепенно разрыхляются, теряют вкусовую и питательную ценность, снижается способность сопротивляться заболеваниям, на них начинают развиваться различные микроорганизмы.
Рациональные методы хранения свежих плодов и овощей предусматривают создание условий (температуры, влажности воздуха, газового состава среды), которые замедляют процессы, ведущие к старению и перезреванию, способствуют сохранению природных иммунных свойств плодов и овощей и одновременно тормозят развитие микроорганизмов.
Устойчивость (иммунитет) растений к микробным поражениям обусловлена многими факторами. Существенное значение имеет их анатомическое строение, особенно строение покровов. Кожица (ее толщина, наличие опробковевших клеток, кутикулы, воскового налета) является мощным защитным барьером проникновению микробов в сочные ткани (мякоть) плодов и овощей. Большую роль играет также их химический состав, наличие веществ, тормозящих развитие микроорганизмов, например красящих (антоцианов, флавонолов), эфирных масел и особенно фитонцидов.
Многие из этих веществ сосредоточены главным образом в кожице плодов и овощей и в прилегающих к ней клетках мякоти. Поэтому покровы являются не только механическим препятствием, но и неблагоприятно воздействуют на микроорганизмы.
Кроме природных защитных свойств, живые органы растений обладают способностью активно реагировать на внедрение в них возбудителя болезни (патогена). В основе ответных защитных реакций инфицированных органов лежит изменение их обмена веществ. Усиливается фитонцидная активность, активизируются ферментативные процессы (например, окисление фенольных соединений), приводящие к образованию токсичных для микробов веществ. В ответ на внедрение патогена в клетках, граничащих с зоной поражения, вырабатываются и накапливаются новые, специфические антимикробные вещества (преимущественно фенольной природы) – фитоалексины. Возникает как бы химический барьер на пути распространения гриба-патогена. В результате тормозится его развитие, он может и погибнуть.
Микрофлора свежих плодов и овощей.На поверхности плодов и овощей постоянно находятся различные микроорганизмы, значительная часть которых не принимает участие в процессах заболеваний и порчи и находится в неактивном состоянии. Если кожица не повреждена, то на ее поверхности имеется обычно незначительное количество питательных веществ, поэтому на ней могут существовать и размножаться только немногие виды микроорганизмов, которые составляют так
называемую эпифитную микрофлору. Видовой состав и численность ее зависят от вида растений, географических, климатических и прочих условий их произрастания.
Наиболее характерными представителями эпифитной микрофлоры плодов и ягод являются дрожжи, молочнокислые, уксуснокислые бактерии, различные спороносные бактерии, а также споры грибов. Значительно разнообразнее по составу и обильнее микрофлора овощей и плодов, у которых повреждена поверхность (побитых, с трещинами даже микроскопической величины, с содранной кожицей), так как вытекающий из поврежденных тканей сок служит питательной средой для микроорганизмов.
На 1 см 2 поверхности здоровых плодов и овощей находятся тысячи и десятки тысяч бактерий, сотни и сотни тысяч дрожжей и спор плесеней, а на поврежденных – миллионы плесеней и дрожжей, миллионы и сотни миллионов бактерий.
Повреждения поверхности плодов и овощей не только способствуют увеличению количества эпифитных микроорганизмов, но служат также причиной инфекции извне специфическими возбудителями заболеваний и порчи. На плоды и овощи могут попасть (из почвы, воздуха, с тары, от людей, участвующих в сборе, упаковке, реализации) и патогенные для человека микроорганизмы (дизентерийные, брюшнотифозные бактерии, сальмонеллы и др.). Сроки выживания этих бактерий на плодах и овощах достаточно велики. На огурцах, зеленом луке, помидорах и редисе сальмонеллы выживают при комнатной температуре 6–12 дней, дизентерийные палочки – 1–7 дней, а при пониженной температуре сроки выживания удлиняются (Л. И. Адельсон). Поэтому при реализации и переработке свежих плодов и овощей необходимо соблюдать санитарные требования.
В период длительного хранения плодов и овощей поражение их микроорганизмами может привести к большим потерям продукции. Этому способствуют неправильные способы заготовки, перевозки и хранения (плохая подготовка хранилищ, закладка плохо просушенной продукции, подмораживание ее, повышенная влажность и температура в хранилищах и т. п.).
Болезни плодов и овощей (гнили) вызываются чаще (особенно плодов) плесневыми грибами и реже дрожжами и бактериями. В первую очередь портятся поврежденные и перезрелые плоды и овощи. Некоторые грибы поражают их еще в период произрастания, резко снижая урожайность. Преобладание плесневых грибов в процессах порчи плодов обусловлено прежде всего высоким содержанием в них углеводов, а для многих – кислой реакцией их соков.
Однако в результате развития грибов снижается количество органических кислот, повышается рН соков, что создает условия для развития бактериальной флоры. Нередко процесс порчи плодов и овощей, начатый грибами, сопровождается за-
тем деятельностью различных бактерий. Существуют заболевания, называемые бактериозами, которые с самого начала вызываются специфическими бактериями. У овощей, содержащих большее по сравнению с плодами количество белковых веществ и имеющих менее кислую реакцию сока, бактериальные поражения встречаются чаще. Возбудителями их являются как бесспоровые бактерии (чаще родов PseudomonasnErwinia), так- и спороносные (Bacillus subtilis, В. polymyxa, В. mace-rans). У пораженных плодов и овощей ткани подвергаются распаду – мацерации; при этом они темнеют и размягчаются иногда до разжижения. Бактериозы плодов и овощей наносят большой экономический ущерб.
Грибные заболевания начинаются с прорастания спор гриба на поверхности кожицы и последующего внедрения проростков (гиф) в мякоть плодов и овощей.
Большинство грибов, поражающих плоды и овощи в период после их съема до реализации, являются раневыми паразитами; они способны проникать в плод лишь через повреждения кожицы или через ее естественные отверстия (устьица, чечевички). Поэтому бережное обращение с плодами и овощами на всех этапах их продвижения от момента сбора до реализации, т. е. сохранение целостности их покровов,– один из главных путей снижения потерь этих ценных продуктов питания. Даже незаметные повреждения (проколы, царапины, потертости), наносимые плодам и овощам во время уборки, упаковки и перевозки, способствуют их быстрой порче.
Грибы, поражающие плоды и овощи преимущественно после съема, относят к факультативным паразитам. Они развиваются на мертвых тканях, гибель которых вызывают сами, выделяя токсичные для растительных клеток вещества.
Под действием выделяемых грибами гидролитических ферментов (пектолитических, целлюлазы) разрушаются межклеточные пластинки и оболочки клеток мякоти плодов и овощей, происходит деструкция – распад тканей.
Грибы обладают разнообразными экзо- и эндоферментами, позволяющими расщеплять полимерные соединения клеток и тканей растения на более простые вещества, доступные для усвоения. Происходят глубокие изменения веществ, входящих в состав плодов и овощей.
Аминокислоты, сахара, органические кислоты, минеральные вещества и другие соединения используются грибами для синтеза веществ их клеток и расходуются в процессе дыхания. Накапливаются различные метаболиты грибов (аммиак, некоторые органические кислоты и др.), токсичные для растительных клеток.
Интенсивность развития болезней плодов и овощей зависит от их устойчивости в отношении гриба – возбудителя болезни, от активности возбудителя и условий среды.
Так, по данным К. А. Мудрецовой-Висс и С. А. Колесник,
при искусственном инфицировании яблок различных помологических сортов возбудителем мягкой зеленой гнили (Penicillium expansum) плоды одних сортов, хранившиеся при 18°С, заболевали на 2–3-й день, плоды других сортов – на 7–8-й, а плоды некоторых наиболее устойчивых сортов – лишь на 12–14-й день после заражения. Неодинакова и поражаемость плодов одного помологического сорта различными патогенами. Например, яблоки сорта Джонатан, инфицированные возбудителем плодовой гнили (Monilia fructigena), заболевали на 1–2-е сутки, а инфицированные возбудителем черного рака (Sphaeropsis malorum)–на 7–10-е сутки после заражения.
Большинство грибов, поражающих плоды н овощи при хранении, холодоустойчивы и способны развиваться при температуре до –5°С. Однако снижение температуры хранения плодов и овощей значительно замедляет развитие заболеваний. Так, кочаны белокочанной капусты, инфицированные возбудителем альтернариоза (Alternaria brassicae), при 18 °С заболевали на 1–3-й день, а при 2–1 °С – на 10–12-й день.
Порча плодов, и особенно ягод, вызывается и дрожжами, которые сбраживают сахар в этиловый спирт и углекислый газ. При этом плоды и ягоды приобретают спиртовой привкус, а иногда и прокисают ввиду развития дрожжей и уксуснокислых бактерий.
Возбудители отдельных видов порчи или болезней плодов и овощей были описаны выше (см. гл. 1). Ниже приводится краткая характеристика наиболее распространенных грибных и бактериальных заболеваний при хранении плодоовощной продукции.
Болезни картофеля и томатов (помидоров). Наиболее распространенной и опасной болезнью ботвы и клубней картофеля, вызываемой грибом фитофторой (Phytophthora infestans), является картофельная гниль, или фитофтороз. На пораженных листьях появляются бурые пятна, на которых образуется белый пушок – скопление мицелия и спороносящих органов гриба. Опадая, они попадают на здоровые листья и в почву. Клубни картофеля поражаются грибом, таким образом, еще в поле, и особенно во время уборки при соприкосновении пораженной ботвы с пораненными участками клубня.
На пораженных клубнях образуются свинцово-сероватые, а затем бурые вдавленные пятна с покрывающим их беловатым налетом из спороносящих гиф гриба. На срезе клубня обнаруживаются побуревшие участки загнившей ткани в виде зубчиков на границе со здоровой тканью (рис. 38). На гифах мицелия гриба, распространяющегося по межклетникам пораженной ткани, образуются выросты-присоски, внедряющиеся в клетки, содержимое которых служит для патогена источником пищи.
При хранении недостаточно просушенных клубней или в условиях повышенной влажности и температуры заболевание
клубней развивается очень быстро. Особенно поражаются фи-тофторозом ранние сорта картофеля.
На пораженных фитофторой клубнях часто начинают развиваться другие плесневые грибы (сапрофиты) и бактерии, которые ускоряют и углубляют процесс порчи и часто переводят его в стадию мокрой гнили, клубни при этом размягчается и издают неприятный запах. Обычно болезнь проявляется в начальный период хранения, когда в хранилищах еще
Рис. 38. Фитофтороз картофеля:
а – пораженный клубень (продольный разрез); б – спорангиеносец со спорангиями; в – прорастающий спорангий; г – зооспора; д – мицелий фитофторы в клубне
относительно тепло, и может вызвать массовую порчу картофеля. Гриб может зимовать на растительных остатках в почве в виде зигот или хламидоспор.
Сухая гниль картофеля, или фузариоз, вызывается грибами рода Fusarium. Клубни поражаются грибом в поле и в хранилищах. Грибы неприхотливы к температурным условиям, переносят температуру –2, –5°С, но хорошо развиваются лишь при повышенной влажности воздуха. Болезнь быстро передается от больных клубней здоровым.
Наиболее часто фузариум поражает клубни, зараженные фитофторой, а также клубни с наружными механическими повреждениями или подмороженные. На поверхности клубней
появляются выпуклые различной окраски подушечки, представляющие собой мицелий гриба с массой конидиеносцев (рис.39).
При пониженной влажности воздуха в хранилище пораженные клубни в дальнейшем сморщиваются, высыхают, местами превращаются в плотную серовато-белую крахмалистую массу. На клубне образуется зональная складчатость, а внутри клубней часто появляются заполненные мицелием полости. Высохшие клубни имеют темно-бурую окраску.
При повышенной влажности заболевание переходит в мокрую гниль. Это заболевание картофеля проявляется особенно во второй половине периода зимнего хранения.
Кольцевая гниль картофеля – поражение сосудисто-проводящей системы клубня (проявляющееся почернением
Рис. 39. Фузариоз (сухая гниль) картофеля:
а – пораженный клубень; б – споры (макроконидии) фузариума; в – клубень в разрезе ‘
ее), вызывается аэробной слегка изогнутой палочковидной бактерией рода Коринебактериум (Corynebacterium sepedoni-cum). Проводящие сосуды закупориваются бактериями. Камбиальное кольцо размягчается, при надавливании выступают капельки слизи.
Мокрая бактериальная гниль картофеля вызывается комплексом бактерий, из которых наиболее активны Pseudomonas syringae и Erwinia carotovora var. carotovora (бесспоровые, подвижные, палочковидные бактерии), обитающие в почве. При поражении мокрой гнилью клубни картофеля размягчаются и превращаются в серую кашицеобразную массу с неприятным запахом. Бактерии поражают чаще всего клубни, поврежденные фитофторой или другими грибами, а также подмороженные. Болезнь довольно быстро распространяется в хранилище и является причиной больших потерь картофеля.
Парша картофеля существует в нескольких формах. Наиболее распространена обыкновенная парша, вызываемая различными видами почвенных актиномицетов, чаще Streptomyces scabiens. На кожице появляются растрескивающиеся небольшие выпуклости-коростинки коричневого цвета. Клубень приобретает неприятный, землистый запах. Заражение происходит еще в почве.
Фитофтороз томатов – распространенное заболевание листьев и плодов томатов, вызываемое грибом фитофторой (Phytophthora infestans). Болезнь проявляется в виде расплывчатых коричневых твердых пятен на поверхности плодов различного возраста, но особенно поражаются недозрелые плоды (рис. 40). Пораженная ткань плодов становится светло-коричневой. Заболевание
приносит большие потери урожая. Черная бактериальная пятнистость томатов вызывается бесспоровыми аэробными бактериями рода Ксантомонас (Xanthomonas vesicatoria). Пораженные плоды покрываются темными выпуклыми точками, окруженными водянистой каймой. Развитию заболевания способствует высокая влажность.
Водянистая гниль томатов, вызываемая бесспоровыми бактериями рода Erwinia (E. carotovora), проявляется
в форме прозрачных пятен водянистой консистенции. Мякоть плода разрушается и превращается в жидкую бесцветную массу с неприятным запахом. Кожица плода сморщивается и часто растрескивается. Особенно поражаются недозрелые плоды.
Черная пятнистость томатов вызывается грибом Alter -naria solani. На пораженных плодах образуются резко ограниченные темные округлые вдавленные пятна, покрытые черным налетом.
Болезни корнеплодов. Наиболее распространенными заболеваниями корнеплодов являются различные гнили.
Белая гниль моркови и других корнеплодов, вызываемая грибом склеротиния (Scle-rotinia sclerotiorum). Мицелий гриба внедряется в ткани корнеплодов, образуя местами на поверхности белые пушистые налеты, выделяющие капельки влаги. Через некоторое время мицелий, уплотняясь, превращается в пленку, на которой появляются в больших количествах склероции в виде черных желваков величиной с горошину (рис. 41). Мякоть корнеплодов размягчается, становится кашицеобразной бурого цвета. В ус-
Рис. 40. Фитофтороз плода томатов
Рис. 41. Белая гниль моркови:
а – поражение грибом Scleroti-
nia; б, β – склероции (внешний
ловиях повышенной влажности даже при относительно низких температурах гриб быстро переходит с одного корнеплода на другой и нередко в течение короткого времени поражает всю партию.
Черная сухая гниль моркови (альтерн а р и оз) вызывается грибом альтернария (Alternaria radicina).Ha верхушке корнеплода и с боков появляются темно-черные сухие вдавленные пятна, превращающиеся в черные язвы (рис. 42). На срезе больная ткань корнеплода угольно-черного цвета резко отграничена от здоровой.
Серая гниль моркови – распространенное поражение в период хранения корнеплодов, вызываемое грибом ботрити-сом (Botrytis cinerea). Ткань корнеплода становится мягкой, мокнущей приобретает буроватый цвет. На поверхности корнеплода образуется обильный серого цвета налет, состоящий из мицелия и множества ко-нидиеносцев. Позднее на мицелии появляются в большом количестве мелкие склероции.
Фомоз моркови вызывается грибом фома (Phoma rostrupii). На корнеплоде образуются серые сухие слегка вдавленные пятна. Ткань под ними сухая, порошистая, трухлявая, коричневого цвета. В ней обнаруживаются пустоты, выстланные мицелием гриба. На пораженных участках корнеплода развиваются спороносящие органы гриба – пикниды –
Рис. 42. Черная сухая гниль моркови
в виде мелких выпуклых черных точек. Гриб поражает морковь еще в поле, при хранении заболевание прогрессирует. Сильнее поражаются недозревшие или перезревшие корнеплоды.
Мокрая бактериальная гниль вызывается бесспоровыми палочковидными бактериями. Особенно активной является Erwinia carotovora. Пораженные участки корнеплодов быстро превращаются в слизистую неприятно пахнущую массу.
Сердцевинная гниль свеклы является широко распространенным видом порчи этого корнеплода, вызываемой грибом Phoma betae.’ Поражение начинается с головки и затем распространяется по всему корнеплоду. На пораженных местах имеются бурые вдавленные пятна, при разрезе которых обнаруживается гниющая ткань черного цвета. При хранении заболевание быстро распространяется на здоровые корнеплоды.
Болезни капусты и лука. Наиболее распространенной формой порчи белокочанной капусты является серая гниль, вызываемая грибом ботритис (Botrytis cinerea). Поверхность кочанов покрывается пушистым серым налетом (мицелий с кони-диеносцами), отсюда и название болезни – «серая гниль».
Обилие легко рассыпающихся спор (конидий) способствует распространению инфекции в хранилище. На пораженных листьях обнаруживается масса черных склероциев гриба раз-
личного размера. Листья темнеют, ослизняются, гниют и издают неприятный запах.
Черная пятнистость, или альтернариоз, капусты вызывается грибом Alternaria brassicae. На пораженных листьях образуются более или менее резко очерченные плотные черные пятна. Нередко пораженные участки листа выпадают и образуются дырочки.
Сосудистый бактериоз – опасное поражение капусты, вызываемое бесспоровой палочковидной холодоустойчивой бактерией рода Ксантомонас (Xanthomonas campestris).
При этом чернеют жилки (система сосудисто-волокнистых пучков) листьев, темнеет и прилегающая к ним перенхимная ткань. Капуста поражается при выращивании и хранении.
Слизистый бактериоз вызывается бесспоровыми бактериями рода Эрвиния (Erwinia carotovora и Ε. carotovora vaar. carotovora). Болезнь проявляется в виде мокрой гнили кочерыги. При поражении в период произрастания кочанов они недоразвиваются и отваливаются. При активном развитии заболевания в период хранения кочанов поражается не только кочерыга, но и наружные листья; они ослизняются, гниют и издают неприятный запах. Потери капусты от этого заболевания большие. Шейковая гниль лука –самая распространенная и опасная болезнь репчатого лука при хранении (рис. 43), вызываемая грибом ботритис (Botrytis allii). Сначала загнивает шейка луковицы, при этом она размягчается. Затем гриб распространяется на сочные чешуи и они становятся желтовато-розовой окраски, водянистыми, как бы вареными. Поверхность луковицы на кроющих чешуях покрывается серым налетом (мицелий с конидиеносцами). Среди мицелия образуются мелкие черные склероции, сливающиеся в сплошную корочку.
Фузариоз лука вызывается грибом фузариумом (Fus-arium cepae). Пораженные чешуи луковицы буреют и размягчаются. Луковица с поверхности покрывается белым налетом. Поражение начинается с донца луковицы, в связи с чем заболевание называют «донцевой гнилью». В хранилищах болезнь распространяется быстро.
Болезни плодов. Очень распространенным заболеванием яблок и груш является плодовая, или коричневая, гниль (монилиоз), вызываемая грибом монилия (Monilia fruc-tigena). На кожице плодов появляются характерные буровато-коричневые пятна, которые быстро разрастаются и захваты-
вают весь плод. Мякоть плода буреет, размягчается и становится губчатой. Позднее на поверхности пораженных участков плода появляются желтовато-серые бородавочки (подушечки), располагающиеся нередко концентрическими кольцами (рис. 44). Они представляют собой скопления органов спороношения гриба с цепочками бесцветных конидий на концах.
При повышенной влажности и благоприятной температуре болезнь развивается очень быстро. Часто при понижении температуры пораженные плоды чернеют, твердеют, поверхность их становится блестящей, как бы лакированной, и плоды превращаются в так называемые «мумии». В этих мумифицированных плодах гриб переходит в покоящуюся стадию – склероции. Мумифицированные плоды являются опасными очагами инфекции.
Монилия (М. cinerea) поражает также косточковые плоды (абрикосы, персики, вишню). Болезнь называется серой плодовой гнилью.
Монилия считается бичом плодовых садов. При холодильном хранении яблоки и груши поражаются монилиозом меньше, чем другими грибами-патогенами.
Черный рак яблок и груш вызывается несовершенным грибом Sphaeropsis malorum. Начальная стадия заболевания плодов напоминает монилиоз – пораженные участки буреют и размягчаются. По мере развития заболевания пораженные участки темнеют, становятся неоднородными (с темными зонами) и на них появляются серо-черные точечные бугорки («сыпь»), представляющие собой скопления спороносящих органов гриба (пикниды). Плоды сморщиваются и нередко мумифицируются; блестящая черная поверхность их шероховата за счет кучно расположенных на ней пикнид. Гриб поражает не только плоды, но и цветки, ветви, кору стволов яблонь. Больная кора является главным источником инфекции.
В период хранения яблоки широко поражаются грибами Penicillium expansum, Alternaria tenuis, Botrytis cinerea.
Рис. 43. Шейковая гниль лука:
α –пораженная луковица; б – кони-диеноеец с конидиями паразита
Рис. 44. Плодовая гниль:
а – пораженное яблоко; б – кони-диальное епороношение монилии
Penicillium expansum вызывает мягкую зеленую гниль (рис. 45). На кожице образуются светло-коричневые стекловидные пятна, на которых появляются серо-голубые, позднее зеленеющие комочки (скопления конидиеносцев с окрашенными конидиями). Кожица вдавливается, растрескивается. Мякоть плода буреет, размягчается, иногда до разжижения. Поражение яблок этим грибом в отдельные годы составляет 80–90 % всех поражений. Пеницилл, развиваясь на яблоках, способен продуцировать токсичное для человека и животных вещество – патулин.
Alternaria tenuis вызывает черную пятнистость. Больные участки плода буреют, затем чернеют, уплотняются.
Рис. 45. Мягкая зеленая гниль:
α – пораженное яблоко (в начальной стадии); б – конидиеносцы пеницилла
На поверхности развивается оливковый, затем чернеющий мицелий с многоклетными темно-коричневыми конидиями.
Botrytis cinerea вызывает серую мягкую гниль. Пораженные участки мякоти приобретают коричневую окраску и значительно размягчаются. Плод становится дряблым. При повышенной влажности и температуре заболевание быстро охватывает весь плод. На поверхности обнаруживается сероватый пушок–спороносящий мицелий гриба. Позднее на нем образуются склероции в виде мелких жестких черных желвачков. Botrytis нередко развивается как вторичный патоген, т. е. после проникновения в плод типичного раневого патогена Penicillium expansum.
Гниль цитрусовых плодов в период хранения вызывают преимущественно грибы из рода Penicillium.
P. italicum образует на поверхности плодов зелено-голубые налеты с узкой белой каймой из мицелия; кожица плодов при этом размягчается, вдавливается. Особенно быстро плесневеют поврежденные и перезрелые плоды. При низких температурах (от 2 до 0 °С) плесень почти не развивается.
P. digitatum образует на поверхности плода сначала белый налет, приобретающий затем оливково-зеленый цвет (за счет окраски конидий). Мякоть размягчается, становится водянистой, горькой.
Лимоны и мандарины при хранении нередко поражаются грибом альтернарией (Alternaria citri). Ткань плодов у их основания и внутри чернеет в результате развития мицелия черно-зеленоватой окраски. Пораженные участки размягчаются. Бережное обращение с плодами и овощами, быстрое охлаждение их после сбора, закладка на длительное хранение только здоровой продукции, систематическое наблюдение за ее состоянием в период хранения, своевременное удаление испорченных плодов, содержание хранилищ в чистоте, санитарная обработка тары, соблюдение установленного режима хранения (температуры и влажности воздуха) являются необходимыми мероприятиями и обязательными требованиями для снижения потерь свежих плодов и овощей от микробных поражений.
Для удлинения срока хранения плодов и овощей в свежем виде эффективным является их холодильное хранение в модифицированной газовой среде – в атмосфере с повышенным содержанием углекислого газа и со сниженным содержанием кислорода. В таких условиях задерживается старение плодов и овощей, длительнее сохраняется иммунитет по отношению к микроорганизмам. Кроме того, такой состав атмосферы тормозит прорастание спор грибов и несколько снижает рост и активность некоторых грибов-патогенов. Помимо хранения свежих плодов и овощей в регулируемой атмосфере предлагается обработка продукции химическими консервантами (бромистым метилом, дифенилом, йодкрахмалом и др.). Для малолежких сортов плодов, особенно ягод, рекомендуется радуризация небольшими дозами (0,2–0,3 Мрад) у-излучений, позволяющая несколько продлить сохраняемость продукции, что имеет значение в пик сезона ее поступления на перерабатывающие предприятия (А. А. Кудряшова и др.). Большое количество плодов и овощей подвергается быстрому замораживанию, при этом их микробная порча исключается ввиду низкой температуры хранения (–18 °С). Однако на них всегда сохраняются жизнеспособные микроорганизмы, поэтому после размораживания плоды и овощи довольно быстро могут подвергаться микробной порче.
Микрофлора квашеных и соленых плодов и овощей. В основе консервирования плодов и овощей квашением и солением лежит использование молочнокислого и отчасти спиртового брожения для подавления роста микроорганизмов – потенциальных возбудителей порчи (гнилостных бактерий, маслянокис-лых и др.). Одновременно продукт приобретает новые пищевые и вкусовые качества.
Молочнокислое и спиртовое брожение возникает в перерабатываемом сырье (капусте, огурцах, помидорах и др.) обычно самопроизвольно (спонтанно) и вызывается находящимся на нем молочнокислыми бактериями и дрожжами.
При квашении капусты ее измельчают, пересыпают солью (2–3 %), перемешивают с морковью (иногда добавляют
яблоки), плотно укладывают в емкости и кладут гнет, оставляют ее под давлением. Соль вызывает плазмолиз клеток листьев капусты. Выделяющийся сок содержит сахар и другие питательные для микроорганизмов вещества.
В начальной стадии процесса развиваются различные аэробные бактерии и дрожжи (занесенные с сырьем), продуцирующие тв небольшом количестве кислоты (уксусную, муравьиную, молочную), спирт и углекислый газ. Благодаря выделению дышащими растительными клетками углекислого газа и газов, образующихся при брожении, создаются анаэробные условия, благоприятствующие развитию молочнокислых бактерий. В первую очередь развивается гетероферментативная молочнокислая бактерия лейконосток (Leuconostoc mesenterioides), образующая сравнительно немного кислоты. Одним из продуктов обмена лейконостока являются эфиры, придающие заквашиваемому продукту характерный запах. На смену этой бактерии приходят палочковидные молочнокислые бактерии. Основная роль в процессе квашения капусты принадлежит гомофермен-тативной мезофильной бактерии Lactobacillus plantarum. Раз-виваются^ и гетероферментативные бактерии, в частности кислотоустойчивая бактерия L. brevis, а также дрожжи, вызывающие спиртовое брожение. Количество молочнокислых бактерий достигает миллионов в 1 см 3 .
Скорость сквашивания капусты зависит от температуры. Оптимальной является температура около 20°С, при которой брожение протекает обычно за 6–8 суток.
Образующаяся молочная кислота (1,5–1,7%) оказывает консервирующее действие, а побочные продукты жизнедеятельности молочнокислых бактерий и отчасти дрожжей (этиловый спирт, летучие кислоты, ароматические вещества, углекислый газ и др.) придают продукту характерные органолептические свойства. Чрезмерное развитие L. brevis может привести к порче – излишней кислотности квашеной капусты, приобретению ею острого привкуса. Снижается качество капусты и при интенсивном развитии дрожжей.
После окончания брожения квашеную капусту следует хранить на холоде (0–3°С) и без доступа воздуха, чтобы задержать развитие потребителей молочной кислоты – пленчатых дрожжей и плесеней. Молочная кислота – основа стойкости продукта. Плесени и дрожжи не только потребляют молочную кислоту, но и придают продукту неприятные запах, вкус и окраску. Некоторые дрожжи вызывают ослизнение капусты. Поскольку плесени и пленчатые дрожжи аэробы, при хранении капусты следует поддерживать анаэробные условия.Помимо плесеней и дрожжей, порчу капусты, особенно при недостаточно быстром повышении кислотности, могут вызывать гнилостные и маслянокислые бактерии. Капуста приобретает прогорклый вкус, резкий неприятный запах. Развитие спорообразующих бактерий группы сенной палочки, обладающих активными пектолитическими ферментами, приводит к размягчению–дряблости продукта, появлению неприятных запаха и вкуса. Размягчение может возникнуть и под действием собственных ферментов капусты.
В практику внедряется квашение капусты с применением закваски из чистых культур молочнокислых бактерий (L. plantarum). Использование бактерий с определенной бродильной активностью и создание для них оптимальных условий (ана-эробность, температура) позволяют направленно использовать полезную биохимическую деятельность микроорганизмов. При введении закваски создается численный перевес полезной микрофлоры, процесс заквашивания ускоряется, исключается развитие вредных микробов, качество капусты улучшается.При квашении огурцов применяют пряности и больше соли (6–8%), поэтому такое консервирование огурцов называют также солением. Квашение огурцов происходит в две стадии. Первая (предварительная 1–2 дня)–до накопления 0,3–0,4% кислоты – проводится при температуре около 20°С, а затем (вторая стадия) продукт медленно сквашивается при температуре от –1 до 2°С.
Микрофлора и микробиологические процессы при квашении огурцов сходны с происходящими при квашении капусты. В начальный период развиваются различные бактерии и дрожжи. По мере возрастания численности молочнокислых бактерий подавляется развитие нежелательной микрофлоры. Из молочнокислых бактерий сначала развиваются лейконосток – слабый продуцент кислоты, а затем более сильные кислотообразо-ватели – гетероферментативные (L. brevis и L. fermentum) и гомоферментативные палочки, преимущественно L. plantarum; развиваются и дрожжи.
Виды порчи солено-квашеных огурцов сходны с порчей квашеной капусты. В основном это ослизнение, размягчение, появление на поверхности пленки молочной плесени или дрожжей, потребляющих молочную кислоту, что способствует развитию нежелательной микрофлоры. Хороший эффект в борьбе с этими микроорганизмами дает введение в рассол сорбиновой кислоты (0,1 %) и предотвращение доступа воздуха.Размягчение возможно и под действием пектинразрушаю-щих ферментов огурцов, наиболее ответственным из которых является полигалактуроназа.Иногда происходит раздувание огурцов – образование в них пустот, обусловленное развитием интенсивно выделяющих газ микроорганизмов (дрожжей, бактерий группы кишечной палочки, гетероферментативных молочнокислых и др.) или нарушением температурного режима квашения.
Рекомендуется применение при квашении чистых культур молочнокислых бактерий. В Кишиневском государственном университете (В. П. Рощиным) получен сухой комплексный препарат (закваска) из солеустойчивых штаммов гомо- и гетероферментативных молочных бактерий (Lactobacillus planta-rum, L. fermentum и Streptococcus lactis).Значительно длительнее сохраняется квашеная продукция, пропастеризованная в герметичной таре.
ЛАБОРАТОРНАЯ РАБОТА 14
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ СМЫВОВ С РУК, ОДЕЖДЫ, ИНВЕНТАРЯ И ОБОРУДОВАНИЯ
Цель работы: Освоение методики проведения смывов с рук, одежды, инвентаря, оборудования.
Основным видом лабораторного контроля за соблюдением санитарного режима на предприятиях пищевой промышленности является бактериологическое исследование смывов с рук, одежды, инвентаря, оборудования, с целью установления степени их бактериального обсеменения и загрязнения БГКП.
Смывы с оборудования и инвентаря производят перед началом работы либо после санитарной обработки в санитарные дни.
Смывы с рук производят перед началом работы, после пользования туалетом.
Приборы, реактивы, посуда термостат, чашки Петри, ватные тампоны, пипетка, изотонический раствор хлорида натрия, молочно-солевой агар, пробирки, среда Кеслера.
Методика выполнения работы
Стерильные тампоны на стеклянных или металлических палочках
увлажняют физиологическим раствором, разлитым по 2 мл в стерильные пробирки непосредственно перед взятием смыва. Смывы с крупного оборудования и инвентаря берут с поверхности 100 см 2 в разных местах исследуемого предмета. Для ограничения поверхности используют шаблон.
Для взятия смывов с санитарной одежды протирают 4 площадки по 25см 2 : нижнюю часть каждого рукава и две площадки с верхней и передней части спецовки.
При взятии смывов с рук протирают тампоном ладони обеих рук, проводя не менее 5 раз по одной ладони и пальцам, затем протирают участки между пальцами, ногти и под ногтями.
Смывы исследуют на обнаружение бактерий группы кишечной палочки и определение наличия коагулозоположительных стафилококков.
1. Определение коагулозоположительных стафилококков.
Для этого производят посев непосредственно тампоном на чашки Петри с молочно-солевым агаром.
2. Выявление БГКП.
Для этого посев производят в среду накопления, для чего тампон погружают в среду Кеслера, разлитую в пробирки по 5-10 мл.
Чашки Петри и пробирки с исследуемым материалом помещают в термостат при температуре 37°С на 48 часов. По истечении этого времени подсчитывают колонии микроорганизмов и наблюдают за изменение среды Кеслера. БГКП и коагулозоположительные стафилококки должны отсутствовать в смывах с контролируемых объектов.
Написать отчет о проделанной работе.
ЛАБОРАТОРНАЯ РАБОТА №15
Санитарно-бактериологическое исследование ферм.
Провести санитарно-микробиологическое исследование воздуха процедурной аспирационным методом до начала работы (задание 1А) и после работы (задание 1Б).
При исследовании воздуха с помощью аппарата ПУ-1Б для определения ОМЧ прокачали 100 л воздуха, для выявления стафилококков и грибов — по 250 л. Произвести расчёт микроорганизмов в 1 кубометре воздуха.
Цель исследования (указать).
Определяемые показатели: (указать).
Метод исследования: (указать).
Использованные питательные среды: (указать).
Вопросы к заданию №1.
Какой метод выявления патогенных микроорганизмов был использован?
Какие СПМ были обнаружены в воздухе?
Укажите возможные источники контаминации воздуха.
Проанализируйте полученные результаты, соответствуют ли они существующим санитарно-микробиологическим требованиям?
Какие могут быть последствия?
Задание №2. Санитарно-бактериологическое исследование воды.
Санитарно-микробиологическое исследование воды питьевой.
См. приложения № 3, 4, 5, 6, 10, 11.
Цель: оценка качества и эпидемиологической безопасности воды питьевой.
Отбор проб воды питьевой. Пробы воды из водопроводной сети отбирают в стерильные флаконы ёмкостью более 500 мл с притёртыми пробками. Сверху пробки должны быть закрыты бумажным колпаком. Если предполагается отбор проб хлорированной воды, то до стерилизации во флакон помещают дехлоратор – 10 мг серноватистокислого натрия на 500 мл воды. Отбор проб проводится в период максимального расхода воды следующим образом:
кран обжигают на пламени тампона, смоченного спиртом;
снимают пробку вместе с бумажным колпаком, не касаясь пробки руками;
спускают воду 10 –15 мин при полностью открытом кране;
заполняют флакон водой с таким расчётом, чтобы не замочить пробку, объём пробы – 500 мл;
закрывают флакон стерильной пробкой с бумажным колпаком, маркируют флакон;
составляют сопроводительный документ, в котором должно быть указано точное место расположения крана, дата и время отбора пробы; особые обстоятельства (состояние водопроводной сети и т. д.); цель исследования: текущий санитарный надзор или особые показания (неблагоприятная эпидемическая ситуация, жалобы населения и т. д.); должность, место работы, фамилия, имя, отчество лица, проводившего отбор пробы.
Определяемые показатели (указать)
Ход исследования согласно МУК 4.2.1018-01.
1. Определение числа сапрофитных микроорганизмов:
1-й день: посев по 1 мл разведений исследуемой воды (10 -1 , 10 -2 ) в расплавленный агар по Коху (по 2 чашки каждого разведения). Инкубация 24 часа при 37 0 С и 48 часов при 20 — 22 0 С.
2-й и 3-й дни: подсчет числа выросших колоний:
Количество колоний на чашке с посевом разведения воды
2. Определение ОКБ.
Определение ОКБ методом мембранных фильтров (основной метод):
1-й этап: фильтрация через фильтр №3 исследуемый объем воды. Фильтр помещают на среду Эндо. Инкубация при 37 0 С 24 часа;
2 — 3-й этапы: подсчет числа выросших на фильтре колоний каждого типа и постановка дополнительных тестов для их идентификации:
1. Культуральные свойства
2. Количество колоний
3. Дополнительные тесты:
а). Мазок по Граму
б). Проба на оксидазу
в). Рост на среде с лактозой и индикатором ВР
4. Вывод о принадлежности данных колоний к ОКБ (да, нет)
5. Посев на ЛПС при 44,5 0 С
6. Наличие газообразования на ЛПС при 44,5 0 С
7. Вывод о принадлежности колоний данного типа к ТКБ (да, нет)
ЛАБОРАТОРНАЯ РАБОТА №16
САНИТАРНО-ГИГИЕНИЧЕСКИЕ ИССЛЕДОВАНИЯ СМЫВОВ С РУК, ОДЕЖДЫ.
Контроль смывов с одежды, рук, инвентаря, оборудования
Санитарно-бактериологический контроль смывов с одежды, рук, инвентаря, оборудования
В целях осуществления постоянного санитарно- бактериологического контроля на предприятиях общественного питания, пищевых отраслей различного профиля за поверхностью объектов, контактирующих с продукцией, применяются различные показатели. Например, определяют общую бактериальную обсемененность объекта (руки работников, спецодежда, оборудование и т.п.), наличие санитарно-показательной микрофлоры (БГКП, энтерококков), а также в отдельных случаях наличие на поверхности исследуемого объекта условно-патогенной и патогенной микрофлоры, характерной для данного производства (при использовании мясного сырья — микроорганизмов рода Salmonella, в кондитерском производстве — Staphylococcus). Общую бактериальную обсемененность объекта определяют количественно (обычно в перерасчете на 1см 2 поверхности- микробное число), а также, в отдельных случаях- качественно.
Данные показатели определяются как в плановом порядке в лабораториях производства и работниками СЭС, так и внепланово по эпидемическим показаниям.
Отбор проб для санитарно-микробиологического исследования предметов обихода и оборудования проводится с помощью следующих методов:
• смывов (тампонами или салфетками);
• отпечатков (контактный метод);
Метод смывов. Этот метод является основным при отборе проб для исследования твердых поверхностей. Смывы с крупных плоских поверхностей (столы, подоконники, полы, стулья, оборудование, инвентарь и т.д.) производят перед началом рабочего дня, либо после санитарной обработки в санитарные дни. Общая площадь поверхности крупных объектов, с которой берется смыв — 100 см 2 . Для ограничения поверхности используют шаблон (трафарет) площадью 25 см 2 , изготовленный из металла, накладывая его последовательно на 4 разных участка. Трафареты перед отбором смывов должны быть простерилизованы. Смывы с рук работников следует производить перед началом работы. При взятии смывов с рук протирают тампоном обе ладони рук, проводя не менее 5 раз по одной ладони и пальцам, затем протирают участки между пальцами, ногти и под ногтями. При взятии смывов с санитарной одежды протирают 4 площадки по 25 см 2 : нижнюю часть каждого рукава и две площадки с верхней и передней части спецовки. Смывы с посуды на предприятиях общественного питания производят, протирая тампоном всю поверхность исследуемых объектов — для тарелок, рабочую поверхность — для ложек, вилок и т.д. (в количестве 2-3 штуки для мелких объектов). Смывы с мелких предметов можно получить, погрузив их непосредственно в колбу со стерильной жидкостью. В течение 10 мин их встряхивают, затем полученную смывную среду используют для посевов. В каждом случае используют стерильные ватные или марлевые тампоны,
которые перед употреблением смачивают стерильным изотоническим раствором хлорида натрия, водой или питательной средой (чаще мясопептонным бульоном или средой Кесслера). При контроле жирных поверхностей пользуются сухими тампонами или салфетками.
Салфетки помещают в колбы с увлажняющей жидкостью и транспортируют в лаборатории с соответствующим сопроводительным документом, где проводятся соответствующие посевы: на общую обсемененность смыва или его разведения, на присутствие санитарно-показательных (БГКП, энтерококков), патогенных (сальмонелл, синегнойной палочки, протея) микроорганизмов на соответствующие среды.
Метод отпечатков, или контактный метод, применяется для определения биологической контаминации ровной гладкой поверхности (как горизонтальной, так и вертикальной). Кусочки марли (в виде кружков диаметром 3—6 см), мембранные фильтры или полоски фильтровальной бумаги помещают в чашки Петри и заливают расплавленной плотной средой (3% мясо-пептонным агаром или средой Эндо двойной концентрации). После остывания стерильным пинцетом забирают кружочки или полоски и накладывают стороной, пропитанной средой, на исследуемую поверхность, прижимая осторожно пинцетом. Затем переносят в стерильную чашку Петри для последующей инкубации (нижней поверхностью вверх). Метод отпечатков выгодно отличается от метода смывов возможностью непосредственного обнаружения загрязнения объектов окружающей среды и отсутствием потери микробов в исследуемых предметах (что всегда происходит при распределении микрофлоры со смытой поверхности в смачивающей жидкости).
Метод агаровой заливки применяется для определения микрофлоры различных горизонтальных поверхностей, а также тканей. Для отбора пробы используется специальная металлическая пластинка высотой 2 см в виде кольца усеченной формы с диаметром верхней поверхности круга 5 см и нижней меньшей — 4см. (рис. 9,а). Перед исследованием кольцо фламбируют обжиганием, охлаждают, помещают на поверхность исследуемого объекта нижним краем и заливают расплавленным и остуженным до 45 °С мясопептонным агаром или средой Эндо. Спустя 5-10 мин после застывания среды кольцо осторожно снимают и вытряхивают в стерильную чашку Петри застывшую агаровую пластинку вверх нижней поверхностью, соприкасавшейся с исследуемым объектом. Метод удобен тем, что на поверхность среды захватываются все микроорганизмы, находящиеся на исследуемом участке объекта, но он не дает представления об общей обсемененности предметов из-за ограниченности исследуемой площади. Его рекомендуют применять при небольшой бактериальной загрязненности.
При оценке санитарного состояния предметов обихода, изготовленных из тканей (постельное белье, одеяла, одежда и т. д.) можно применять метод, заключающийся во встряхивании участка загрязненных тканей над чашкой Петри с питательной средой. Обследуемую ткань зажимают в специальной металлической обойме, состоящей из двух колец, вкладываемых друг в друга (рис.9, б), и помещают над чашкой Петри со средой. Встряхивание ткани можно производить просто поколачиванием по ее наружной поверхности стерильным пинцетом или, закрепив в центре ткани стерильную булавку, несколько раз ее оттягивают и отпускают. Вместе с пылью из ткани на питательную среду попадают и находящиеся в ней микроорганизмы. Чашку закрывают и помещают в термостат для инкубации.
Определение общей микробной обсемененности объекта
Этот показатель определяют из смачивающей жидкости, применяемой при взятии смывов. Посев производят по обычной методике определения общего микробного числа. В пробирках с тампонами или в колбах, содержащих салфетки (после проведения смывов), общий объем жидкости доводят до 10 мл, добавляя стерильный изотонический раствор хлорида натрия и получая исходное разведение1:10. После интенсивного 2-3- минутного встряхивания готовят десятикратные разведения. В зависимости от предполагаемой степени загрязненности посевы производят из нескольких разведений.
Определение титра БГКП в смывах Определение титра БГКП проводят бродильным методом. При предполагаемой малой степени фекального загрязнения предварительно производят посев смыва на среду обогащения (среда Кесслера). Подсчет титра проводят на 1см 2 поверхности. При обнаружении БГКП контактным методом или методом агаровой заливки используют среду Эндо. В этом случае можно провести расчет числа БГКП на 1 см 2 поверхности исследуемого предмета (индекс БГКП). Идентификация выделенных культур БГКП (если это необходимо) ведется как при исследовании питьевой воды. Однако чаще всего на производстве пользуются более строгим показателем- по первой бродильной пробе. В этом случае последовательно отбирают несколько десятков смывов с разных объектов (с оборудования крупных размеров- 2-4 смыва из разных мест) на среду Кесслер или Кода. После инкубации пробирок со смывами в термостате при 37°С 18-24ч считают процент смывов с наличием в них БГКП от общего числа взятых смывов.
Определение энтерококков в смывах Проводится титрационным методом или методом мембранных фильтров. Обильный рост колоний энтерококков свидетельствует о свежем фекальном загрязнении исследуемого предмета обихода. За титр энтерококка принимается то
предельное разведение смыва, в котором обнаружены энтерококки.
Исследование смывов на присутствие патогенных стафилококков, сальмонелл, протеев, синегнойной палочки проводят так же, как при санитарно-бактериологическом контроле пищевых продуктов.
Оценка санитарного состояния объектов окружающей среды
При оценке санитарно-микробиологического состояния объектов исходят из цели обследования и назначения этих объектов. Официальных регламентаций о состоянии, составе микрофлоры различных объектов практически нет.
Имеющиеся инструктивные материалы по санитарно- микробиологическому контролю предприятий обществен-ного питания и торговли пищевыми продуктами указывают на то, что фекальное загрязнение должно быть исключено, т. е. не должно быть БГКП на оборудовании (не соприкасающимся с сырыми продуктами), на вымытой посуде. На всех обследуемых предметах обихода и оборудования не должны обнаруживаться патогенные микроорганизмы: их присутствие указывает на реальную опасность заражения. К сожалению, не всегда удается избежать фекального загрязнения на производстве, в больницах и т.д. В связи с этим, исходя из опыта санитарной практики, если БГКП обнаруживаются только в 5% проб, взятых с предметов обихода и оборудования, санитарно-гигиеническое состояние обследуемого предприятия (лечебного учреждения) расценивается как удовлетворительное.
По показателям общей обсемененности: санитарное состояние поверхности считается отличным, если ОМЧ на 1см 2 не превышает 100, хорошим — при микробном числе от 100 до 1000, удовлетворительным — более 1000, плохим — более 10000.
В то же время выделение патогенных стафилококков в клиниках хирургического профиля и в родильных домах с предметов обихода и от персонала свидетельствует о санитарном неблагополучии. В этом случае проводится обязательное определение фаговаров и антибиотикограммы выделяемых стафилококков.
При обследовании различных объектов на стерильность (перевязочный и шовный материал, системы переливания крови, шприцы, иглы, грудное молоко, жидкость для питья детей и т. д.) не должно быть роста во всех посевах.
ЛАБОРАТОРНАЯ РАБОТА №17
ПРИГОТОВЛЕНИЕ РАСТВОРОВ МОЮЩИХ СРЕДСТВ
Цель: Приготовить 10% раствор хлорной извести.
Показания. Для дезинфекции.
Противопоказания: Аллергическая реакция на хлорсодержащие препараты у сотрудника.
Длинный хирургический халат.
Респиратор (или 8-слойная маска).
Весы или мерная емкость.
Сухая хлорная известь 1 кг.
Эмалированная емкость с крышкой.
Бутыль из темного стекла с притертой пробкой.
Холодная вода -10 литров.
Марлевая салфетка или сито.
Последовательность действий медсестры:
Наденьте второй халат, клеенчатый фартук, резиновые перчатки, респиратор или восьмислойную маску.
Возьмите 1 килограмм сухой хлорной извести
Высыпьте ее осторожно в эмалированную емкость, измельчите ее деревянной лопаткой.
Перемешайте все и осторожно вливайте холодную воду до отметки 10 литров.
Закройте крышкой и поставьте на 24 часа (в течение этого времени несколько раз перемешайте) для выделения активного хлора, получится маточный раствор.
Перелейте через 24 часа полученный раствор через 4 слоя бинта (марли) в бутыль из темного стекла с маркировкой «10% раствор хлорной извести».
Поставьте на этикетке дату приготовления раствора, его концентрацию, свою должность и фамилию.
Снимите защитную одежду.
Вымойте руки с мылом.
Приготовлен 10% раствор хлорной извести (осветленный).
Хлорсодержащие растворы готовят в специальном помещении с хорошей вентиляцией.
10% раствор можно хранить 5-7 суток в темном месте.
Раствор необходимо хранить в недоступном для пациента месте.
Приготовление рабочих растворов хлорной извести:
0.5% — 500 мл 10% раствора хлорной извести на 9,5 литра воды;
1% — 1 литр 10% раствора хлорной извести на 9 литра воды;
2% — 2литра 10% раствора хлорной извести на 8 литра воды;
Формула приготовления хлорной извести:
Y = (% кол-во литров). Y — количество осветленного раствора хлорной извести.
Рабочий раствор хлорамина (готовится перед применением)
1% -10 г хлорамина на 990 мл воды;
2% — 20 г хлорамина на 980 мл воды;
3% — 30 г хлорамина на 970 мл воды;
5% — 50 г хлорамина на 950 мл воды.
Действие моющих средств на микрофлору рук, поверхностей и оборудования Цели работы: 1. Освоить методику определения количества микроорганизмов на руках методом смыва. 2. Освоить методику определения количества микроорганизмов на поверхностях и оборудовании методом смыва. Методические указания Производство продуктов питания, лекарственных средств и электроники требует поддержания высокого уровня микробиологической чистоты. Микробиологический надзор также необходим на объектах общественного питания, торговой сети, пищеблоков детских, дошкольных и подростковых учреждений. С целью контроля эффективности санитарной обработки инвентаря, оборудования, посуды, санитарной одежды и рук персонала широко используется метод смывов, который дает возможность объективно оценить санитарное содержание обследуемых учреждений. Санитарные нормы микробиологического контроля рук персонала и поверхностей оборудования зависят от вида производства и класса чистоты помещения. Класс чистоты чистого помещения – это четко регламентированные требования по уровню содержания в воздухе различного рода примесей и частиц. Классы чистоты различаются по количеству бактерий на единицу объема. Этот параметр, один из важнейших в классификации чистых помещений, регламентируется стандартами. Классификации чистых комнат для различных отраслей имеют свои отличительные особенности. В таблице 3 приведены классы чистоты помещений для приготовления лекарственных средств. Требования и нормы зависят от вида готового продукта и характера выполняемых операций. Класс A – локальная зона для проведения операций, представляющих высокий риск для качества продукции (зоны наполнения, укупорки). Класс B – зона, непосредственно окружающая зону А. Класс C – зоны, для выполнения 112 менее ответственных стадий производства продукции (приготовление растворов и т.д.).• Класс D – работа с компонентами и материалами после мойки, подготовка первичной упаковки и т.д. В помещениях класса D и С может также осуществляться приготовление нестерильных лекарственных средств. Таблица 3 Классификация чистых помещений производства лекарственных средств в соответствии с ОСТ 42-510-98 Класс чистоты помещений или зон Максимально допустимое количество частиц в 1 м3 воздуха размером, мкм Максимально допустимое количество жизнеспособных микроорганизмов на 1 м3 воздуха 0,5 5 0,5 5 Оснащенное состояние Функционирующее состояние А 3500 0 3500 0 0 0,5 мкм в одном кубическом футе воздуха. Классы А и В по ОСТ 42-510-98 примерно соответствуют классам 100 и ISО 5, класс С – классам 10000 и ISO 7, класс D – классу 100000 и ISO 8. В лечебных учреждениях России принята своя классификация помещений. Класс А (операционные) соответствует по микробиологическим нормам классу D при производстве стерильных лекарственных средств. В классах А и В не допускается присутствие микроорганизмов на перчатках персонала, в классе С – допускается не более 2-3 жизнеспособных микроорганизмов. На пищеконцентратных предприятиях, где нет высоких требований к микробиологической чистоте, количество механических 113 частиц не регламентируется, а количество микроорганизмов, обнаруженных на руках персонала, не должно превышать 10 000. Таблица 4 Классификация чистых помещений по Федеральному стандарту США и ISO Область применения Класс по Федеральному стандарту США 209 Е Класс по стандарту ISO (международная организация по стандартизации) Производство интегральных микросхем 1 ISO 3 Производство интегральных микросхем с расстоянием между проводниками менее 2 мкм 10 ISO 4 Асептическое производство инъекционных препаратов, требующее отсутствия микроорганизмов и частиц. Хирургические операции по имплантации или трансплантации органов. Изоляция пациентов с иммунным дефицитом, в том числе, после пересадки костного мозга 100 ISO 5 Производство оптических элементов высокого класса. Сборка и испытания прецизионных препаратов. Сборка миниатюрных подшипников. 1000 ISO 6 Точное машиностроение, гидравлика и пневматика, сборка прецизионного гидравлического и пневматического оборудования, клапанов с сервоприводами, высокоточных часовых механизмов 10 000 ISO 7 Пластиковое производство, автомобильная промышленность, сборка электронных компонентов, сборка гидравлических и пневматических устройств 100 000 ISO 8 При проведении санитарно-бактериологических исследований смывов на производствах, не требующих высокой микробио- 114 логической чистоты, в основном ограничиваются выявлением общего числа бактерий и бактерий группы кишечных палочек. Обнаружение последних расценивают как одно из подтверждений нарушения санитарного режима. При выявлении вторичного массивного обсеменения готового продукта со значительным превышением в нем общего количества микробов, в смывах определяют общую бактериальную обсемененность и наличие бактерий рода Proteus и St. aureus. Поверхности и оборудование также регламентированы по бактериальной обсемененности. В помещениях высоких классов чистоты микроорганизмы не допустимы. На предприятиях пищеконцентрационной промышленности по показателям общей обсемененности санитарное состояние поверхности считается отличным, если ОМЧ на 1см2 не превышает 100, хорошим — при микробном числе от 100 до 1000, удовлетворительным — более 1000, плохим — более 10000. Обсемененность оборудования в цехах, производящих продукты детского и диетического питания, должны быть не более 50 микробных клеток на 100 см2 поверхности оборудования. Во всех случаях биологического контроля присутствие патогенных и спорообразующих бактерий, грибов и дрожжей недопустимо. При их выявлении необходимо проведение дополнительных мер по дезинфекции и выявление источников контаминации. Экспериментальная часть 1. Влияние бактерицидных и моющих средств на микрофлору рук. Студенты выполняют работу индивидуально. С преподавателем предварительно оговариваются условия работы: моющее или бактерицидное средство, которым студент будет обрабатывать руки в опыте. Можно сравнить микрофлору рук после использования и без использования полотенца для высушивания обработанных поверхностей. 115 Занятие 1 В зависимости от количества экспериментов каждому студенту понадобятся две либо три чашки Петри с питательным агаром, и столько же ватных тампонов, простерилизованных с водопроводной водой. Также понадобятся: пять пипеток объемом 1мл, четыре пробирки с 9 мл водопроводной воды. Для приготовления тампонов вату накручивают на конец проволоки, еще одно небольшое количество ваты накручивают на проволоку таким образом, чтобы он служил пробкой при помещении проволоки с тампоном в пробирку с 5 мл воды. При этом тампон не должен быть погруженным в жидкость. Чашки Петри заворачивают в бумагу. Пипетки заворачивают в полоску бумаги, предварительно заложив в широкий кончик вату. Питательный агар готовят из расчета 15 мл для одной чашки Петри. Студенты рассчитывают общее количество чашек Петри, рассчитывают навеску питательной среды и готовят питательный агар в общей колбе по рецепту. После приготовления питательную среду слегка остужают и разливают в пробирки. Пробирки снабжают ватно-марлевыми пробками. Отдельно студенты готовят пробирки с 9 мл водопроводной воды и закрывают их ватномарлевыми пробками. Все приготовленные материалы и посуду стерилизуют при 1,1 ати 25 минут. Занятие 2 Во время эксперимента студенты отбирают пробы с грязных рук, затем с рук после обработки моющим средством и высушивания полотенцем, или после обработки моющим средством без высушивания. Перед отбором пробы тампон увлажняют, погружая его в пробирку с 5мл стерильной водопроводной воды. Тампоном тщательно делают смывы с тыльной поверхности рук, делая медленные движения, тщательно протирая тампоном между пальцев. После взятия пробы тампон помещают в эту же пробирку. В случае с грязными руками готовят два 10-кратных разведения, из которых по 1 мл высевают в чашки Петри. Посевы зали- 116 вают расплавленным и охлажденным до 45-50°С стерильным питательным агаром. Посевы помещают в термостат при температуре 30°С. Если исследуют смывы с обработанных рук – можно не делать разведений, или ограничиться одним 10-кратным разведением. Занятие 3 Обсемененность рук рассчитывают, исходя из количества колоний и с учетом разведений. Выводы студенты делают самостоятельно при контроле со стороны преподавателя. 2. Влияние бактерицидных и моющих средств на микрофлору оборудования. Студенты выполняют работу индивидуально. Предварительно с преподавателем оговаривается оборудование и бактерицидное средство, с которыми будет работать студент. При бактериологическом анализе смывов с оборудования и инвентаря, в них определяется общая бактериальная обсемененность. Занятие 1 Для проведения эксперимента студентам необходимы: тампоны с физиологическим раствором, две чашки Петри со стерильным питательным агаром. Тампоны, чашки Петри и питательная среда готовятся и стерилизуются так же, как описано в пункте 1. Занятие 2 Перед отбором пробы тампон увлажняют, погружая его в пробирку с 5 мл стерильной водопроводной воды. После отбора пробы тампон помещают в эту же пробирку. Пробы отбираются на поверхности площадью 1 м2 . В случае если поверхность оборудования или инвентаря небольшая – отбирают пробы на площади 25*25 см. Студенты отбирают пробы медленными движениями тампона параллельными близко расположенными линиями, затем перпендикулярными линиями по отношению к первым. После отбора пробы тампон возвращается обратно в пробирку, содержимое тщательно перемешивается и 0,1 мл суспензии 117 высевается в чашку Петри. Посевы заливают расплавленным и охлажденным до 45°С стерильным питательным агаром. После исследования обсемененности оборудования студенты обрабатывают поверхность бактерицидным средством и снова отбирают высевают пробы вышеописанным способом. Посевы помещают в термостат при температуре 30°С. Занятие 3 При подсчете количества микроорганизмов на 1 см2 площади студенты принимают во внимание площадь, на которой отбирали пробы, количество воды в пробирке, объем высеваемой суспензии. После санитарной обработки общая обсемененность 1 см2 поверхности оборудования, изготовленного из металла, стекла, резины, пластмассы, дерева, не должна превышать 300 микробных клеток. Выводы студенты делают самостоятельно при контроле со стороны преподавателя.
Источник