Понятие о кислотности и щелочности почвы
Характерным свойством почвы является ее реакция. Она определяется соотношением свободных ионов Н + и ОН — в почвенном растворе. Концентрация свободных ионов Н + выражается величиной РН, представляющей отрицательный логарифм концентрации ионов водорода. РН=7 характеризует нейтральную реакцию, РН 7 – щелочную.
Реакция почвенного раствора в различных почвах колеблется от РН 3,5 до 8-9 и выше. Наиболее кислую реакцию имеют болотные почвы верховых торфяников. Кислой реакцией почвенного раствора характеризуются подзолистые и дерново-подзолистые почвы, а также красноземы (РН 4-6). Черноземы имеют реакцию близкую к нейтральной. Наиболее щелочная реакция у солончаков, особенно содовых (РН-8-9 и выше).
Сельскохозяйственные растения предъявляют разные требования к реакции почвы. Наиболее благоприятная слабокислая и слабощелочная реакция. С реакцией почвенного раствора тесно связана жизнедеятельность почвенной микрофлоры. В кислой среде преобладает грибная микрофлора, в нейтральной или слабощелочной – бактериальная.
С реакцией почвенного раствора связаны процессы превращения компонентов минеральной и органической частей почв, растворение веществ, образование осадков, миграция и аккумуляция веществ в почвенном профиле. Кислая среда является следствием развития в почве кислотности, щелочная реакция – следствие щелочности почвы.
Кислотность почвы — способность почвы подкислять воду и растворы нейтральных солей. Различают актуальную (активная) и потенциальную (скрытая) кислотность.
Актуальная кислотность обусловлена концентрацией свободных ионов Н + и характеризует кислотность почвенного раствора. Потенциальная кислотность характерна для твердой фазы почвы. Между актуальной и потенциальной кислотностью в почве сохраняется подвижное равновесие
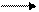
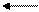
В большинстве почв актуальная кислотность обусловлена угольной кислотой и ее кислыми солями. Причиной потенциальной кислотности почвы являются обменные ионы Н + и Al +++ , т.к. при взаимодействии почвы с растворами солей эти катионы вытесняются в раствор и подкисляют его:
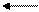
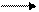
В зависимости от характера вытеснения Н+ и Al +++ различают 2 формы потенциальной кислотности: обменную и гидролитическую.
Обменная кислотность проявляется при взаимодействии почвы с растворами нейтральных солей, которые образуются при соединении сильных оснований с сильными кислотами (KCl, BaCl2, NaCl и т.п.)





ППК Аl +++ +4КСl ППК — Mg ++ + HCl + AlCl3



Гидролитическая кислотность обычно больше обменной. Она может рассматриваться как суммарная кислотность почвы, состоящая из актуальной и потенциальной кислотности. Кислотность выражается в миллиграмм – эквивалентах (м-экв) на 100г почвы.
Для устранения кислотности почв проводят известкование.При определении степени нуждаемости почвы в известковании следует учитывать насыщенность почвы основаниями (таблица 2), а также ее гранулометрический состав и набор культур в севообороте.
Таблица 2 -Деление почв по степени нуждаемости в известковании.
| Степень нуждаемости в известко-вании | РН – солевой вытяжки | Степень насыщен-ности почвы основа-ниями (%) |
| Сильная | До 4,5 | До 50 |
| Средняя | 4,6-5,0 | 50-70 |
| Слабая | 5,1-5,5 | >70 |
| Отсутствует | >5.5 | >80 |
Дозу извести чаще всего рассчитывают по величине гидролитической кислотности. Для этого гидролитическую кислотность умножают на коэффициент 1,5; полученная величина означает дозу (в т/га), которая должна быть внесена в почву для доведения ее реакции до слабокислой
Если для известкования используют не чистый СаСО3, то проводят перерасчет на содержание СаСО3 в применяемом известковом материале, а для MgСО3, СаО и Са(ОН)2 пользуются соответственно коэффициентами 0,84;0,56 и 0,74. Можно также пользоваться дозами извести, предлагаемыми справочниками по удобрениям для отдельных почвенных разновидностей с учетом рН солевой вытяжки. На легких почвах с низкой буферностью полную дозу извести, рассчитанную по гидролитической кислотности, обычно уменьшают на 25-30%. Для отдельных культур (лен, картофель) дозу извести можно снизить на 50%. При расчете доз известкования освоенных торфяников необходимо иметь в виду значительно меньший объемный вес их по сравнению с минеральными почвами
Щелочность почвы обуславливается повышенной концентрацией в почве ионов гидроксила ОН — . Различают актуальную и потенциальную щелочность. Актуальная щелочность обуславливается наличием в почве гидролитически щелочных солей (Na2CO3, NaHCO3, Ca(HCO3)2 и др.).
Потенциальная щелочность обнаруживается у почв, содержащих поглощенный Na.








Щелочность почвы устраняют гипсованием- традиционный способ ее нейтрализации. Дозу гипса для замены натрия на кальций в ППК вычисляют по формуле:
где, Х – доза гипса в т/га;
0,086 – миллиэквиваленты гипса, в г;
Na – содержание обменного натрия, в м-экв. на 100г почвы;
Н- мощность пахотного слоя, в см;
d – плотность массы мелиорируемого горизонта, г/см 3 .
С изменением реакции среды тесно связано важное свойство почв – их буферность, т.е. буферная способность.
Буферностью называют способность почвы противостоять изменению реакции почвенного раствора. Буферная способность различных почв неодинакова. Почвы, богатые карбонатами (черноземы, каштановые), хорошо противостоят смещению реакции в кислую сторону, тогда как почвы, обедненные основаниями (подзолы, красноземы), имеют высокую буферность при изменении реакции в щелочную сторону. Особенно низка буферность песчаных и супесчаных почв, а также содержащих мало органического вещества.
Благодаря этому замечательному свойству почвы (буферности) возможно применение хорошо растворимых солей в качестве минеральных удобрений, в противном случае в зонах вокруг гранул удобрений создавались бы губительные для растений концентрации солей.
Контрольные вопросы:
1 Происхождение, состав и основные свойства почвенных коллоидов?
2. Что такое ацидоиды, базоиды и амфолитоиды? Дайте им характеристику.
3. Охарактеризуйте процессы коагуляции и пептизации коллоидов?
4. Как Вы понимаете поглотительную способность почвы, от чего она зависит?
5.Назовите закономерности обменного поглощения катионов и анионов в почве.
6. Назовите состав обменных катионов в основных типах почв.
7. Какова роль поглотительной способности в плодородии почв?
8. Что называется емкостью поглощения почв, от чего она зависит, в каких пределах колеблется?
9. Каковы происхождение и виды почвенной кислотности и щелочности?
Источник
Научная электронная библиотека
11. Природа почвенной кислотности и щелочности
Реакция среды имеет существенное значение для направления почвенных процессов, зависит от типа почв, количества осадков, ее измеряют величиной рН. Изменение реакции среды – лимитирующий фактор процессов почвообразования.
Кислотность почв – способность почв нейтрализовать растворы с щелочной реакцией и подкислять воду и растворы нейтральных солей (Роде, 1975).
Актуальная кислотность (активная) – кислотность почвенного раствора, суспензии или водной вытяжки почв, обусловленная наличием водорода, концентрация ионов Н+ растворе в г-экв (моль) на 1 литр, выраженная рН. Условия жизни оптимальны при рН от 2,5–3 до 10–10,5.
Потенциальная кислотность (пассивная) – кислотность твердой фазы почвы, обусловлена катионами водорода, находящимися в поглощенном состоянии или появляющимися в результате гидролиза. Ее подразделяют на обменную и гидролитическую.
Обменная потенциальная кислотность – обусловлена наличием в почвенно-поглощающем комплексе ионов водорода и алюминия, способных к замещению, проявляется при взаимодействии с почвой электронейтральных солей, например, КСI. При взаимодействии почв с нейтральной солью не все протоны переходят в раствор, в системе устанавливается динамическое равновесие:
ПК]Н + КСI → ППК]К +НСI
Гидролитическая потенциальная кислотность – обусловлена наличием в почвенно поглощающем комплексе ионов водорода, способных к замещению:
ППК]Н + СН3СОО Nа → ППК]Nа + СН3СООН
Щелочность – способность почвы проявлять свойство оснований. Создается за счет солей слабых кислот, образующих при гидролизе слабо диссоциирующие молекулы.
Nа2CO3 + Н2O→ 2Na + 2ОН +Н2СО3
А. А. Роде (1975) выделяет щелочность карбонатную, бескарбонатную и общую (наличие в водной вытяжке соответственно карбонат и бикарбонат ионов отдельно и в совокупности).
Актуальная щелочность обусловливает присутствие в почве карбонатов и бикарбонатов кальция, магния, натрия, которые увеличивают рН.
Потенциальная щелочность характерна для солонцеватых почв, содержащих обменный натрий:
ППК]2Nа + Н2СО3→ ППК]2Н + Nа2СО3
Для ее устранения используют гипсование, серную кислоту, железный купорос. Гипсование – вытеснение натрия. Сульфаты удаляют промывками
ППК]2Nа + СаSO4 → ППК]Са + Na2SO4
Буферность – способность почвы противостоять изменению реакции среды.
Экологическое значение кислотности и щелочности почв (по Валькову и др., 2006)
Резко кислая, рН 4–5. Часто во влажном климате, у сильноподзолистых и болотных почв, желтоземно- и красноземно-под-золистых. Почвы сильно промыты от извести, калия, бора, серы, цинка, кобальта, йода. Возможно разрушение немногочисленной органики, ухудшение физических свойств.
Сильнокислая, рН 5–5,5. Почвы влажного климата (подзолистые, дерново-подзолистые, бурые лесные ненасыщенные, желтоземы и красноземы). Понижена микробиологическая деятельность, активизирована грибная. При суглинистом и глинистом составе характерна склонность к уплотнению.
Слабокислая, рН 6–6,5. Почвы влажного климата (выщелоченные черноземы, серые и бурые лесные, насыщенные желтоземы и красноземы). Фосфат в доступном состоянии, токсичность алюминия и марганца понижена или ее нет. Дефицит серы, кальция, калия, бора, кобальта. Доля йода невысокая. Склонность к уплотнению, повышенный уровень жизнедеятельности микроорганизмов и нитрификационной активности.
Нейтральная, рН 6,5–7,5. Типична для черноземов. Благоприятные физические условия, прекрасная оструктуренность, интенсивная микробиологическая деятельность, оптимальные условия фосфорного, азотного минерального питания, высокое плодородие.
Слабощелочная, рН 7,5–8,5 (8,7). Характерна для южных черноземов, карбонатных и автоморфных почв сухих и полупустынных степей. Фосфаты, железо, цинк и марганец могут быть в дефиците. Физические свойства – от отличных (карбонатные черноземы) до неудовлетворительных (солонцеватые почвы). Микробиологическая деятельность, нитрификационная способность, условия азотного питания, доступность многих зольных элементов хорошие.
Сильнощелочные, рН 8.5-10. Повышение рН характерно для материнских пород многих черноземов и каштановых почв.
Резкощелочные, рН 10–12. Проявляется локально в аридном климате. Это могут быть солонцы, содовые солончаки. Доступность фосфора понижена, железо и марганец в дефиците, возможен избыток бора. Неблагоприятные физические условия, обесструктуренность, подавлена деятельность микроорганизмов.
Источник
