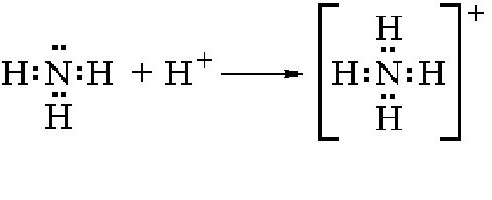Аммиачное и аммонийное удобрение: что это такое и где купить
Азот способствует развитию культур, наращиванию вегетативной массы, увеличению урожайности и улучшению качества продукции. То есть, этот элемент жизненно важен для растений. Они получают его из почвы. И если грунт истощен или изначально был обедненным, то приходится вносить в него азотные удобрения.

Одной из групп таких удобрений, самой популярной, являются вещества, в которых азот содержится в форме аммиака NH3 (аммиачные) и аммония NH4+(аммонийные).
Преимущества
Аммонийные и аммиачные удобрения отличаются универсальностью. Они подходят для грунтов любого типа, множества культур, в том числе цветов и домашних растений, насыщая их азотом. Их можно использовать для подготовки почвы и в фазе роста, в течение всего вегетативного периода.
Такие удобрения мало подходят для подкормки озимых и закладки в лунки. Из почвы они вымываются плохо, но их необходимо глубоко в нее заделывать.
Еще один плюс: стоимость их невысокая, так как производство не отличается сложностью. При этом результат их применения вне всяких похвал, так что экономическая выгода их использования бесспорна.
Важно: вносить аммиачные и аммонийные удобрения нужно строго по инструкции, так как передозировка может пагубно сказаться на растениях.
Кроме того, они повышают кислотность почвы, поэтому в определенных случаях их нужно вносить с веществами, нейтрализующими такую способность.
Резкий запах таких удобрений отпугивает медведку, зеленую тлю и других вредителей.

Еще одним плюсом таких минеральных подкормок является то, что выпускаются они как в легкорастворимом твердом, так и жидком виде. А на практике уже давно доказано, что именно растворы лучше усваиваются растениями. Еще одно преимущество жидкого удобрения: легкость внесения в почву, процесс можно полностью механизировать.
Виды аммиачных и аммонийных удобрений
Классифицируются эти вещества дополнениями к азоту.
Безводный аммиак (NH3). Это подвижная жидкость без цвета с 82,3% азота. Ее глубоко заделывают в почву осенью и зимой, она не вымывается, хорошо воспринимается растениями. Но жидкий аммиак – очень сильная отрава, а потому опасен. Из-за этого сейчас в сельском хозяйстве используется крайне мало.
Аммиачная вода (NH3 + NH4OH + H2O) – водный технический аммиак. Прозрачная жидкость, иногда бывает с желтым оттенком, резко пахнущая. Популярное экономичное удобрение, широко и успешно применяемое в разных климатах и почвах. Гидрат аммиака вносят при подготовке почвы к посеву, как основная подкормка и для внекорневой обработки растений. Кроме прочего, он спасает почву от вредных организмов, грибков.
Сульфат аммония (NH4)2SO4. В этом препарате азот и сера находятся почти в равных частях (21 и 24 % соответственно). Удобрение, имеющее вид бесцветных прозрачных кристаллов, может использоваться как в сухом виде, так и в растворенном (что эффективнее) при подготовке почвы к посадке. Раствором также поливают огород. Сернокислый аммоний не требует особых условий хранения, гигроскопичен, не слеживается, не испаряется. Но так как он закисляет почву, то его в некоторых случаях целесообразно вносить совместно с нейтрализующим известняком или мелом, щелочными фосфорсодержащими подкормками. Полезное действие: делает плоды более вкусными и полезными, повышая в них содержание витаминов, урожай дольше сохраняется.
Сульфат аммония–натрия. В этом удобрении 16% азота, 20 – 25 % сульфата натрия и 9% оксида натрия. Представляет собой кристаллы желтого, темно-серого или белого цвета. Полезные свойства его такие же, как и сульфата аммония. Используют в качестве подкормки весной и осенью, а больше всего это вещество любит свекла.
Хлористый аммоний (NH4Cl) или хлорид аммония. Кристаллический порошок, запаха не имеет. Хлор, хоть и необходим растениям для азотного метаболизма и фотосинтеза, некоторым из них противопоказан – винограду, картофелю, масличному табаку и др. Поэтому огородники с опаской относятся к этому удобрению.
Карбонат аммония (NH4)2CO3 – углекислая соль. Быстрорастворимые кристаллы аммониевой соли угольной кислоты весьма неустойчивы в воде и на воздухе, поэтому их нужно помещать глубоко в почву.
Сульфонитрат аммония (NH4)2SO4*2NH4NO3+(NH4)2SO4) – смесь сульфата аммония и аммиачной селитры. Азот в этом веществе содержится в двух формах – нитратной и аммонийной. Это минеральное удобрение со сбалансированным составом азота и серы обладает улучшенными физико-химическими свойствами. Благодаря этому оно увеличивает плодородие почвы и может вноситься в верхний слой грунта перед посевом весной, как основная подкормка и в период вегетации.
Аммиачная селитра
Об этом аммонийном удобрении с формулой NH4NO3 стоит сказать несколько слов отдельно. Веществу в виде белых гранул или желтоватого порошка, только наполовину считающемуся азотным (34–35%) больше всего доверяют аграрии и чаще всего используют. Это и не странно – урожайность благодаря ему вырастает на 45%. Потому оно и занимает первое место среди азотных удобрений.

В сухом виде нитрат аммония вносят осенью и весной, а раствором подкармливают корни огородных растений. Он плохо выводится из грунта, поэтому позволяет не злоупотреблять удобрениями, отлично работает даже в мерзлой почве.
На рынке сейчас предлагается несколько разновидностей аммиачной селитры с разной спецификой:
Б–марка – продается расфасованной в небольшие пакетики и предназначается специально для рассады и домашних цветов;
калийная – добавлен калий, который, как и азот, оказывает большое позитивное влияние на растения. Используется перед цветением, во время и при появлении завязей. Улучшает вкус плодов;
кальциевая – без содержащегося в этом удобрении кальция ухудшается корневая система, овощи становятся слабее, чахнут, перестают расти. Селитра с этим элементом увеличивает урожайность и срок его хранения;
натриевая – это щелочное вещество благоприятно для картофеля и свеклы;
магниевая – содержание магния помогает нормально развиваться бобовым и огородным растениям;
известковая – в этом удобрении соседствуют азот, магний, кальций и калий. Его экологичность сомнительна, так как перед расфасовкой вещество обрабатывают мазутом.
Где продается
Агро-Центр предлагает азотные удобрения – аммиачные и аммонийные, в широком ассортименте. Купить их в розницу и оптом по доступным ценам с доставкой можно в нашем магазине и онлайн.
Сотрудники Агро-Центра всегда готовы оказать помощь покупателю в выборе подходящего удобрения, подскажут нюансы его использования, дадут советы.
Правильный выбор удобрения, своевременное и строго дозированное внесение, тщательное следование инструкции – залог здоровья растений, их роста, цветения, получения хорошего вкусного урожая и его долгой сохранности!
Источник
Аммонийные удобрения
Аммонийные удобрения – группа твердых азотных удобрений, содержащих азот в форме катиона аммония NH4 + . Применяются в качестве основных удобрений. Бесхлорные аммонийные удобрения используют в качестве подкормок в течение вегетационного периода. Получают на основе химического взаимодействия аммиака с различными веществами (серной кислотой, хлоридом натрия, диоксидом углерода и прочими). [3]
Содержание:
Виды аммонийных удобрений
Сульфат аммония
Сульфат аммония-натрия
Крестоцветные (капуста)
Крестоцветные (капуста) — культуры, отзывчивые к внесению сульфата-аммония натрия.
Является хорошим удобрением для растений, отзывчивых на серу и натрий, в частности, для культур из семейства крестоцветных. (фото) Используется для основного, припосевного внесения и подкормок. [3]
Хлористый аммоний
Внешне хлорид аммония – мелкокристаллический желтоватый или чисто белый порошок. Обладает хорошей растворимостью. В 100 м 3 воды при 20 °C растворяется 37,2 г вещества. Удобрение малогигроскопичное, при хранении не слеживается.
Высокая физиологичческая кислотность и содержание хлора являются причиной основного использования хлорида аммония осенью под зяблевую вспашку. При таком внесении хлор будет вымыт из корнедоступного слоя атмосферными осадками. [3]
Карбонат аммония
Бикарбонат аммония содержит 17 % азота, более стоек к воздействию кислорода воздуха, но потери аммиака при хранении и перевозке не исключаются. При внесении его следует сразу заделывать в почву. [3]
Вискоза
Cульфат аммония используется при производстве вискозы.
Применение
Сельское хозяйство
Аммонийные удобрения применяют как минеральные удобрения для увеличения плодородия почвы и обеспечения растений необходимыми питательными веществами, в частности, азотом. [3]
Промышленность
Вещества, представляющие собой аммонийные удобрения, находят применение и в различных отраслях промышленности. Так, сульфат аммония применяют при производстве вискозного волокна и в стекольной промышленности. [2] (фото)
Схема реакции
Схема реакции взаимодействия катионов аммония с почвенно-поглощающим комплексом, согласно: [3]
Поведение в почве
После внесения в почву аммонийные удобрения быстро растворяются в почвенном растворе, и ион NН4 вступает в обменные реакции с ионами твердой фазы почвы. Значительная часть растворенных катионов аммония входит в почвенный поглощающий комплекс. Вследствие этого в почвенный раствор вытесняется эквивалентное количество ионов. (Изображение)
Вследствие этого процесса ион аммония теряет подвижность и хорошо усваивается растениями.
Не все ионы аммония поглощаются растениями, оставшаяся часть в результате нитрификации переходит в нитратную форму. Нитраты легко попадают в корневую систему растений путем биологического поглощения.
Процесс нитрификации приводит к образованию в почве азотной кислоты и освобождению соляной и серной кислот.
Бикарбонаты почвенного раствора и катионы ППК нейтрализуют образовавшиеся кислоты.
Схемы реакции
Схемы реакций нейтрализации азотной, серной и соляной кислот бикарбонатами почвенного раствора и катионами ППК, согласно: [3]
В результате реакций нейтрализации происходит вытеснение оснований из ППК водородом. Это ослабляет буферную способность почв и приводит к повышению их кислотности. (Изображение)
Кислотность почвы при внесении аммонийных удобрений повышается еще и из-за их собственной физиологической кислотности. Причина в том, что из аммонийных удобрений растениями быстрее поглощается катион аммония, чем анион хлора или серы. Поэтому в почве накапливаются кислотные остатки, вызывающие ее подкисление. [3]
Применение на различных типах почв
Применение аммонийных удобрений ограничивается их способностью подкислять почву. Однократное внесение аммонийных удобрений может и не повлиять на кислотность почв, но их использование в течение нескольких лет может значительно сдвинуть реакцию почвы в кислую сторону. Степень подкисления тем выше, чем меньше буферная способность почвы.
Повышение кислотности приводит к снижению эффективности азотных удобрений, поскольку в кислой среде течение реакции нитрификации сильно замедляется.
Источник
Соли аммония: свойства. Соли аммония: применение
Аммоний – одно из многочисленных соединений азота. Его соли обладают рядом интересных свойств и находят практическое применение во многих областях человеческой деятельности. Исследованием свойств этого элемента занимается химия. Соли аммония изучаются в разделе исследования взаимодействий азота с другими химическими элементами.
Что такое аммоний
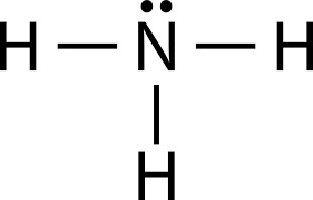
Чтобы узнать, что такое аммоний, следует более внимательно ознакомиться с принципом соединения азота и атомов углерода. Молекула аммиака записывается в виде NH3. Атом азота связан своими ковалентными связями с тремя протонами. Вследствие внутренней структуры азота одна связь остается нераспределенной.
Поэтому NH3 активно вступает в различные ковалентные связи с другими элементами, задействуя нераспределенную электронную пару. Если в соединение вступает ядро водорода, то образуется ион аммония. Схема реакции приведена ниже:
Как можно видеть, в данной реакции молекула аммиака является акцептором одного протона и тем самым ведет себя как основание. Аммоний в свободном виде не существует, так как практически мгновенно распадается на водород и аммиак. Соли аммония получаются в результате взаимодействия этого элемента с другими веществами. Как показывают практические опыты, аммоний вступает в различные соединения с кислотами, нейтрализуя их и образовывая соли аммония. Например, в случае вступления в реакцию с соляной кислотой происходит образование одной из солей этого элемента:
В результате реакции получается хлорид соли аммония.
Взаимодействие с водой
Аммоний хорошо взаимодействует с водой. В итоге реакции получаются гидраты аммиака усиленной концентрацией ОН — . Химическая запись реакции:
Поскольку количество ионов гидроксогруппы чрезвычайно велико, то водные растворы аммиака обладают щелочной реакцией. Однако по старой химической привычке водный раствор аммиака записывают, как NH4OH. Данное вещество называется гидроксидом аммония, а щелочную реакцию этого соединения рассматривают в виде диссоциации молекул, на которые раскладывается аммиак.
Соли аммония. Свойства и основные характеристики
Большая часть солей NH4 практически бесцветны и довольно хорошо растворяются в воде. Данное соединение обладает многими свойствами металлов, поэтому и соли аммония ведут себя так же, как и соли различных металлов. Вот несколько примеров такого подобия:
— Соли NH4 являются хорошими электролитами. Они подвергаются гидролизу в различных растворах. Эту реакцию можно проследить на примере диссоциации хлорида аммония:
— Подвержены гидролизу. В результате получается реакция соли слабого основания и сильной кислоты:
— имеют ионную кристаллическую решетку, обладают электропроводимостью;
— не выдерживают высоких температур и распадаются на составляющие.
Необратимые и обратимые процессы
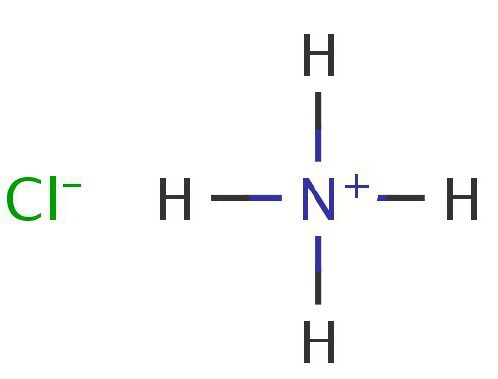
Распад солей аммония под воздействием температур может быть необратим, либо же представлять собой обратимый процесс. Если анион соли проявляет несильные свойства окислителя, соли распадается обратимо. Классическим примером такой реакции является хлорид аммония: при повышении температуры реакции он в конце концов распадается на собственные исходные элементы — хлористый водород, а также аммиак. Если стенки сосуда не прогревать, на них появляется налет. Так генерируется хлорид аммония.
Другие соли этого элемента, анион в которых имеет ярко выраженные свойства окислителя, распадаются безвозвратно. Стандартным примером такой реакции может служить распад нитрата аммония, который выглядит следующим образом:
Поскольку один из продуктов взаимодействия покидает ее поле, реакция прекращается.
Применение аммиака и солей аммония
Весомая доля аммиака, добываемого промышленным путем, идет на применение его в установках для заморозки и охлаждения. Находят соли аммония применение в повседневной жизни и в медицине. Но подавляющая часть аммиака идет на изготовление азотной кислоты и разнообразных азотсодержащих соединений, прежде всего, различных минеральных удобрений.
Азотистые удобрения
Наиболее известные соли производной азота, применение которых в хозяйственной деятельности крайне важно – это сульфат аммония, нитрат аммония, хлорид аммония. Азот – необходимая составляющая часть белков. Этот элемент является обязательным для существования любого живого организма. Растения извлекают азот из плодородного грунта, где этот элемент находится преимущественно в связанном виде. Обычно азот встречается, как соли аммония и соединения азотной кислоты. Растворяясь во влажной почве, эти неорганические соединения попадают в организмы растений и перерабатываются ими в различные белки и аминокислоты. Животные и люди не могут усваивать азот ни в свободном виде, ни в качестве его простых соединений. Для питания и роста им необходим белок, составной частью которого обязательно является азот. Только при участии растений мы получаем столь необходимый нам элемент для жизни и здоровья.
Сульфат аммония. Формула этого соединения — (NH4)2SO4. Эта соль аммония служит основой для множества удобрений.
Нитрат аммония. Формула этого вещества — NH4NO3. Это также известное удобрение, которое хорошо усваивается растениями. Кроме сельскохозяйственного применения, нитрат аммония используется в военной и горнодобывающей отрасли – на его основе изготавливаются взрывчатые смеси (аммоналы), применяемые для подрывных работ.
Нашатырь
Хлорид аммония. Хорошо известен, как нашатырь. Его химическая формула — NH4Cl. Это соединение хорошо известно в производстве лакокрасочной продукции, в текстильном деле, используется нашатырь и в гальванических элементах. Хорошо известен хлорид аммония пайщикам и лудильщикам. В своей работе они часто задействуют хлористые соли аммония. Применение этого вещества помогает удалить с поверхности металлов тончайшие оксидные пленки. Прикосновение разогретого металла к нашатырю вызывает соответствующую реакцию оксидов – они либо переходят в хлориды, либо восстанавливаются. Хлориды быстро улетучиваются с поверхности металла. Процесс реакции для меди может быть записан следующим образом:
Аммиак в жидком виде и крепкие растворы солей аммония также применяются в качестве азотных удобрений – содержание азота в них выше, чем в твердых удобрениях, и усваивается растениями он лучше.
Источник