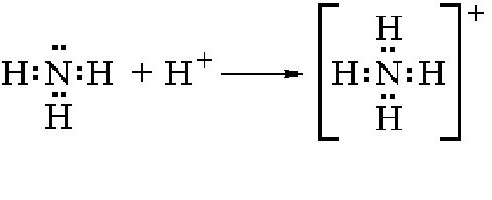Аммонийные удобрения
Содержание:
Виды аммонийных удобрений
Сульфат аммония
Подробнее при переходе по ссылке
Сульфат аммония-натрия
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
Хлористый аммоний
Внешне хлорид аммония – мелкокристаллический желтоватый или чисто белый порошок. Обладает хорошей растворимостью. В 100 м 3 воды при 20 °C растворяется 37,2 г вещества. Удобрение малогигроскопичное, при хранении не слеживается.
Высокая физиологичческая кислотность и содержание хлора являются причиной основного использования хлорида аммония осенью под зяблевую вспашку. При таком внесении хлор будет вымыт из корнедоступного слоя атмосферными осадками.
Карбонат аммония
Бикарбонат аммония содержит 17 % азота, более стоек к воздействию кислорода воздуха, но потери аммиака при хранении и перевозке не исключаются. При внесении его следует сразу заделывать в почву.
Применение
Сельское хозяйство
Аммонийные удобрения применяют как минеральные удобрения для увеличения плодородия почвы и обеспечения растений необходимыми питательными веществами, в частности, азотом.
Промышленность
Вещества, представляющие собой аммонийные удобрения, находят применение и в различных отраслях промышленности. Так, сульфат аммония применяют при производстве вискозного волокна и в стекольной промышленности.
Поведение в почве
Подробнее при переходе по ссылке
«>удобрения быстро растворяются в почвенном растворе, и ион NН4 вступает в обменные реакции с ионами твердой фазы почвы. Значительная часть растворенных катионов аммония входит в почвенный поглощающий комплекс. Вследствие этого в почвенный раствор вытесняется эквивалентное количество ионов. (Изображение)
Вследствие этого процесса ион аммония теряет подвижность и хорошо усваивается растениями.
Не все ионы аммония поглощаются растениями, оставшаяся часть в результате нитрификации переходит в нитратную форму. Нитраты легко попадают в корневую систему растений путем биологического поглощения.
Процесс нитрификации приводит к образованию в почве азотной кислоты и освобождению соляной и серной кислот.
Бикарбонаты почвенного раствора и катионы ППК нейтрализуют образовавшиеся кислоты.
В результате реакций нейтрализации происходит вытеснение оснований из ППК водородом. Это ослабляет буферную способность почв и приводит к повышению их кислотности. (Изображение)
Кислотность почвы при внесении аммонийных удобрений повышается еще и из-за их собственной физиологической кислотности. Причина в том, что из аммонийных удобрений растениями быстрее поглощается катион аммония, чем анион хлора или серы. Поэтому в почве накапливаются кислотные остатки, вызывающие ее подкисление.
Применение на различных типах почв
Применение аммонийных удобрений ограничивается их способностью подкислять почву. Однократное внесение аммонийных удобрений может и не повлиять на кислотность почв, но их использование в течение нескольких лет может значительно сдвинуть реакцию почвы в кислую сторону. Степень подкисления тем выше, чем меньше буферная способность почвы.
Повышение кислотности приводит к снижению эффективности азотных удобрений, поскольку в кислой среде течение реакции нитрификации сильно замедляется.
Источник
Соли аммония: свойства. Соли аммония: применение
Аммоний – одно из многочисленных соединений азота. Его соли обладают рядом интересных свойств и находят практическое применение во многих областях человеческой деятельности. Исследованием свойств этого элемента занимается химия. Соли аммония изучаются в разделе исследования взаимодействий азота с другими химическими элементами.
Что такое аммоний
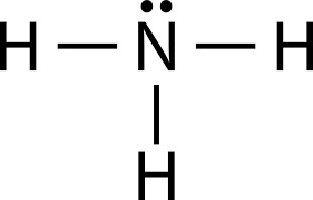
Чтобы узнать, что такое аммоний, следует более внимательно ознакомиться с принципом соединения азота и атомов углерода. Молекула аммиака записывается в виде NH3. Атом азота связан своими ковалентными связями с тремя протонами. Вследствие внутренней структуры азота одна связь остается нераспределенной.
Поэтому NH3 активно вступает в различные ковалентные связи с другими элементами, задействуя нераспределенную электронную пару. Если в соединение вступает ядро водорода, то образуется ион аммония. Схема реакции приведена ниже:
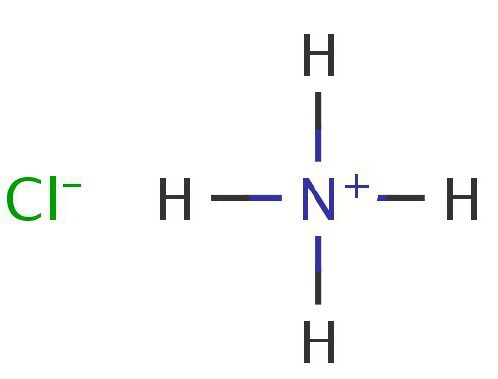
Как можно видеть, в данной реакции молекула аммиака является акцептором одного протона и тем самым ведет себя как основание. Аммоний в свободном виде не существует, так как практически мгновенно распадается на водород и аммиак. Соли аммония получаются в результате взаимодействия этого элемента с другими веществами. Как показывают практические опыты, аммоний вступает в различные соединения с кислотами, нейтрализуя их и образовывая соли аммония. Например, в случае вступления в реакцию с соляной кислотой происходит образование одной из солей этого элемента:
В результате реакции получается хлорид соли аммония.
Взаимодействие с водой
Аммоний хорошо взаимодействует с водой. В итоге реакции получаются гидраты аммиака усиленной концентрацией ОН — . Химическая запись реакции:
Поскольку количество ионов гидроксогруппы чрезвычайно велико, то водные растворы аммиака обладают щелочной реакцией. Однако по старой химической привычке водный раствор аммиака записывают, как NH4OH. Данное вещество называется гидроксидом аммония, а щелочную реакцию этого соединения рассматривают в виде диссоциации молекул, на которые раскладывается аммиак.
Соли аммония. Свойства и основные характеристики
Большая часть солей NH4 практически бесцветны и довольно хорошо растворяются в воде. Данное соединение обладает многими свойствами металлов, поэтому и соли аммония ведут себя так же, как и соли различных металлов. Вот несколько примеров такого подобия:
— Соли NH4 являются хорошими электролитами. Они подвергаются гидролизу в различных растворах. Эту реакцию можно проследить на примере диссоциации хлорида аммония:
— Подвержены гидролизу. В результате получается реакция соли слабого основания и сильной кислоты:
— имеют ионную кристаллическую решетку, обладают электропроводимостью;
— не выдерживают высоких температур и распадаются на составляющие.
Необратимые и обратимые процессы
Распад солей аммония под воздействием температур может быть необратим, либо же представлять собой обратимый процесс. Если анион соли проявляет несильные свойства окислителя, соли распадается обратимо. Классическим примером такой реакции является хлорид аммония: при повышении температуры реакции он в конце концов распадается на собственные исходные элементы — хлористый водород, а также аммиак. Если стенки сосуда не прогревать, на них появляется налет. Так генерируется хлорид аммония.
Другие соли этого элемента, анион в которых имеет ярко выраженные свойства окислителя, распадаются безвозвратно. Стандартным примером такой реакции может служить распад нитрата аммония, который выглядит следующим образом:
Поскольку один из продуктов взаимодействия покидает ее поле, реакция прекращается.
Применение аммиака и солей аммония
Весомая доля аммиака, добываемого промышленным путем, идет на применение его в установках для заморозки и охлаждения. Находят соли аммония применение в повседневной жизни и в медицине. Но подавляющая часть аммиака идет на изготовление азотной кислоты и разнообразных азотсодержащих соединений, прежде всего, различных минеральных удобрений.
Азотистые удобрения
Наиболее известные соли производной азота, применение которых в хозяйственной деятельности крайне важно – это сульфат аммония, нитрат аммония, хлорид аммония. Азот – необходимая составляющая часть белков. Этот элемент является обязательным для существования любого живого организма. Растения извлекают азот из плодородного грунта, где этот элемент находится преимущественно в связанном виде. Обычно азот встречается, как соли аммония и соединения азотной кислоты. Растворяясь во влажной почве, эти неорганические соединения попадают в организмы растений и перерабатываются ими в различные белки и аминокислоты. Животные и люди не могут усваивать азот ни в свободном виде, ни в качестве его простых соединений. Для питания и роста им необходим белок, составной частью которого обязательно является азот. Только при участии растений мы получаем столь необходимый нам элемент для жизни и здоровья.
Сульфат аммония. Формула этого соединения — (NH4)2SO4. Эта соль аммония служит основой для множества удобрений.
Нитрат аммония. Формула этого вещества — NH4NO3. Это также известное удобрение, которое хорошо усваивается растениями. Кроме сельскохозяйственного применения, нитрат аммония используется в военной и горнодобывающей отрасли – на его основе изготавливаются взрывчатые смеси (аммоналы), применяемые для подрывных работ.
Нашатырь
Хлорид аммония. Хорошо известен, как нашатырь. Его химическая формула — NH4Cl. Это соединение хорошо известно в производстве лакокрасочной продукции, в текстильном деле, используется нашатырь и в гальванических элементах. Хорошо известен хлорид аммония пайщикам и лудильщикам. В своей работе они часто задействуют хлористые соли аммония. Применение этого вещества помогает удалить с поверхности металлов тончайшие оксидные пленки. Прикосновение разогретого металла к нашатырю вызывает соответствующую реакцию оксидов – они либо переходят в хлориды, либо восстанавливаются. Хлориды быстро улетучиваются с поверхности металла. Процесс реакции для меди может быть записан следующим образом:
Аммиак в жидком виде и крепкие растворы солей аммония также применяются в качестве азотных удобрений – содержание азота в них выше, чем в твердых удобрениях, и усваивается растениями он лучше.
Источник
Как правильно применять сульфат аммония на огороде и в саду?
Сульфат аммония является одним из популярных средств улучшения урожая. Состав этого тука прекрасно удовлетворяет потребности растения в азоте и сере, стимулирует активность клеточных процессов, улучшает показатели плодов. Сульфат аммония применим для любых почв, весьма эффективен в саду и огороде, доступен по цене и прост в применении.
Состав и свойства сульфата аммония
Сернокислый аммоний относится к минеральным солям, внешне представляет собой прозрачные или белые кристаллы мелкой фракции. Химическая формула сульфата аммония – (NH4)2SO4, согласно которой вещество состоит из 21% азота и 24% серы. Эти компоненты представлены в форме ионов, благодаря чему полностью усваиваются растительными культурами.
Полезные свойства и состав сульфата аммония позволяют применять вещество в качестве минерального удобрения. Этот тук имеет массу положительных сторон:
- составляющие препарат азот и сера незаменимы в регулировании клеточных процессов растения, необходимы для вегетации и образования плодов;
- химикат отлично растворим в воде, используется для разнообразных подкормок весь дачный сезон, может сочетаться с другими минеральными добавками;
- в почве не слеживается и не вымывается;
- средство безопасно для использования;
- качество плодов при использовании удобрения существенно улучшается, они сохраняют сочность и свежесть длительное время;
- не аккумулируется в виде нитратов в корнеплодах и листьях.
Общие рекомендации по применению
Агрохимикат практически не имеет противопоказаний, он эффективен на различных грунтах независимо от климатической зоны.
При выборе сульфата аммония в качестве удобрения следует знать некоторые нюансы его применения на огороде и в саду:
- Высокое содержание азота и серы позволяет использовать тук как стартовую подкормку весной.
- Препарат результативен в любом виде: сухим его рассыпают при перекопке, в водном растворе применяется для полива и внекорневых подкормок.
- Из-за окислительных свойств на кислых почвах средство рекомендовано вносить с щелочными веществами в равных частях.
- Усредненная дозировка внесения добавки составляет от 20 до 40 г на квадрат.
- Сернокислый аммоний не восполняет весь комплекс необходимых растению веществ, применяется в комплексе с другими минералами.
- Чтобы азот при реакции с землей из аммонийной формы не перешел в нитратную, рекомендовано использовать водный раствор химиката.
Применение на различных типах почв
Сульфат аммония быстро растворяется и поглощается корневой системой. Вещество не испаряется и не вымывается из грунта. Особенно эффективен препарат на необработанных почвах. На окультуренных грунтах азот превращается в нитрат. Это происходит в результате работы бактерий почвы.
В нитрификации нет ничего фатального, ведь в такой форме компонент хорошо усваивается, а вместе с ним лучше поглощаются калий, магний и кальций.
На кислых почвах
Использовать аммонийную соль на кислых грунтах не рекомендуется, так как она обладает окислительным свойством. Чтобы реакция удобрения с почвой было контролируемой, следует вносить на каждые 100 кг агрохимиката по 130 кг извести.
На черноземах
Черноземные грунты богаты гумусом, потому устойчивы к изменению реакции. В течение 15 лет такая земля остается нейтральной, при небольшом подкисливании качество урожая сохраняется.
На глинистых и суглинистых почвах
На грунтах с содержанием глины или торфа преобразование азота в нитритную форму происходит очень долго из-за малого количества нитрифицирующих микроорганизмов. Прежде чем применять сульфат аммония на такой земле, ее предварительно следует осушить и разрыхлить.
На песчаных и супесчаных почвах
На легких песчаных грунтах тук весьма эффективен, так как они нейтральны и обеспечивают слабую миграцию аммония. Однако следует учитывать, что спустя 5 лет после постоянного применения этого удобрения почва может сильно окислиться, и произойдет дефицит карбонатов, содержащихся в ней. Поэтому ежегодно дачнику следует контролировать почвенный PH-баланс.
Инструкция по применению сульфата аммония
Удобрение особенно результативно при применении весной во время перепахивания, так как азот и сера в его составе помогают растениям активно наращивать зеленную массу. Такое средство прекрасно подходит для многих культур. Помимо стартовой подкормки, его можно использовать до 3 раз в середине сезона. Уникальность сульфата аммония в том, что он, в отличие от других препаратов с содержанием аммиака, полностью поглощается садовыми и огородными насаждениями в любом виде. Наиболее эффективны жидкие средства: благодаря хорошей растворимости препарат усваивается моментально, а в сухом виде разложение происходит спустя несколько суток.
Овощные культуры и картофель
Агрохимикат благотворно влияет на качество урожая корнеплодов, крестоцветных и пасленовых культур, редьки, кукурузы, подсолнуха, щавеля, редиса, рапса, пшеницы и гречихи. Сульфат аммония как удобрение имеет определенные нормы применения на огороде для разных растений:
- Огурцы, томаты, перец и баклажаны подкармливают перед высаживанием рассады во время подготовки грядки, внося по 15 г на квадрат. Далее можно удобрять препаратом до 3 раз за сезон в сухом виде после осадков или путем полива по 40 г на квадратный метр. Наиболее полезен раствор из 10 г химиката на ведро воды. За 3 недели до сбора плодов подкормки прекращают.
- Все виды капусты удобряют только при перекопке, добавляя по 30 г порошка на 1 м2. Если внести добавку при посадке не успели, то подкормить можно до образования кочана водным раствором из 30 г соли на ведро.
- При использовании сульфата аммония для картофеля, моркови, свеклы получаются вкусные сочные корнеплоды, так как его компоненты способствуют накоплению сахаров. Перед посадкой вносят по 25-40 г сухого вещества на квадрат. Далее можно произвести еще 2-3 подкормки не позднее, чем за 2 недели до выкапывания.
При применении сульфата аммония картофельные клубни меньше подвергаются гниению и поражению паршой.
Плодовые деревья
Использование сернокислого аммония в садоводстве способствует образованию крупных и сладких плодов, фрукты хорошо хранятся и долго не портятся. Подкармливать кусты и фруктовые деревья нужно весной сухим порошком, внося в углубления приствольного круга по 25 г на каждое растение.
При высадке саженцев в низ ямы добавляют смесь из двух лопат перепревшего навоза и 20 г препарата. Молодые кустики и деревца удобряют аммонийной солью раз в год, в течение сезона никаких азотных удобрений вносить больше не требуется.
Зелень и огородные травы
Петрушка, укроп, сельдерей, кориандр, базилик, мята и другие пряные травы хорошо реагируют на подкормки сульфатом аммония. Вносить его можно перед высевом по 20 г на квадрат или после проклевывания по 7 г на 1 м² между рядками. В середине вегетации лучше подкармливать жидким средством из 10 г порошка на ведро воды до 3 раз. Удобрение перестают использовать за 14 дней до предполагаемой срезки трав.
Ягодные кустарники
Вносить препарат рекомендуется при подготовке гряды для клубники или земляники по 25 г на квадратный метр. Когда кустики хорошо приживутся, используют раствор из столовой ложки агросредства и 10 л воды, поливают по литру на растение.
Цветочные культуры
Садовые цветы можно удобрять весной перед высадкой, внося по 20-25 г вещества на квадрат при перекапывании. Далее во время вегетации можно сделать 2-3 подкормки раствором из 10 г и ведра воды.
Сочетание с другими подкормками
Сульфат аммония не обеспечивает полного питания растениям, так как для полноценного развития помимо азота и серы им требуются калий, кальций, фосфор, магний и другие элементы.
Чтобы восполнить запас необходимых растительным культурам компонентов и получить хороший результат, сернокислый аммоний можно применять в составе питательных смесей с другими минеральными средствами. Это удобрение сочетается с аммофоской, диаммофоской, нитрофоской, аммиачной селитрой, мочевиной, калийной солью и хлористым калием.
Некоторые составы нужно готовить прямо перед внесением, так как при хранении они могут слежаться. К таковым относится сочетание сульфата аммония с суперфосфатом, фосфоритной и костной мукой, натриевой, калийной и кальциевой селитрой.
Не сочетается аммонийная соль с золой, фосфат-шлаком, навозом и пометом из-за потери азота в процессе реакции.
Условия хранения
Агрохимикат не нуждается в особых условиях хранения, он не слеживается и не сыреет. Но держать упаковку лучше в сухом помещении. Производители не ограничивают сроки хранения, однако препарат рекомендовано использовать в течение 6-12 месяцев, так как эффективность активных компонентов со временем снижается.
Зная, для чего применяется сульфат аммония, можно улучшить вкус и качество урожая на даче. Несмотря на то что удобрение немного дороже других туков азотной группы, оно удобно в использовании и хранении, прекрасно сочетается с другими средствами и совершенно безопасно для человека и растений.
Источник