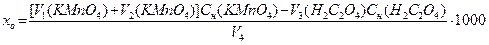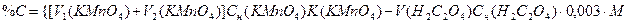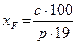Использование метода водной вытяжки в почвенных исследованиях



Метод водных вытяжек применяют при исследовании динамики почвенных процессов, изучении режима различных элементов, в том числе и питательных веществ, вредных корневых выделений (колинов) и прочих токсикантов, которые накапливаются в почве, а также при решении некоторых других задач. Но наиболее часто этот метод используют пр анализе засоленных почв. Исследование водной вытяжки является обязательным для всех щелочных почв. При анализе засоленных почв водная вытяжка имеет исключительное значение, так как позволяет оценить наиболее важную их генетико-агрономическую особенность – специфику ионно-солевого комплекса.
Ионно-солевой комплекс засоленных почв – это вся совокупность солей и ионов находяшихся в разных формах: жидкой (почвенный раствор), твердой (кристаллические водорастворимые соли), сорбированной (обменные основания) и связанных между собой динамическим равновесием (слайд 33).
Сущность метода водной вытяжки заключается в кратковременном (3 мин.) взаимодействии дистиллированной воды с почвой, в соотношении 1:5 (слайд 34). Это приводит к растворению легкорастворимых (карбонат и гидрокарбонат натрия, гидрокарбонаты кальция и магния, хлориды натрия, магния и кальция сульфаты магния и натрия) и труднорастворимых солей (гипс, карбонаты кальция и магния), содержащихся в почве.
Выделяют полную и сокращенную водную вытяжку. При полной водной вытяжке определяют сухой (плотный) остаток, прокаленный остаток, главные анионы – карбонат, гидрокарбонат, сульфат, хлорид и катионы кальция, магния, натрия, калия. В щелочных почвах в водную вытяжку могут переходить заметные количества кремнекислоты, алюминатов, органических веществ. В водную вытяжку переходят водорастворимые фосфаты, соединения азота и микроэлементы, что отражается на величине сухого остатка.
При сокращенной водной вытяжке ограничиваются определением сухого остатка и некоторых, наиболее интересующих в конкретном случае, катионов и анионов.
Главным преимуществом этого метода является вид используемого экстрагента. Применение дистиллированной воды, по сути, имитирует действие на почву атмосферных осадков, таким образом, в какой-то мере воссоздается природная ситуация. Это исключает трансформацию органической и минеральной части почвы. Этот метод применим на любых почвах, и не требует специальной подготовки почвы и оборудования. Водную вытяжку можно получить даже из почв, имеющих полевую влажность.
Главный недостаток водной вытяжки – принятое в методе широкое соотношение почва: раствор, которого не бывает в природной обстановке (слайд 35). Поэтому химический состав водной вытяжки не аналогичен почвенным растворам, циркулирующим в почвенном профиле засоленных почв. Строго говоря, при попадании в почву дистиллированной воды на почву действует уже не дистиллированная вода, а раствор солей, что приводит к изменению растворимости некоторых компонентов почвы. Кроме того, если такие почвы, как солончаки, очень хорошо фильтруются, то при приготовлении водной вытяжки из солонцов, напротив, происходит очень медленная фильтрация, а фильтрат практически всегда оказывается загрязнен коллоидными частицами. Приходится применять центрифугирование почвенной вытяжки для отделения коллоидов.
При определении степени и химизма засоления почв с помощью водной вытяжки целесообразнее проводить классификацию почв по содержанию токсичных солей (т. е. легкорастворимых) (слайд 36).
Результаты анализа водных вытяжек из засоленных почв представляют в виде таблиц (слайд 37) и солевых профилей (слайд 38).
Однако при всех своих недостатках этот метод широко и часто применяется в почвенных исследования. Водная вытяжка остается базовым методом для изучения засоленных почв. Полученные с ее помощью данные используют для генетической диагностики почв, в агрономической и мелиоративной практике.
Источник
Анализ почвенных растворов. Водные вытяжки
Нам уже известно, что почвенные растворы представляют собою наиболее естественный и наиболее легко восприемлемый источник питания культурных растений и что активную способность этих последних добывать себе пищу из твердой фазы почвы мы должны признать до некоторой степени вынужденной, к каковой способности растения прибегают лишь в том случае, когда в почвенном растворе не имеется налицо достаточного количества того или другого необходимого для них питательного соединения. С этой точки зрения значение в жизни культурных растений почвенных растворов громадно (впрочем, указанную выше вынужденную способность мы должны признать в большинстве случаев и обычной, ибо, как о том у нас была речь выше, почвенные растворы в силу своей легкоподвижности и изменяемости являются источником питания для растений не всегда надежным).
Что же касается в частности азота, т. е. того элемента, по отношению к которому, как нам уже известно, наиболее часто наблюдается истощение почвы и голодание со стороны культурных растений, то почвенные растворы мы должны признать источником, кроме того, и единственным, откуда высшие растения только и могут почерпать себе необходимую им азотистую пищу. Чтобы убедиться в этом, достаточно вспомнить, в каких формах встречается в почвах азот.
Последний, как нам уже известно, может находиться в почвах или в форме различных органических соединений (входя, например, в состав почвенного перегноя) или в форме соединений минеральных — аммиачных солей, нитритных и нитратных. Так как органическую форму азота мы можем считать высшими растениями практически не восприемлемой, то единственным источником азотистого питания упомянутых растений мы должны признать лишь продукты распада органического азота, а именно соли аммиака, азотистой и азотной кислоты; а все эти соединения являются, как известно, легко растворимыми в воде и в силу этого находящимися именно в почвенном растворе (за исключением того аммиака, который является поглощенным гуматной частью почвы, но в таковой форме он является для растений недоступным).
Итак, весь усвояемый культурными растениями азот находится в почвенном растворе, и другого какого-либо источника, откуда эти растения могли бы непосредственно извлечь необходимую им азотистую пищу, в почве не имеется, как бы мы высоко ни оценивали активную «растворяющую» силу корневой системы растений. Этим фактом еще более подчеркивается то громадное значение, которое играют в жизни культурных растений циркулирующие в почве растворы и которое отмечено нами выше.
Таким образом, если усвояемые формы фосфора, калия и др. обычно стремятся определять помощью слабокислотных вытяжек, исходя из тех соображений, что в большинстве случаев почвенные растворы содержат этих элементов недостаточное количество, в силу чего сами растения вынуждаются прибегать к активной работе по добыванию необходимой им фосфорной, калийной и др. пищи и из твердой части почвы, то количество усвояемого азота мы в каждый данный момент могли бы определять, изучая состав имеющегося в почве почвенного раствора.
Исходя, таким образом, из соображения, что почвенные растворы являются наиболее естественными и наиболее легко восприемлемыми, а по отношению к азоту (а может быть, и к сере?) и единственным источником питания для культурных растений, мы должны отметить то громадное сельскохозяйственное значение, которое имеют все попытки так или иначе изучить характер, состав и свойства почвенного раствора.
Мы уже ознакомились с теми методами, которые применяются к изучению этих растворов. Напомним, что методы эти можно подразделить на три категории; одни из них стремятся предварительно так или иначе выделить из почвы почвенный раствор (в «неизменном» виде) и затем уже подвергать последний изучению; другие стремятся проникнуть во внутреннюю природу почвенного раствора без предварительного выделения его из почвы. Наконец, третьи стараются подойти к изучению природы, состава и свойств почвенных растворов помощью исследования водных вытяжек из почвы.
Что касается первого метода, то, принимая во внимание, что почвенный раствор в отношении концентрации растворенных веществ пространственно не однороден (в силу явлений положительной или отрицательной адсорбции — см. выше), требуется при применении тех или иных манипуляций полная уверенность, что весь почвенный раствор вытеснен из почвы целиком, ибо оставшаяся не вытесненной часть раствора может оказаться или наиболее концентрированной (если в почве имеет место явление положительной адсорбции) или же, наоборот, наименее концентрированной (в случае наличия явлений отрицательной адсорбции), что в результате может дать нам превратное суждение об истинной природе почвенного раствора. А как раз ни один из имеющихся методов вытеснения последнего не дает нам в этом отношении твердой уверенности, и в этом их слабая сторона.
Что же касается второго метода, т. е. попыток изучения внутренней природы и свойств почвенного раствора без предварительного их выделения из почвы («электрический» метод Whitneyn Briggs и«криоскопический» метод BouyoucosnMc Cool), то, неговоря уже о том, что этими методами определяется лишь общая концентрация почвенного раствора, без возможности проникнуть в его ближайший состав, необходимо, кроме того, отметить и недостаточную еще их разработанность, в силу чего методы эти являются еще мало применимыми для разрешения тех задач, которые ставит себе агрономия в связи с изучением почвенных растворов вообще (ценные результаты могут дать эти методы разве только при разрешении вопросов, связанных со степенью засоленности почв).
Что касается, наконец, водных вытяжек из почвы как метода изучения почвенных растворов, то мы уже отмечали в своем месте, что отожествлять состав их с составом «истинного» почвенного раствора можно лишь с большой осторожностью. He повторяя тех доводов, которые приводились в пользу этого положения нами раньше, укажем только, что исследования К. Гедройца совершенно наглядно показали, что при обработке почвы водою в раствор идут не только имеющиеся в этой почве легко растворимые соединения, но что при этом разрушается и часть трудно растворимых алюмосиликатов. Воздействуя на суглинистый чернозем и оподзоленный суглинок различными количествами воды (в течение 3 минут), упомянутый ученый нашел следующее количество перешедших в раствор минеральных веществ (в граммах):
Источник
Анализ водной вытяжки из почв
Анализ водной вытяжки из почвы дает сведения о составе и количестве легкорастворимых веществ почвы и позволяет установить степень и характер засоления почвы.
Состав водной вытяжки из почв
При действии воды на почву происходит растворение минеральных соединений и частично гумусовых веществ, а в некоторых случаях идет также процесс разложения сложных силикатов. В дальнейшем почва взаимодействует уже не с водой, а с образовавшимся сложным раствором, где могут протекать реакции взаимного обмена между катионами вытяжки и катионами поглощающего комплекса почвы. Щелочная реакция почв увеличивает растворимость гумусовых веществ, кислая реакция почв повышает растворимость полуторных оксидов. В связи с этим условия и время приготовления водной вытяжки должны быть строго стандартными. Общепринято приготовлять водную вытяжку из почвы (измельченная и просеянная средняя проба) путем пятиминутного взбалтывания ее с водой, не содержащей СО2, при соотношении почвы к воде 1:5.
Важной характеристикой свойств почвы является величина рН водной суспензии. В зависимости от значения рН определяют кислотность или щелочность водной вытяжки почвы и выбирают соответствующий ход дальнейшего анализа. В водной вытяжке из почвы чаще всего определяют анионы: СO3 2- , HCO3 — , Cl — , SO4 2- и катионы: Ca 2+ , Mg 2+ , K + , Na + . В специальных случаях проводят определение HSiO3 — , H2PO4 — , HPO4 2- , Fe 3+ , Fe 2+ , Al 3+ , NH4 + и др., общей минерализации, общей щелочности, общей кислотности, водно-растворимых органических веществ (окисляемости) и т.д.
Результаты анализа принято выражать количеством мг-экв вещества на 100 г почвы.
Определение величины рН проводят в фильтрате сразу после приготовления водной вытяжки из почвы или, что более правильно, в суспензии (до фильтрования). Для измерения рН суспензию готовят при отношении почвы к воде 1:2,5 (20 г почвы и 50 мл дистиллированной воды). Определение рН проводят с помощью рН-метра.
Приготовление водной вытяжки из почв
Состав водной вытяжки меняется при соприкосновении ее с почвой и с воздухом, поэтому все определения проводятся в возможно короткий срок. Прежде чем приступить к приготовлению водной вытяжки, следует собрать установку для фильтрования и приготовить необходимые для дальнейших определений реагенты.
На технических весах отвешивают 100 г воздушно-сухой почвы (средняя проба) и количественно переносят в емкость для взбалтывания. Отмеряют мерной колбой 500 мл дистиллированной воды, не содержащей СО2. Получают гетерогенную систему, в которой отношение почвы к воде равно 1:5. Емкость закрывают пробкой и энергично встряхивают 5 мин. По окончании взбалтывания всю суспензию почвы с водой, не давая ей отстояться, осторожно и быстро фильтруют. Фильтр помещают в воронку диаметром 15 – 20 см. Одиночный фильтр легко прорывается при перенесении на него почвы, поэтому под него подкладывают беззольный фильтр. Нельзя допускать, чтобы фильтр был выше воронки; в этом случае раствор, поднимаясь по капиллярам бумаги, образует «выцветы» солей по краю фильтра и тем самым снижает концентрацию их в фильтрате. Фильтрование следует проводить в комнате, свободной от паров HCl и других кислот, а также от паров аммиака. В качестве приемника используют сухую коническую колбу на 500 мл. Если первые порции фильтрата окажутся мутными, то его следует перефильтровать через этот же фильтр сразу, не дожидаясь конца фильтрования. По окончании фильтрования колбу с фильтратом следует закрыть сухой пробкой.
Все количественные определения из водной вытяжки необходимо проводить сразу после ее приготовления.
Множители пересчета объема вытяжки на 100 г почвы (при соотношении почвы к воде или другому растворителю как 1:5)
| Анализируемый объем, мл | Вес почвы, соответствующий анализируемому объему, г | Множитель пересчета на 100 г почвы |
| 0,2 | 2,5 |
Определение общей и частной щелочности (карбонатов и гидрокарбонатов)
Щелочность водной вытяжки из почвы обусловлена присутствием в ней растворимых карбонатов и гидрокарбонатов. Суммарное содержание ионов СО3 2- и НСО3 — соответствует общей щелочности, содержание СО3 2- – частной щелочности.
Определение карбонатов и гидрокарбонатов при совместном присутствии аналогично титрованию двух слабых оснований, одно из которых является двухкислотным:
Если вести титрование такой смеси с использованием двух индикаторов – фенолфталеина и метилового оранжевого, то по фенолфталеину двухкислотное основание (СО3 2- ) будет оттитровано по первой стадии; при дальнейшем титровании по метиловому оранжевому будет оттитровано второе основание (НСО3 — ) и первое основание (СО3 2- перешедший в НСО3 — ) до конца.
Методика определения. Аликвоту водной вытяжки (25 мл) переносят в колбу для титрования, добавляют 2 капли фенолфталеина и осторожно, по каплям титруют 0,01 н. раствором HCl до исчезновения розовой окраски (V1). В обесцветившийся раствор добавляют 2 капли метилового оранжевого и дотитровывают по каплям 0,01 н. раствором HCl до перехода окраски из желтой в оранжевую. Если рН водной вытяжки почвы менее 8, то определяют щелочность только с индикатором метиловым оранжевым.
Результаты определения выражают количеством мг-экв СО3 2- (m1) и НСО3 — (m2) на 100 г почвы:
где р – навеска почвы в объеме 25 мл водной вытяжки (см. табл.1).
Тогда частная щелочность соответствует m1, а общая щелочность –
Определение кальция и магния (жесткости)
Определение кальция и магния проводят с помощью комплексонометрического титрования. В одной порции раствора определяют суммарное содержание кальция и магния, титруя раствором ЭДТА в присутствии индикатора ЭХЧТ в условиях аммиачного буфера; в другой порции раствора определяют кальций, проводя титрование в сильнощелочной среде в присутствии индикатора мурексид. Содержание магния находят по разности.
Методика определения. Аликвоту водной вытяжки 10 мл переносят в колбу для титрования и добавляют 50 мл воды. Добавляют 5 мл 2н. раствора NaOH, мурексид на кончике шпателя и титруют 0,025 М раствором ЭДТА до перехода окраски из розовой в лиловую (V1).
Следующую аликвоту водной вытяжки 10 мл переносят в колбу для титрования, добавляют 50 мл воды, 5 мл аммиачного буферного раствора. Вносят индикатор ЭХЧТ на кончике шпателя и титруют 0,025 М раствором ЭДТА до перехода окраски из сиреневой в синюю (V2).
Результаты анализа выражают количеством мг-экв Са 2+ и Mg 2+ на 100 г почвы:
Нитрит-ионы являются промежуточным продуктом биохимического окисления аммиака или восстановление нитрат-ионов. Для их определения предлагается фотометрический метод с сульфаниловой кислотой и a-нафтиламином. Метод основан на диазотировании сульфаниловой кислоты присутствующими в пробе нитритам-ионами и реакции полученной соли с a-нафтиламином с образованием красно-фиолетового азокрасителя. Интенсивность окраски пропорциональна концентрации нитрит-ионов.
Методика определения. Для определения берут аликвоту водной вытяжки 2 мл в колбу на 50 мл, прибавляют 1 мл раствора сульфаниловой кислоты и смесь тщательно перемешивают. После пятиминутного стояния прибавляют 1 мл раствора a-нафтиламина, разбавляют водой до метки, перемешивают. Через 40 минут замеряют оптическую плотность раствора при длине волны 540 нм в кювете толщиной 5 см на фоне дистиллированной воды.
Результаты анализа выражают количеством мг-экв нитрит-ионов на 100 г почвы
где с – содержание нитрит-ионов, найденное по ГГ, мг/л; р – навеска почвы в объеме 2 мл водной вытяжки (см. табл.1); 46 – эквивалент нитрит-иона; 20 – разбавление (1000 мл /50 мл).
Определение водно-растворимых органических веществ (общей окисляемости)
Почвенные воды и водные вытяжки из почв содержат водно-растворимые органические вещества, количество которых характеризует «подвижность» гумуса. О количестве органических веществ судят по количеству окислителя, необходимому для их окисления, т.е. по «окисляемости» таких растворов. В зависимости от используемого окислителя различают «перманганатную» и «бихроматную» окисляемость (они не одинаковы). Оба вида окисляемости определяются косвенными методами – титрованием избытка окислителя, не вошедшего в реакцию с органическими веществами.
Определение перманганатной окисляемости
Органические вещества окисляются в кислой среде перманганатом калия при нагревании, избыток его разрушается оксалатом натрия или щавелевой кислотой, а избыток последних оттитровывают перманганатом калия, т.к. непосредственно избыток перманганата калия оттитровать оксалатом натрия затруднительно вследствие выделения значительного выделения MnO2. Метод можно использовать только для проб, окисляемость которых ниже 100 мг О/ л.
Методика определения. В колбу для титрования помещают несколько стеклянных шариков или кусочков керамики и вносят 10 мл аликвоты, доводят водой до 100 мл, приливают 5 мл разбавленной H2SO4 и 20 мл 0,01 н. раствора KMnO4. Смесь нагревают так, чтобы она закипела через 5 мин и кипятят 10 мин. К горячему раствору прибавляют 20 мл 0,01 н. раствора Н2С2О4. Обесцвеченную смесь титруют горячей (лучше при 80-90°С) 0,01 н. раствором KMnO4 до розового окрашивания.
Если раствор при кипячении обесцветится или побуреет, то определение повторяют с разбавленной пробой.
Результаты анализа выражают количеством мг-экв окисляющих веществ в 1 л раствора
где V1 и V2 – объемы KMnO4, пошедшие на окисление органических веществ и щавелевой кислоты, V3 – объем щавелевой кислоты, V4 – объем анализируемой пробы, мл.
Также можно результаты определения водорастворимых органических соединений вычислять в процентном содержании углерода или перегноя:
где М – множитель для пересчета взятого объема вытяжки на 100 г почвы, 0,003 – граммовое значение мг-экв углерода.
Доступный для питания растений фосфор находится в почве преимущественно в виде соединений с кальцием, магнием и полуторными оксидами. Во все методах определения усвояемого, или доступного, фосфора количественный учет Р2О5 ведут фотометрическим методом. Метод основан на частичном восстановлении Мо (VI) фосфорномолибденовой гетерополикислоты до низших валентностей, в результате чего образуется молибденовая синь, интенсивность окраски которой пропорциональна концентрации фосфат-ионов в растворе.
Приготовление составного реактива.К 300 мл бидистиллята приливают при перемешивании 144 мл концентрированной серной кислоты H2SO4. Затем охлаждают приблизительно до 20°С и при перемешивании добавляют раствор 10 г сульфаминовой кислоты NH2SO3H в 100 мл дистиллированной воды, раствор 12,5 г молибдата аммония (NH4)2MoO4·4H2O в 200 мл дистиллированной воды, раствор 0,235 г хлорида сурьмы SbCl3 и 0,6 г винной кислоты или 0,345 г антимонилтартрата калия KSbOC4H4·0,5H2O в 100 мл дистиллированной воды. После этого разбавляют смесь до 1 л дистиллированной водой. Реактив хранят в склянке из оранжевого стекла.
Методика определения. Берут аликвоту 5 мл водной вытяжки в мерную колбу на 50 мл, добавляют 2 мл составного реактива, перемешивают. Затем добавляют 0,5 мл аскорбиновой кислоты, разбавляют водой до метки и перемешивают. Оптическую плотность замеряют через 15-20 мин при длине волны 670 нм в кювете с толщиной 5 см на фоне дистиллированной воды.
Результаты анализа выражают количеством мг-экв фосфат-ионов на 100 г почвы
где с – содержание фосфат-ионов, найденное по ГГ, мг/л; р – навеска почвы в объеме 5 мл водной вытяжки (см. табл.1); 95 – эквивалент фосфат-иона; 20 – разбавление (1000 мл /50 мл).
Результаты анализа можно также выразить в виде мг-экв оксида фосфора на 100 г почвы
где 142/95×2 – фактор пересчета фосфат-иона на оксид фосфора.
Определение фторид-ионов в почве
Пробоподготовка. Для определения содержания водорастворимой формы фтора точную навеску тонкоизмельченной пробы 5 г помещают в полиэтиленовую емкость, добавляют 50 мл воды. Содержимое встряхивают в течение 15 мин и оставляют на ночь. После стояния содержимое перемешивают круговыми движениями и фильтруют.
Приготовление составного реактива. В мерной колбе на 250 мл растворяют 0,0526 г безводного ализаринкомплексона в 30 мл воды с добавлением нескольких капель концентрированного аммиака, добавляют 100 мл диметилформамида (ДМФА) и 37,5 мл ацетатного буферного раствора (рН 4,1 – 4,2). После тщательного перемешивания добавляют 2,5 мл 0,05 М раствора нитрата лантана, доводят водой до метки и перемешивают (раствор можно хранить в течение 6 месяцев).
Построение градуировочного графика. Для построение градуировочного графика в мерные колбы на 25 мл вводят 0,5; 1; 1,5; 2; 2,5 мл раствора фторида натрия с титром по фтору 19 мкг/мл, добавляют 10 мл составного реактива АК-La и доводят водой до метки. Полученные растворы тщательно перемешивают и через 20 мин замеряют оптическую плотность при длине волны 620 нм. Измерения проводят в кювете с толщиной 1 см на фоне составного реактива той же концентрации.
Определение концентрации фторид-ионов. Из фильтрата отбирают аликвоту 10 мл в мерную колбу на 25 мл, добавляют 10 мл составного реактива и доводят водой до метки. Перемешивают и замеряют оптическую плотность как при построении ГГ.
Результаты анализа выражают количеством мг-экв фтора на 100 г почвы
где с – содержание фторид-ионов, найденное по ГГ, мкг/25 мл раствора; р – навеска почвы в объеме 10 мл водной вытяжки (см. табл.1); 19 – эквивалент фосфат-иона.
Источник