Раздел «Культуры растительных клеток»
Культуры клеток высших растений
Суспензионные культуры
Суспензионные культуры — отдельные клетки или группы клеток, выращиваемые во взвешенном состоянии в жидкой среде. Представляют собой относительно гомогенную популяцию клеток, которую легко подвергнуть воздействию химических веществ.
Суспензионные культуры широко используются в качестве модельных систем для изучения путей вторичного метаболизма, индукции ферментов и экспрессии генов, деградации чужеродных соединений, цитологических исследований и др.
Признаком «хорошей» линии служит способность клеток к перестройке метаболизма и и высокая скорость размножения в конкретных условиях культивирования. Морфологические характеристики такой линии:
- высокая степень дезагрегации (5-10 клеток в группе);
- морфологическая выравненность клеток (небольшие размеры, сферическая или овальная форма, плотная цитоплазма);
- отсутствие трахеидоподобных элементов.
Клеточную суспензию получают, помещая каллусную ткань в колбу с жидкой питательной средой. Суспензия перемешивается в колбе на качалке, имеющей скорость перемешивания 100 — 120 об/мин. При первом переносе на свежую среду удаляют крупные кусочки исходного каллуса и крупные агрегаты, фильтруя через 1 — 2 слоя марли, нейлоновые сита, шприц с соответствующим отверстием. Для инициализации суспензионной культуры необходимо 2 — 3 г свежей массы каллусной культуры на 60 — 100 мл жидкой питательной среды. Однако для каждой линии культуры клеток существует минимальный объем инокулята, при меньшем размере которого культура не растет.
Рост суспензионных культур клеток можно оценивать по одному или нескольким следующим параметрам:
1. Объем осажденных клеток (ООК). Переносят небольшой объем суспензионной культуры в мерную пробирку объемом 15 мл, лучше всего коническую. Центрифугируют 5 минут при 200 g. ООК — величина, которую составляет объем осадка от объема суспензии, обычно в %.
2. Число клеток. Подсчитывается в камере Фукса-Розенталя.
3. Сырая и сухая масса. Суспензия клеток фильтруется через смоченный и взвешенный фильтр, вложенный в воронку Бюхнера под слабым вакуумом. Клетки промывают дистиллированной водой, оттягивают воду под вакуумом и взвешивают снова вместе с фильтром. Сухая масса – определяется аналогично, но взвешивается сухой фильтр, а клетки сушат вместе с фильтром в термостате при 60 о С до постоянной массы.
4. Содержание белка. Для определения белка клетки собирают на фильтре из стекловолокна, дважды промывают кипящим раствором 70% этанола, сушат ацетоном, гидролизуют 1М NaOH при температуре 85 о С полтора часа. Затем фильтруют и определяют белок по Лоури.
5. Проводимость среды. Определяют с помощью кондуктометра. Как правило, она обратно пропорциональна свежей массе клеток.
6. Жизнеспособность клеток. Оценивают, изучая движение цитоплазмы под микроскопом, а также с помощью прижизненных красителей (флюоресцеиндиацетат, соли тетразолия, синий Эванса). Перед использованием подбирают рН инкубационного буфера, концентрацию красителя, время инкубации, строят калибровочные кривые для смеси живых и убитых клеток.
По полученным данным строят ростовые кривые, которые имеют S-образную форму и состоят из нескольких участков: 1- латентная, или лаг-фаза, где видимый рост не наблюдается ни по одному из критериев; 2 — экспоненциальная, рост с ускорением; 3 — линейная, где скорость роста постоянна; 4 — фаза замедленного роста; 5 — стационарная фаза; 6 — фаза деградации клеток (рис. 11).
Реальная ростовая кривая может несколько отличаться от модельной. На форму ростовых кривых влияют и генетическая характеристика популяции (вид растения), и количество инокулята, и условия выращивания (состав среды, начальное значение рН, состав газовой фазы, скорость перемешивания).
Необходимо отметить, что ростовые кривые для разных критериев не идентичны. Дисбаланс между скоростями клеточного размножения (число клеток), синтеза структурных элементов клетки (сухая масса) и увеличения объема и содержания вакуолей (сырая масса) отражает специфику онтогенеза высшего растения.
Для глубинного культивирования растительных клеток применимы способы, разработанные в микробиологии. Различают два вида систем культивирования: открытую и закрытую.
Для закрытой системы характерен периодический режим выращивания. Клеточная масса (инокулят) помещается в определенный объем среды. Система закрыта по всем параметрам, кроме газов, до конца выращивания. Периодически подается свежая питательная среда, а старая удаляется в том же объеме. Клетки остаются в системе в течение всего цикла выращивания.
Открытые (проточные) культуры характеризуются поступлением свежей питательной среды, при котором отбирается не только старая питательная среда, но и часть урожая клеточной массы.
Наиболее изучено и распространено закрытое глубинное культивирование. Для аэрации и перешивания используют различную аппаратуру: роллеры, качалки, магнитные мешалки и т.д. Очень большое значение для роста и биосинтеза клеток in vitro имеют технические характеристики систем культивирования. При масштабировании от небольших по объему культур в колбах до больших многолитровых ферментеров меняются многие параметры культивирования, в частности аэрация и перемешиваемость.
Для культивирования суспензий в производственных масштабах применяется аппаратура, разработанная для микробиологической промышленности, однако исследования последних лет показали, что растительные клетки в силу своих специфических особенностей требуют особых сосудов для культивирования. Клетки растений в десятки, сотни раз крупнее клеток бактерий и грибов, кроме того, их размеры меняются в процессе онтогенеза. Если в начале экспоненциальной фазы роста они мелкие и плотные, то в стационарной фазе роста они сильно увеличиваются в размерах и вакуолизируются. Чем крупнее становится клетка, тем больше возрастает опасность ее механического повреждения в процессе перемешивания. В то же время клетки растений, крупные и тяжелые, требуют эффективного перемешивания. Оседание их приводит к появлению «мертвых» зон в сосудах, в которых происходит быстрое накопление и старение клеток. Для культуры клеток женьшеня отрицательное влияние механического стресса при выращивании в ферментере с турбинными мешалками сказывалось на жизнеспособности клеток уже при скоростях мешалок свыше 100—350 об/мин, это отрицательно влияло на синтез ими антрахинонов. Устойчивость штамма к механическому стрессу является важным требованием к культуре и трудной задачей для исследователей.
Мягкое перемешивание и аэрацию обеспечивает пневматический способ перемешивания потоком сжатого стерильного воздуха, подаваемого в ферментер с восходящим током воздуха. К сожалению, и этот способ имеет свой недостаток, потому что в культуральной среде возникает избыток воздуха, приводящий к кислородному голоданию. От концентрации кислорода в среде зависят рост и вторичный метаболизм клеток. В микробиологических системах изучена взаимозависимость роста биомассы, выхода искомого продукта и снабжения кислородом. Для растений таких данных нет.
На рост клеток, кроме кислорода, могут влиять и другие газы. Например, углекислый газ может существенно влиять на длину лаг-фазы. Высокая степень аэрации может оказывать негативное действие на рост и синтез продуктов вторичного метаболизма, поскольку удаляются углекислый газ и летучие соединения. Клетки растений in vitro по сравнению с микроорганизмами имеют низкую интенсивность дыхания, что тоже должно учитываться при конструировании сосуда для культивирования. Сравнивали рост и образование метаболитов клетками в ферментерах разных типов. Клетки моринды лимонолистной, культивируемые в ферментерах с продувкой воздуха, содержали антрахинона на 30% больше, чем в перемешиваемых колбах, и в два раза больше, чем в ферментерах других систем. Выход биомассы клеток не менялся в зависимости от типа биореактора. Клетки барвинка розового (Catharantus roseus) также синтезировали больше индольных алкалоидов при культивировании в ферментере с продувкой воздуха, чем в биореакторах с механическим перемешиванием.
Отличительная особенность суспензионных культур клеток растений — высокая плотность, необходимая для роста. Поэтому другим осложнением при культивировании клеток растений является увеличение вязкости, со провождающее рост биомассы. Это ведет к адгезии. Адгезия (прилипание) клеток друг к другу, на поверхностях культурального сосуда и погруженных в него мешалок и датчиков вызывает затруднения. В верхней части сосуда постепенно может образовываться пена, состоящая из выделяемых клетками белков и полисахаридов. В процессе культивирования клетки слипаются и часть из них скапливается в этой пене, образуя «корку», или «безе». С увеличением биомассы клеток увеличивается и эта «корка», снижая интенсивность перемешивания, что в конце концов может привести культуру к гибели.
Клетки растений обладают меньшей физиологической и метаболической активностью по сравнению с микроорганизмами. Время генерации (интервал времени между двумя последовательными клеточными делениями) растительной клетки в 60—100 раз превосходит время генерации микробной клетки. Пул пролиферирующих клеток не превышает 50—60%, многие клетки быстро прекращают деление и переходят в фазу покоя.
Все эти обстоятельства определяют продолжительный рост популяции клеток при накопительном, или периодическом, выращивании. Поддержание стерильности длительное время также является одной из технических проблем, особенно при непрерывном культивировании.
Периодическое, или накопительное, культивирование — это самый простой способ выращивания клеток, являющийся пока традиционным. Суспензионные культуры используют для промышленного получения вторичных метаболитов. Вещества, продуцируемые растительными клетками используются в медицине, парфюмерной промышленности, растениеводстве и других отраслях промышленности. К ним относятся: алкалоиды, терпеноиды, гликозиды, полифенолы, полисахариды, эфирные масла, пигменты, антиканцерогены (птотецин, харрингтонин), пептиды (ингибиторы фитовирусов). В настоящее время в разных странах около ста видов растений используется в биосинтетической промышленности для получения экономически важных веществ, среди них — женьшень, раувольфия змеиная, наперстянка шерстистая и пурпурная, диоскорея дельтовидная, воробейник, беладонна, паслен дольчатый, дурман обыкновенный, ландыш майский, клещевина, агава, мак снотворный и др.
Получение вторичных метаболитов имеет свои особенности. Деление клеток, приводящее к увеличению клеточной биомассы, и синтез вторичных метаболитов разобщены во времени. Накопление вторичных метаболитов возрастает в фазе замедленного роста клеточной популяции и достигает максимума в стационарной фазе. Некоторые алкалоиды активно синтезируются в фазе максимальной митотической активности (экспоненциальный рост), что является исключением. Знание таких закономерностей позволяет регулировать процессы получения ценных веществ. Механизмы и условия, блокирующие активный рост клеток и клеточную пролиферацию, одновременно активируют ферменты вторичного метаболизма. Неспецифические стрессовые условия, воздействующие на клетки в конце экспоненциальной фазы, могут стимулировать переход к синтезу вторичных метаболитов и увеличивать их выход. Необходимо учитывать, что вопрос взаимодействия первичного и вторичного метаболизма, рассмотренный нами в упрощенном виде, намного сложнее.
Источник
Способы выращивания суспензионной культуры
1. Культивирование клеток в жидкой среде осуществляется несколькими способами. Наиболее простым и распространенным является накопительное или периодическое культивирование. Клетки растут в постоянном объеме питательной среды на установках качального или роллерного типа. Такая система закрыта для всего, кроме газов и летучих продуктов метаболизма. Оказывается при этом в колбах накапливается значительное количество углекислого газа. После замедления роста суспензия разводится до начальной плотности, и цикл выращивания повторяется. Цикл выращивания — это период от помещения инокулюма в свежую среду до следующего субкультивирования. Для накопительных культур чаще всего используются конические широкогорлые колбы разных размеров на платформенных качалках кругового или полукругового типа со скоростью вращения 60-120 оборотов в минуту. Клетки растений, несмотря на ряд специфических особенностей, подчиняются тем же законам роста, что и микроорганизмы, поэтому для их выращивания применяют технологию и аппаратуру, принятую в работе с микроорганизмами. Микроорганизмы обычно культивируют в особых аппаратах, называемых ферментерами. Накопительные культуры можно выращивать в лабораторных ферментерах рабочим объемом 0,5-10 л. По сравнению с глубинным выращиванием в колбах на качалке при культивировании клеток в ферментерах появляются принципиально новые возможности, связанные с их конструкцией.
На культуру клеток в ферментерах можно в любой момент воздействовать различными факторами (температура, свет, газовый режим, физиологически активные вещества, рН и др. ) и отбирать пробы клеток для определения динамики роста и метаболизма популяции в цикле выращивания. То есть, не нарушая режима асептики, можно контролировать рост и продуктивность биомассы, изучать влияние на эти процессы различных воздействий. Вместе с тем культивирование растительных клеток в ферментерах сопряжено с трудностями, вытекающими из специфических особенностей клеток высших растений. Наличие вакуоли и целлюлозно-пектиновой оболочки, придающей клеткам не только прочность, но и хрупкость, обуславливает их подверженность механическому стрессу при перемешивании и аэрации. Опасность механического стресса усиливается на стадии растяжения клеток.
Ферментеры различных конструкций обеспечивают перемешивание и аэрацию по-разному: вращаясь вокруг собственной оси, будучи в наклонном состоянии, перемешиванием магнитными и механическими мешалками, продуванием сжатого стерильного воздуха через суспензию. Конструкция лопастей мешалок бывает разной, и вращаются они с разной скоростью.
Высокая скорость перемешивания ведет к разрушению клеток, снижение интенсивности перемешивания может привести к оседанию части клеток к их гибели. Рост биомассы, которого так стараются добиться в работе ученые, ведет к возрастанию вязкости, что так осложняет культивирование. В отличие от микроорганизмов растительные клетки слипаются между собой и с поверхностями культиватора. Кроме того, они могут скапливаться в верхней части сосуда, образуя пену. Перечисленные особенности растительных клеток заставляют исследователей очень тщательно подходить к выбору типа культиваторов и режиму перемешивания в зависимости от целей и задач экспериментов с суспензионной культурой.
2. Способ, при котором клетки выращиваются в проточном режиме, называется непрерывным культивированием. В основу создания проточных систем легли опыты, в которых было обнаружено, что добавление в суспензию в фазу экспоненциального роста культуры порций свежей питательной среды позволяет долго поддерживать деление клеток. Непрерывное культивирование может осуществляться в закрытой проточной, полупроточной и открытой проточной системах.
В закрытой проточной системе суспензионная культура непрерывно снабжается свежей средой, приток которой сбалансирован оттоком равного количества использованной среды. В такой системе хорошо изучать влияние различных факторов на метаболизм клеток.
При полупроточном режиме выращивания определенная часть суспензии время от времени отбирается и оставшаяся часть разбавляется свежей средой.
Применяется для получения большой биомассы с целью ее биохимического исследования.
Открытая проточная система устроена так, что обеспечивает баланс между притоком свежей питательной среды и удалением равного объема клеточной суспензии. Скорость удаления части клеток из системы должна соответствовать скорости образования новых клеток в результате деления, это создает равновесное состояние между ростом клеток (постоянством скорости клеточного деления) и биосинтезом (постоянством состава и метаболической активности).
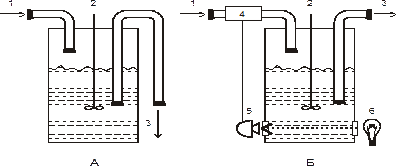
3. В открытой проточной системе исследуются взаимосвязи между процессами роста и метаболизма, те изменения, которые происходят при переходе клеток от одного состояния к другому, а также условия оптимального режима культивирования для получения максимального количества вторичных метаболитов. В основу непрерывного культивирования могут быть положены принципы хемостата и турбидостата, разработанные при культивировании микроорганизмов (рис. 2).
Рисунок 2. Схемы биореакторов для проточного культивирования
А – хемостат; Б – турбидостат с автоматической регуляцией оптической
плотности.
1 – поступление среды, 2 – мешалка, 3 – сток культуры, 4 – насос,
5 – фотоэлемент, 6 – источник света
В хемостатном режиме непрерывное культивирование идет под воздействием лимитирующего рост фактора. Хемостатная культура представляет собой перемешиваемую суспензию, в которую с постоянной скоростью поддается свежая среда с заданной концентрацией какого-то лимитирующего рост компонента и с такой же скоростью отбирается часть культуры. Общий объем суспензии остается постоянным. При выращивании клеточных суспензий в хемостатном режиме скорость размножения клеток регулируется концентрацией лимитирующего фактора. Скорость роста и плотность клеточной популяции проходят в соответствии с заданной скоростью поступления среды (скорость разбавления), т.е. подачей лимитирующего фактора и других компонентов среды. Это приводит популяцию в стационарное состояние, для которого характерны выравненность физиологического состояния, постоянства концентрации лимитирующего фактора и других компонентов среды.
Принцип турбидостата предусматривает непрерывное культивирование без внешнего лимитирования, рост клеток популяции поддерживается на определенном уровне регулированием оптической плотности культуры. Для этого подходят суспензии с низкой плотностью клеток и высокой удельной скоростью роста, т.е. популяции в начальные фазы роста. Турбидостат представляет собой хемостат, дополненный фотоэлектрическим элементом, чувствительным к мутности культуры. Рост клеточной популяции поддерживается на заданном уровне автоматически с помощью фотометрической регуляции подачи среды.
Хемостатный и турбидостатный режимы применяют с целью стабилизации клеточной популяции в определенном состоянии роста и поддержания его неограниченное время. Эти приемы культивирования очень ценны для изучения регуляции роста и метаболизма клеток в строго стандартных условиях под влиянием различных лимитирующих и ингибирующих факторов. Однако, таких работ очень мало, что связано с новизной метода и техническими трудностями. Препятствием к культивированию клеток высших растений в проточном режиме является их высокая чувствительность к повреждениям, агрегированность, длительное время генерации.
Дата добавления: 2015-07-14 ; просмотров: 3421 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник