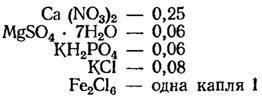Среда для выращивания водорослей
7.2. Методы лабораторного культивирования водорослей (М. И. Радченко, Н. М. Масюк)
Метод культур все шире используют в практике таксономических [195, 639], флористических [85], гидробиологических [294] работ. Наличие чистых культур — необходимая предпосылка успешного физиолого-биохимического, цитологического и генетического изучения микроскопических водорослей.
Собранный в природе живой материал служит источником получения смешанных и чистых лабораторных культур водорослей. Исходный материал, помещенный в колбе на северное окно лаборатории, может сохраняться длительное время при периодическом добавлении (в меру подсыхания) воды из исходного местообитания, стерильной водопроводной воды или подходящей питательной среды, имеющих активную реакцию (pH), как в исходной среде. Такие смешанные культуры могут быть источником живого материала в качестве контроля при изучении фиксированных формалином проб. Однако, поскольку в таких культурах присутствует смесь разных видов, которые могут вытеснять друг друга, для систематических целей желательно иметь чистые культуры исследуемых объектов.
Для выделения монадных форм и стадий обычно используют их положительный фототаксис, благодаря которому подвижные организмы скапливаются на освещенной стороне сосуда (капли), где их можно собрать с помощью пипетки. Нейстонные водоросли и синезеленые, обладающие газовыми вакуолями, отделяют от других водорослей центрифугированием, в процессе которого они скапливаются в верхних слоях жидкости. Чистую культуру некоторых видов водорослей можно получить из их покоящихся клеток (зигот, акинет, спор, цист), подвергая исходный материал воздействию экстремальных факторов (высушивая, замораживая, нагревая в термостате), разрушающих сопутствующие организмы, которые не образуют покоящихся стадий.
Для выделения отдельных организмов широко используют пипеточный метод — отлавливание единичных клеток, колонии или нитей с помощью стерильной пипетки Пастера с тонко оттянутым длинным концом под бинокулярной лупой или при малых увеличениях микроскопа. Водоросли, отловленные благодаря всасывающей силе капилляра, последовательно переносят из одной капли стерильного питательного раствора в другую, пока в капле не останется искомая водоросль без посторонних примесей, после чего ее переносят в пробирку со стерильной питательной средой и выставляют на рассеянный свет, искусственный или естественный (этот метод в отдельных случаях позволяет избавиться не только от посторонних видов водорослей, но и от сопутствующих бактерий).
Более удобным является метод агаровых пластинок. Для этой цели используют агаризованные питательные среды, содержащие 0,5-2% агар-агара. Среды, содержащие меньше 0,5% агар-агара, наиболее пригодны для изоляции нежных жгутиковых организмов, не обладающих плотными клеточными покровами. На поверхность агаровой пластинки в чашке Петри диаметром 9 см равномерно наносят 0,1 мл суспензии водорослей со средней плотностью 1 клетка в 1 мм 3 . На одни сутки чашки Петри помещают на рассеянный дневной свет (окно с северной стороны), а затем переносят на осветительную установку с люминесцентными лампами (освещенность около 2 тыс. лк). Отдельные колонии, выросшие на поверхности агаровой пластинки, снимают (желательно с кусочками агаровой среды) стерильными инструментами (пипеткой, препаровальной иглой, ланцетом и др.) и вносят в пробирки с жидкой питательной средой. Двукратное повторение этой процедуры позволяет не только избавиться от посторонних видов водорослей, но и получить клоповые культуры [131].
Хотя для целей систематики нет надобности в получении бактериально чистых (аксенических) культур (поскольку альгологически чистые культуры более близки к естественным условиям обитания водорослей), однако при проведении ряда физиолого-биохимических исследований возникает необходимость очистки водорослей от сопутствующих бактерий. Аксенические культуры водорослей получают с помощью антибиотиков, ультрафиолетового облучения или путем многократной проводки через стерильные агаризованные питательные среды с примесью органических веществ, способствующих проявлению бактериального загрязнения [294, 639]. Следует иметь в виду, что применение антибиотиков и ультрафиолетового облучения, оказывающих мутагенное действие, может вызвать необратимые генетические изменения изучаемой культуры.
Среды, рекомендуемые для искусственного культивирования водорослей, чрезвычайно разнообразны. Выбор среды зависит от специфики культивируемого объекта и целей выращивания. Бывают жидкие среды (питательные растворы) и твердые (агаризованные). Первые используют для получения биомассы водорослей, необходимой для морфологических, цитологических, физиолого-биохимических и других исследований; вторые — для хранения коллекционных (музейных) культур * .
* ( Способы хранения коллекционных культур описаны в разделе 7.3)
Большинство водорослей хорошо развивается на минеральных средах, некоторые нуждаются в добавках органических веществ, которые служат источником элементов питания, витаминов и других физиологически активных веществ. Питательные среды содержат основные биогенные элементы (N, P, S, Mg, K, Ca) и микроэлементы (Fe, Mn, Cu, Mo, Br, Zn и др.). Источником углерода служит растворенный в воде углекислый газ, запасы которого постоянно пополняются из воздуха, а также за счет его выделения водорослями в процессе дыхания или внесения в среду карбонатов и бикарбонатов. Чтобы железо и другие микроэлементы не выпадали в осадок, в среды добавляют хелатирующие соединения — органические вещества, образующие с ионами металлов устойчивые комплексные соединения в форме, доступной для питания растений, например, этилендиаминтетрауксусную кислоту (ЭДТА) или ее соли.
В качестве источника органических веществ иногда добавляют почвенную вытяжку. Существует много разных методов приготовления почвенной вытяжки. Например, Ф. Гиндак [639] рекомендует 1 часть почвы и 1 часть воды кипятить в течение 1 ч, настоять сутки, снова кипятить 1 ч, охладить, отфильтровать и фильтрат простерилизовать в автоклаве. Согласно рекомендации Э. А. III тиной [85], 1 весовую часть воздушно-сухой просеянной почвы в течение 5 мин взбалтывают с 4 частями воды, фильтруют и стерилизуют в автоклаве. Кроме почвенной вытяжки в качестве источников органических веществ добавляют пептон, глюкозу, сахарозу, аминокислоты, витамины и другие соединения.
Для приготовления питательных растворов используют дистиллированную воду, полученную из стеклянного перегонного аппарата, или простер и лизованную водопроводную воду, а также химические реактивы с достаточно высокой степенью очистки (чда).
Чтобы избежать образования осадка в питательной среде, ее компоненты лучше готовить отдельно в небольших объемах воды. Полученные растворы после стерилизации и охлаждения постепенно смешивают в необходимом объеме воды, добавляя их в той последовательности, в которой они записаны во взятом рецепте, соблюдая при этом условия стерильности. В первую очередь это касается растворов микроэлементов, фосфатов, бикарбонатов, квасцов.
Посуду и инструменты, предварительно тщательно вымытые, высушенные и завернутые в бумагу, стерилизуют и сушат в сушильном шкафу при 165-180°С в течение 2 ч. Стерилизацию раствора проводят в автоклаве сухим паром в течение 45-60 мин при давлении 9,8 ⋅ 10 2 ГПа. Среды, содержащие легко разрушающиеся органические вещества (сахара, витамины), стерилизуют при 4,9 ⋅ 10 2 ГПа 15-30 мин. Иногда применяют дробную стерилизацию текучим паром в 3-4 приема (через 2-3 суток) в аппарате Коха или в автоклаве.
Разнообразные прописи питательных сред, рекомендуемых для тех или иных групп водорослей, можно найти в многочисленных статьях и сводках [52, 175, 195, 294, 453, 639, 703]. Ниже приведены лишь некоторые из них.
Среда Киопа (г/л, применяется в разведениях 1/2, 1/4, 1/10, для зеленых водорослей):
Среда Прата (г/л, для хранения коллекции культур):
Среда Тамия (г/л, применяется в различных разведениях для зеленых водорослей):
Источник
Рецепты сред для выращивания водорослей
Для водных культур используют питательные среды, содержащие все необходимые для водорослей элементы. Разработано множество рецептов питательных сред применительно к разным группам водорослей. Приводим наиболее употребительные из них.
Среда Данилова: Ca(NO3)2 — 0,2 г, К2НРО4 — 0,2 г, почвенная вытяжка 250 мл, дистиллированная вода 750 мл. Почвенная вытяжка готовится из садовой почвы (можно заменить испытуемой почвой) путем взбалтывания почвы и последующей фильтрации через весь объем почвы в соотношении I весовой части почвы на 4 части воды.
Среда Бристоль в модификации М. М. Голлербаха (г/л): NaNO3 — 0,25; КН2PO4 — 0,25; MgSO4 — 0,15; CaCl2 — 0,05; NaCl — 0,05; FeCl3 — следы. Далее среды даны в г/л.
Среда Кнопа: Ca(NO3)2 — 0,25; MgSO4 — 0,06; KH2PO4 — 0,06; KCl — 0,03; FeCl3 — капля 1%-ного раствора. Иногда употребляется в разведениях.
Среда Громова № 6 (рекомендуется для синезеленых): KNO3 — 1,0; К2НРO4 — 0,2; MgSO4·7H2O — 0,2; CaCl2 — 0,15; NaHCO3 — 0,2 микроэлементы — 1 мл исходного раствора, рН — 7,0. Раствор микроэлементов (г/л): ZnSO4·7H2O — 0,022; MnSO4 — 1,81; CuSO4·5H2O — 0,079; NaBO3·4H2O — 2,63; (NH4)6Mo7O24·4H2O — 1,0; FeSO4·7H2O — 9,3; CaCl2 — 1,2; Co(NO3)2·H2O — 0,02; трилон Б (ЭДТА) — 10,0.
Для выделения азотфиксирующих синезеленых водорослей эта среда приготовляется без азота.
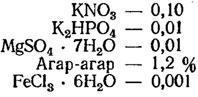
Среда Громова № 1: K2HPO4 — 0,0666; MgSO4·7H20 — 0,0333; KNO3 — 0,1; раствор микроэлементов — 1 мл/л; рН — 6,8.
Среда Гусева № 1 (для азотфиксирующих синезеленых): MgSO4·7H2O — 0,2; KH2PO4 — 0,2; CaCl2 — 0,1; FeCl3 — 0,008; вода водопроводная — 1000 мл.
Среда Гусева № 2 (для всех синезеленых): Ca(NO3)2 — 0,2; KH2PO4 — 0,1; MgCl2 — 0,2; FeCl3 — 0,008; вода водопроводная — 1000 мл.
Среда Болда (ВВМ) — для микроскопических зеленых. Готовятся исходные растворы, каждый на 400 мл деионизированной воды: NaNO3 — 10,0 г; KH2PO4 — 7,0 г; K2HPO4 — 3,0 г; MgSO4·7H2O — 3,0 г; CaCl2·2H2O — 1,0 г; NaCl — 1,0 г.
10 мл каждого раствора добавляют к 936 мл деионизированной воды, а затем добавляют по 1 мл каждого раствора микроэлементов, что дает конечный объем 1 л.
Растворы микроэлементов следующие (на 1 л деионизированной воды).
- ЕДТА — исходный раствор: ЕДТА — 50 г; КОН — 31 г.
- H — Fe исходный раствор: FeSO4·7H2O — 4,98 г растворяется в 1 л подкисленной воды (1 мл H2SO4 добавляется к 999 мл воды).
- H — В исходный раствор: H3BO3 — 11,42 г на 1 л.
- H — H3 исходный раствор: ZnSO4·7H2O — 8,82 г; MnCl·4H2O — 1,44 г; MoO3 — 0,71 г; CuSO4·5H2O — 1,57 г; Co(NO3)2·6H2O — 0,49 Г -готовится на подкисленной воде (см. выше).
Среда ВВМ широко используется в разных модификациях:, в частности количество NaNO3 иногда увеличивают до 25 г (400 мл воды).
Для приготовления агаровых сред сухой агар размачивают в водопроводной воде, промывают в дистиллированной воде, распускают, на водяной бане, фильтруют и добавляют в раствор нужные соли. В разных случаях на 1 л будущего раствора берут от 5 до 20 г (0,5-2%).
Интенсивные культуры водорослей требуют более концентрированных сред. Наоборот, для выделения водорослей из почвы в накопительных культурах нередко можно обойтись чистой почвенной вытяжкой, без добавления минеральных солей.
Источник
Научная электронная библиотека
Сибагатуллина А. М., Мазуркин П. М.,
2.4. Технология выращивания культуры водоросли
На практике наиболее распространенными методами биотестирования являются такие, в которых фиксируются, главным образом, такие интегральные параметры, как показатели выживаемости, роста, плодовитости тест-организмов.
Все методы биотестирования характеризуются своими особенностями. Это и доступность тест-объекта, которая определяется возможностью их культивирования в лабораторных условиях, поддержанием необходимых условий температуры, освещенности, сложностью состава питательных сред, чистотой воздуха и пр. Это и оперативность получения ответа.
Наиболее быстрые реакции на токсическое воздействие равных концентраций удается регистрировать у простых организмов – бактерий, водорослей и инфузорий. Наступление таких реакций ограничивается минутами или несколькими часами. Сутками измеряется проявление ответных реакций более крупных объектов (у ракообразных – дафний), а так называемая хроническая токсичность оценивается в течение многих суток и даже недель. Каждый метод характеризуется и своими техническими способами реализации. Общим правилом для всех методик является оценка надежности тест-культур.
В качестве тест – организма в наших экспериментах была использована одноклеточная зеленая водоросль Chlorella vulgaris. Данная водоросль легко культивируется (выращивается) на искусственных питательных средах и быстро размножается. Кроме этого, она широко распространена в природе и хорошо изучена учеными. В качестве питательной среды взята минеральная среда Тамия следующего состава (г/л): КNО3 – 5.0; MgSO4+7H2O – 2,5; KHPO4 – 1,25. Питательная среда и растворы солей готовятся на дистиллированной воде и не подвергаются стерилизации. Для избегания образования осадка, навеску каждого вещества сначала растворяют в небольшом количестве воды, а затем растворы сливают вместе в указанной выше последовательности и доливают воду до соответствующего объема. Перед внесением водорослей питательная среда (100%) разбавляется в 2 раза дистиллированной водой (50%).

Рис.2.2. Культиватор КВ-05
Наращивание исходной культуры водоросли производится в специальном культиваторе КВ-05, рис.2.2. В качестве реактора используется прозрачная бутыль из бесцветного стекла емкостью 400 мл. В реактор заливается суспензия водоросли в объеме 150мл. Для обеспечения углекислым газом, за счет растворения содержащегося в воздухе CO2 и перемешивания суспензии непрерывно вращается вокруг своей продольной оси. В процессе культивирования суспензия водоросли облучается светом лампы накаливания 40 Вт, 220В, установленный над реактором. Постоянная температура поддерживается автоматическим включением и выключением встроенного вентилятора по команде блока термостабилизации прибора.
Засев водоросли производится с начальной оптической плотностью 0,020±0,005. Для этого в 150 мл 50% питательной среды (среда Тамия, разбавленная дистиллированной водой в 2 раза) вносится 15 мл суспензии водоросли, профильтрованной через 3-4 слоя марли с оптической плотностью 0,220. Культура выращивается в полустационарном режиме, который достигается ежедневным пересевом в свежую среду. Такой режим культивирования позволяет без соблюдения условий стерильности поддерживать чистую культуру водоросли. При перерывах в работе свежевыращенную культуры водоросли можно хранить в холодильнике при температуре 2-4 °С в течение 2-4 месяцев. При возобновлении работ по биотестированию хранящуюся культуру водоросли следует активировать, прокультивировав одни сутки в культиваторе «КВ-05», как указано выше.
В качестве показателя светопропускания в приборе ИПТ-02, рис.2.3 используется величина оптической плотности, регистрируемая в круглой кювете («пенициллиновом» флаконе) на красном свету (длина волны 660 нм), который близок по спектру длинноволновому максимуму поглощения хлорофилла. Для уменьшения влияния оптической неоднородности стенок флакона на результаты измерения измерительный свет просвечивает кювету в трех направлениях.

Рис.2.3. Измеритель плотности ИПТ-02
Согласно основному закону светопоглощения, между величиной оптической плотности (D) и концентрацией растворенного вещества в измеряемом растворе существует прямопропорциональная зависимость. Аналогичная связь имеет место между D и количеством клеток в суспензии водоросли. Таким образом, через величину оптической плотности можно оперативно и достаточно точно определить насколько изменилась численность клеток в процессе роста культуры водоросли. Если не требуется высокая точность измерений, допустимо проводить измерение оптической плотности непосредственно во флаконах, в которых выращивались тест-культура. В этом случае после настройки прибора «ИПТ-02» по эталонной кювете с дистиллированной водой все флаконы культиватора «Фитотестер 03» последовательно помещаются в кюветный узел прибора.
Измерение температуры, которое также позволяет делать прибор «ИПТ-02» после его переключения в соответствующий режим работы (Т°), производится выносным датчиком. Чтобы обеспечить более точный и быстрый замер Т° необходимо делать несколько помешивающих движений термодатчиком в измеряемой среде. Для стабилизации температурного режима прибор должен быть включен за 15 минут до начала работы.
С целью изучения зависимости наиболее обобщенного показателя жизнедеятельности культуры водоросли – скорости ее роста – от факторов внешней среды, в том числе и тех, которые оказывают на нее токсическое воздействие, используется многореакторный культиватор «Фитотестер-03», рис.2.4. Данный культиватор представляет собой плоский прямоугольный блок разъемной конструкции, внутри которого расположена круглая кассета для установки в нее флаконов с суспензионными пробами тест-организма. Кассета приводится во вращение электродвигателем, что обеспечивает равномерное перемешивание содержимого всех реакторов и снабжение культуры водоросли углекислым газом, содержащимся в окружающем воздухе. Одинаковое облучение всех проб водоросли осуществляется лампой накаливания мощностью 40 Вт, расположенной внутри корпуса культиватора, рядом с кассетой. Лампа является не только источником световой энергии для фотосинтеза водорослей, но и нагревательным элементом, обеспечивающим нагрев проб тест-культуры.

Рис.2.4. Многокюветный культиватор водорослей (Фитотестор-03)
Для предотвращения перегрева реакторов в центре вращающей кассеты установлен вентилятор, который включается каждый раз, когда температура в корпусе прибора превышает установленный уровень. Последний задается термостатирующим устройством, также размещенным в культиваторе. После включения вентилятора происходит быстрое охлаждение внутреннего пространства культиватора более холодным внешним воздухом. При снижении температуры ниже требуемого вентилятор автоматически выключается. Таким образом, с помощью команд, подаваемых вентилятору, осуществляется процесс поддержания необходимой температуры в течение всего периода культивирования проб тест-организма [11].
Источник