Учет численности микроорганизмов в почве
Почва – наиболее благоприятная среда для развития микроорганизмов. В связи с большой гетерогенностью ее состава для учета численности в ней микроорганизмов с исследуемого участка берут среднюю пробу.
Среднюю почвенную пробу получают смешиванием отдельных образцов, количество которых зависит от микрорельефа, степени гетерогенности почвы и ее однородности в ботаническом отношении. Рекомендуют с площади 100 м 2 брать пробу из трех точек, с площади, превышающей 100 м 2 , — из пяти по методу «конверта», с 1 га и более – из 15 точек. При исследовании пашни пробы берут с глубины всего пахотного слоя, снимая верхний слой толщиной 2 см; при изучении микрофлоры почвенного профиля – по генетическим горизонтам (снизу вверх).
Почвенный образец берут буром, лопатой и ножом. В поле перед взятием образца их тщательно очищают, затем обрабатывают спиртом и обжигают. Укладывают образец в заранее приготовленную стеклянную широкогорлую стерильную банку, закрывающуюся корковой пробкой, обернутой стерильной бумагой, либо в стерильные пергаментные пакеты. На пакеты и банки наклеиваются этикетки с указанием места взятия пробы, горизонта и других сведений.
Почвенные образцы анализируют в первые сутки. При необходимости допускается хранение их в холодном помещении (в холодильнике) в течение 2 дней.
Приготовление почвенной суспензии и посев
На стерильное часовое стекло стерильным шпателем помещают 5 г почвы. Чтобы при взвешивании в почву не попали микроорганизмы из воздуха, особенно споры грибов, часовое стекло накрывают другим часовым стеклом. Предварительно стекла взвешивают. Часовые стекла и шпатели стерилизуют фламбированием. Навеску почвы переносят в стерильную фарфоровую ступку, увлажняют 0,5 мл воды и растирают пальцем в стерильной резиновой перчатке в течение 5 мин. Перед приготовлением почвенной суспензии для каждого образца готовят 2 стерильные колбы на 250 мл. Одна содержит 50 мл стерильной водопроводной воды, другая — пустая. Водой из первой колбы растертую почвенную массу смывают в пустую стерильную колбу. Колбу с полученной почвенной суспензией взбалтывают 10 мин и дают отстояться крупным частицам почвы.
Далее готовят разведения, содержащие разные концентрации почвы в 1 мл воды. Для этого из колбы стерильной пипеткой берут 1 мл суспензии, содержащей 10 -1 г почвы, и переносят в пробирку с 9 мл стерильной водопроводной воды. Пипетку неоднократно промывают в пробирке, чтобы максимально смыть клетки с ее стенок. Концентрация почвы в пробирке будет 10 -2 г.
Другой стерильной пипеткой берут 1 мл суспензии из первой пробирки и переносят ее во вторую пробирку, тщательно повторяя процедуру промывания пипетки. Концентрация почвы во второй пробирке будет 10 -3 г. Точно также новыми стерильными пипетками производят дальнейшие разведения почвенной суспензии до достижения разведения 10 -5 и 10 -6 г.
Для определения численности микроорганизмов в каждом разведении методом питательных пластин проводят глубинный или поверхностный посев. Методы посева описаны выше. Для учета бактерий используют среду МПА, для учета микроскопических грибов – среду Чапека (см. приложение 1).
Учет численности микроорганизмов
Клетки микроорганизмов, попав в питательную среду, начинают размножаться и образуют видимые невооруженным глазом колонии. Каждая колония на чашке с питательной средой вырастает из одной колониеобразующей единицы (КОЕ), которая может представлять собой бактериальную, дрожжевую клетку, кусочек мицелия актиномицета или гриба.
Подсчет численности бактерий осуществляют через 24-48 часов инкубации чашек в термостате, грибов – через 7 суток, актиномицетов – через 10-14 суток.
Количество КОЕ в 1 г сырой почвы устанавливают, умножая число КОЕ в чашке на степень разведения – число, показывающее, во сколько раз в конкретном случае разбавили 1 г почвы.
Для правильного определения численности КОЕ подсчитывают только чашки, в которых колоний свыше 10 и не более 250-300.
Для сравнения количества КОЕ в разных почвах необходимо подсчитать их число в 1 г абсолютно сухой почвы. Для этого одновременно со взятием навески определяют влажность почвы. Метод определения влажности почвы приведен в приложении 2. Для определения количества КОЕ в абсолютно сухой почве необходимо число клеток в сырой почве разделить на количество абсолютно сухой почвы, содержащейся в 1 г сухой почвы.
Пример расчета. При посеве из пробирки с разведением почвенной суспензии 10 -6 г на чашке выросло 18 колоний. Содержание абсолютно сухого вещества почвы составило 70%, т.е. 0,7 г сухой почвы в 1 г сырой почвы.
Число клеток (КОЕ) в 1 г сырой почвы равно 18000000.
Число клеток (КОЕ) в 1 г сухой почвы равно
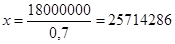
Метод питательных пластин легко выполним, но имеет ряд недостатков, самый существенный из которых – отсутствие универсальной среды для развития всех микроорганизмов, обитающих в почве. Питание у разных бактерий специфично, и на каждой среде выделяется только физиологическая группа. Так, на наиболее часто применяемой среде мясо-пептонном агаре МПА развиваются в основном гнилостные бактерии, способные усваивать легко доступные органические формы азота. Для более полного представления о населенности почвы делают посевы на элективные среды или используют метод прямого подсчета микроорганизмов под микроскопом.
Источник
Учет численности микроорганизмов (КОЕ) в почве методом питательных пластин в сочетании с методом последовательных разведений
Методы учета численности микроорганизмов
Учет численности и выделение чистой культуры микроорганизмов
Почва — наиболее благоприятная среда для развития микроорганизмов. В связи с большой гетерогенностью ее состава для учета численности в ней микроорганизмов с исследуемого участка бepyт среднюю почвенную пробу (см. 10.1.1),
Сначала готовят суспензии (методом разведения), содержащие разные концентрации почвы в 1 мл воды. Для этого на стерильное часовое стекло стерильным фарфоровым шпателем или алюминиевой чайной ложкой 6epyт из банки или мешка навеску почвы в 1 г. Часовое стекло, шпатель, ложку фламбируют в пламени горелки или, смочив в спирте, обжигают. При взвешивании почвы часовое стекло накрывают другим стерильным часовым стеклом.
Навеску почвы, соблюдая условия асептики, переносят в колбу на 250 мл с 49 мл стерильной воды. Смесь в взбалтывают 5 мин, не смачивая пробку. Стерильной пипеткой берут 1 мл суспензии, содержащей 10 -2 г почвы, и переносят в пробирку с 9 мл стерильной водопроводной воды. Пипетку неоднократно промывают водой в пробирке, чтобы максимально смыть клетки с ее стенок. Другой стерильной пипеткой берут из колбы еще 1 мл суспензии и помещают во вторую колбу, также содержащую 99 мл стерильной водопроводной воды. Эту пипетку промывают таким же образом, как и в первом случае. Пробирку и вторую колбу взбалтывают 1 мин. Концентрация почвы в пробирке будет 10-3 г , во второй колбе – 10 -4 г . Точно так же новыми стерильными пипетками переносят по 1 мл суспензии из второй колбы во вторую пробирку с 9 мл и в третью колбу с 99 мл стерильной водопроводной воды и готовят новые суспензии, содержащие в 1мл соответственно 10 -5 и 10 -6 г почвы.
Для определения численности микроорганизмов в каждом разведении методом питательных пластин можно провести глубинный или поверхностный посев. Последний более сложен и занимает больше времени. Поэтому для подсчета численности бактерий в почве методом питательных пластин можно ограничиться глубинным посевом, а поверхностный использовать при учете численности различных физиологических групп микроорганизмов на плотных средах (см. главу 10).
Для определения количества живых клеток, содержащихся в 1 мл суспензии каждого разведения, берут по 1 мл этих суспензий и переносят в стерильные чашки Петри, используя всякий раз новую стерильную пипетку (лучше пипетку Мора). На крышках чашек стеклографом отмечают исследуемый вариант и разведение. Затем в чашки Петри вливают расплавленный МПА, заранее приготовленный и разлитый в пробирки на 20 мл ( 2 /3 объема) из расчета одна пробирка на чашку. Температура агара должна быть примерно 45 °С. Ее определяют, прикладывая пробирку с расплавленным агаром к щеке: если щеке не горячо — среду можно пылить в чашку Петри. Осторожными круговыми движениями чашки, не смачивая крышку, aгар перемешивают с суспензией. Чашки с застывшим агаром переворачивают вверх дном, чтобы избежать попадания на его поверхность конденсационной влаги с крышки, и помещают в термостат при 28—30 °С.
Клетки микроорганизмов, попав в питательную среду, начинают размножаться и образуют видимые невооруженным глазом колонии. Каждая колония на чашке с питательной средой вырастает из одной колониеобразующей единицы (КОЕ), которая может представлять собой бактериальную, дрожжевую клетку, спору, кусочек мицелия актиномицета или гриба. Через 48 ч инкубации чашки вынимают из термостата и предварительно подсчитывают число колоний. В связи с тем, что существуют медленнорастущие формы бактерий, окончательный подсчет делают на 5-е сут.
Количество КОЕ в 1 г сырой почвы устанавливают, умножая число колоний в чашке на степень разведения — число, показывающее, во сколько раз в каждом конкретном случае разбавили 1 г почвы. Казалось бы, во всех вариантах посева должно получиться примерно одинаковое число КОЕ, однако на практике происходит не так.
Иногда клеток так много, что развившиеся колонии микроорганизмов сливаются, что часто наблюдается в чашках при разведении 10 -2 . При высоких разведениях вырастают единичные колонии (меньше 10 на чашке), которые могут образоваться от случайно попавших клеток из воздуха при внесении в чашку почвенной суспензии или питательной среды. Учет таких чашек сделает подсчет недостоверным. Для правильного определения численности КОЕ подсчитывают только чашки, в которых колоний свыше 10 и не более 250—300 (в последнем случае при условии, если колонии очень мелкие).
При подсчете колоний чашки просматривают в проходящем свете и, чтобы дважды не учитывать одни и те же колонии, подсчитанные отмечают чернилами или тушью. Чтобы не пропустить мелкоточечные колонии, чашки дополнительно просматривают под лупой. Можно использовать и специальный прибор для подсчета колоний.
Бывают случаи, когда в последнем разведении (10 -6 ) число колоний значительно больше 300. Такой посев желательно повторить, увеличив число разведений. Если это невозможно, подсчет выполняют, учитывая, что он дает представление лишь о минимальной численности микроорганизмов в почве.
Метод питательных пластин легко выполним, но имеет ряд недостатков, самый существенный из которых — отсутствие универсальной среды для развития всех микроорганизмов, обитающих в почве. Питание у разных бактерий специфично, и на каждой среде выявляется довольно узкая физиологическая группа. Так, на МПА развиваются в основном гнилостные бактерии, способные усваивать легко доступные органические формы азота. Нитрифицирующие, целлюлозоразрушающие, азотфиксирующие и другие бактерии на этой среде не развиваются. Для более полного представления о населенности почвы делают посевы на элективные среды (см. 4.2.1) или используют метод прямого подсчета микроорганизмов под микроскопом.
Второй недостаток метода питательных пластин — вероятность неполного учета клеток в образце в связи с тем, что в одном месте в агаре может застыть не одна, а несколько клеток. Образованные ими колонии сливаются, создавая впечатление одной колонии. Если такие колонии имеют неоднородную структуру, можно внести поправку при подсчете, приготовив из них окрашенный препарат. Если под микроскопом обнаруживаются разные формы клеток, например кокки, палочки и сарцины, то считают, что это не одна колония, а, как в данном примере, три. Если все формы клеток одинаковые, то расценивают колонию как результат развития одной клетки (хотя в этом месте одинаковых клеток могло быть 5, 10 и более).

Для сравнения количества КОЕ в разных почвах необходимо подсчитать их число в 1 г абсолютно сухой почвы. С этой целью одновременно со взятием навески почвы для приготовления разведений в отдельный бюкс (металлический или стеклянный), высушенный до постоянной массы, берут навеску (5—10 г) для определения влажности почвы. Сушат почву при 105 °С до постоянной массы. Для определения числа КОЕ в 1 г сырой почвы определяют разность между массами сырой и сухой почвы, делят ее на массу навески и умножают на 100. Затем число клеток в 1 г сырой почвы надо разделить на количество абсолютно сухой почвы, содержащейся в 1 г сырой почвы.
Пример расчета. В 1 г сырой почвы содержится 5600 клеток. При влажности почвы 30% это число клеток будет соответствовать 0,7 г абсолютно сухой почвы. Определяем численность клеток в 1 г абсолютно сухой почвы:
0,7 г абсолютно сухой почвы содержат 5600 клеток
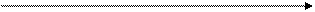
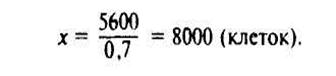 |
Таким образом, в 1 г абсолютно сухой почвы содержится 8 тыс. живых клеток.
Источник
Определение микроорганизмов в почве
Методы оценки суммарной активности почвы и активности отдельных микробиологических процессов. Влияние минеральных и органических удобрений на почву. Среды, применяемые для различных физиологических групп микроорганизмов. Формула определения влажности.
| Рубрика | Биология и естествознание |
| Вид | дипломная работа |
| Язык | русский |
| Дата добавления | 03.06.2014 |
| Размер файла | 186,9 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
1. Принципы определения микроорганизмов в почве
1.1 Методы оценки суммарной активности почвы и активности отдельных микробиологических процессов в почве
1.2 Влияние минеральных и органических удобрений на активацию микробиологических процессов
2. Характеристика объектов и методов исследований
2.1 Характеристика почвы чернозем компостированный, чернозем N120 P90, чернозем влажный и микроорганизмов
2.2 Взятие средней почвенной пробы
2.3 Определение влажности
2.4 Учет численности микроорганизмов в почве
2.5 Приготовление почвенной суспензии и посев на питательные среды
2.6 Среды, применяемые для различных физиологических групп микроорганизмов
2.7 Учет численности микроорганизмов методом обрастания комочков почвы
2.8 Определение биологической активности почвы по интенсивности разложения полотна
3. Результаты исследований и их обсуждение
3.1 Учет численности микроорганизмов на плотных средах
3.2 Определение влажности почвы.
3.3 Качественная и количественная оценка микрофлоры на МПА
3.4 Идентификация микроорганизмов на МПА
3.5 Учет клеток азотобактера
3.6 Определение биологической активности по разложению льняного полотна
3.7 Результаты микробиологического анализа почвы чернозем компостированный, чернозем N120 P90, чернозем
3.8 Обсуждение темы работы
Микробиология — наука, изучающая микроорганизмы — бактерии, микоплазмы, актиномицеты, дрожжи, микроскопические грибы и водоросли — их систематику, морфологию, физиологию, биохимию, наследственность и изменчивость, распространение и роль в круговороте веществ в природе, практическое значение.
Наука о мельчайших организмах, не видимых невооруженным глазом. Микробиология изучает строение микробов (морфология), их химическую организацию и закономерности жизнедеятельности (физиология), изменчивость и наследственность (генетика микроорганизмов), взаимоотношения с другими организмами, включая человека, и их роль в формировании биосферы. В ходе исторического развития микробиологии как наука разделилась на общую, сельскохозяйственную, ветеринарную, медицинскую и промышленную.
Сельскохозяйственная микробиология — изучает роль и значение микробов в формирование структуры почвы, ее плодородия, минерализация и питание растений. Особое внимание в сельскохозяйственной микробиологии уделяется изучение микрофлоры почвы растительного мира, влияние ее на плодородие, состав почвы, инфекционные заболевания растений и т.д.
Сельскохозяйственная микробиология изучает не только состав почвенной микрофлоры, а и ее роль в круговороте веществ в почве, значение для структуры и плодородия почвы, действие бактериальных препаратов на урожайность растений, а также влияние удобрений на микробиологическую активность почвы. Микробиологическая активность почвы зависит от её плодородия, а для повышения плодородия почв используются органические и минеральные удобрения. Но удобрения действуют на почву как положительно, при правильном его использовании, так и отрицательно, что и определяется в работе.
Цель: определить влияние органических и минеральных удобрений на микробиологическую активность чернозема.
1) Провести количественную оценку микрофлоры МПА по числу колоний в 3-х повторениях.
2) Произвести учет комочков почв обросших азотобактером.
3) Определить влажность почв.
4) Провести пересчет числа колоний м/о на 1г сырой почвы, а затем сухой с учетом влажности по средней величине.
5) Сделать вывод о биологической активности почвенного образца.
6) Описать культуральные признаки колонии.
В данной курсовой работе мы определяли влияние органических и минеральных удобрений на микробиологическую активность черноземных почв. Микробиологическую активность почв мы исследовали с помощью методов посева на МПА, по плотности азотобактера и степени разложения льняного полотна. Произвели посев на МПА. Рассмотрели и изучили метод определения общей биологической активности почвы по интенсивности разложения полотна (метод Мишустина — Вострова — Петровой), метод обрастания комочков почвы, произвели учет микроорганизмов на плотных средах, на среде Эшби. Сделали расчеты и сделали вывод: чем больше плодородие почв — тем больше их микробиологическая активность.
1. Принципы определения микроорганизмов в почве
a) Прямые методы учета — Среди методов количественного анализа наиболее объективным является метод прямого микроскопирования почвы, принцип которого был предложен С.Н. Виноградским. При этом способе готовят почвенную суспензию и в определенном объеме ее с помощью микроскопа подсчитывают общее число микроорганизмов. Последующим пересчетом можно установить, сколько микроорганизмов приходится на 1 г исследуемой почвы. С.Н. Виноградский готовил препараты на предметном стекле и просматривал их под оптическим микроскопом. В поле зрения можно было видеть палочковидные бактерии, мелкие и крупные кокки, иногда обрывки мицелия грибов и актиномицетов и другие микроорганизмы.
b) Метод посева: — Состав отдельных групп микроорганизмов (бактерии, актиномицеты, грибы и т. д.) может быть уточнен посевом почвенной суспензии на разные по составу твердые питательные среды, на которых затем развиваются зародыши тех или иных групп микроорганизмов. В практике обычно используют агаризованные или желатинизированные, а иногда силикогелевые питательные среды.
После инкубации засеянных чашек в термостате подсчитывают выросшие на твердой питательной среде колонии. Допуская, что каждая колония произошла из одного зародыша того или иного микроорганизма, устанавливают число клеток во взятом образце почвы. Подобный пересчет имеет ряд условностей.
Метод Коха. 3-4 пробирки с МПЖ расплавляют в водяной бане при 40-45°С. Исследуемый материал вносят бактериологической петлей или пастеровской пипеткой в пробирку с расплавленным МПЖ, равномерно размешивают его, вращая пробирку между ладонями, каплю разведенного материала из первой пробирки переносят во вторую, из второй в третью и т.д. Содержимое каждой пробирки выливают в стерильные чашки Петри. МПЖ должен равномерно покрыть дно чашки. После того как желатин застынет, чашки ставят, чашки ставят крышкой вверх в термостат при температуре 20-22°С. Вместо МПЖ в настоящее время используют МПА. Каждая попавшая в желатин или агар микробная клетка размножается только в том месте, куда была внесена вначале, и образует видимое невооруженным глазом скопление микроорганизмов — колонию, которую отсеивают на МПБ или скошенный МПА для получения чистой культуры.
c) Методы выявления микробных пейзажей: — Метод обрастания стекол по Холодному. На ровной поверхности почвы делают ножом разрез, глубина которого зависит от исследуемого горизонта. Отмытые и обезжиренные стекла плотно прижимают к вертикальной стенке разреза и засыпают почвой. В пахотном слое стекла помещают на 3 — 5 см ниже поверхности. Сверху разрез засыпают почвой и место, где заложены стекла, отмечают этикеткой. Стекла выдерживают в почве в зависимости от задачи исследования от недели до нескольких месяцев.
После истечения времени экспозиции убирают почву с тыльной стороны стекол, «откидывают» их от стенки и вынимают. Тыльную сторону вытирают сухой тряпкой, а опытную поверхность стекол высушивают на воздухе и фиксируют. После фиксации стекло погружают в воду опытной поверхностью вниз, не доводя его до дна. При этом крупные частицы почвы, отмокая, падают на дно, а фиксированные микроорганизмы и мелкие частицы остаются на стекле. После промывки препарат погружают в раствор карболового эритрозина на срок от 30 мин до 24 ч.
Окрашенные препараты исследуют под микроскопом с иммерсионной системой. При микроскопировании отмечают характер микрофлоры, плотность обрастания стекол и доминирующие формы. Отдельные ассоциации микроорганизмов можно запечатлеть, используя микрофотосъемку.
d) Метод капилляров: — Новые возможности в области изучения микробных пейзажей почвы открывает капиллярный метод Б.В. Перфильева и Д.Р. Габе. Для изучения группового состава микроорганизмов почв ими сконструирован капиллярный прибор — педоскоп, который может быть использован и для работы с грунтами. Педоскоп представляет собой набор капиллярных ячеек с 5—6 прямоугольными каналами. Ячейки закладывают в пазы широкого стеклянного держателя и заполняют полужидкой агаризованной средой, содержащей в качестве органического субстрата гумусовые вещества (фульвокислоты). Это создает для микроорганизмов условия, близкие к почвенным. Педоскоп выдерживают в почве 1,5—2 месяца, затем просматривают его под микроскопом. С помощью этого метода удается выявить характерные для почвы микробные ассоциации.
1.1 Методы оценки суммарной активности почвы и активности отдельных микробиологических процессов в почве
a) Нитрифицирующая активность почвы, показателей такой активности служит нитрификационная способность почвы, характеризующая мобилизуемость азотного запаса почвы в результате деятельности микроорганизмов. Нитрификационную способность устанавливают по нарастанию в почве количества нитратов после выдерживания ее при определенных условиях в термостате. Описанная проба свидетельствует о потенциальной способности почвы накапливать то или иное количество минерального азота. Количество выделяемого диоксида углерода за определенный промежуток времени пересчитывают на 1 г абсолютно сухой почвы, или на 1 г гумуса.
b) Дыхание почвы — как показатель энергии разложения органических соединений почвы определяется по выделению углекислого газа;
c) Метод аппликаций — разложение ткани льняного полотна: чем выше в почве содержание подвижного азота и других элементов питания, тем активнее идет окисление клетчатки микроорганизмами. Клетчатка служит для них только источником углерода. Поэтому при отсутствии в почве азота целлюлоза разрушающие микроорганизмы не могут использовать клетчатку, так как кроме углерода им нужен и азот, а также и другие элементы питания, которые они берут извне.
Следовательно, биологическая активность почвы, определенная по интенсивности разложения полотна, служит показателем интенсивности не только процессов не только превращения углерода, но и обеспеченности почвы азотом и другими элементами.
d) Метод ферментативных показателей: Для оценки биологической активности почвы исследуют также ферменты, находящиеся в почве. В основном их продуцируют микроорганизмы, поэтому между показателями активности ферментов почвы и определенными микробиологическими процессами намечается коррелятивная зависимость.
Абсолютные значения отдельных показателей активности ферментов различаются для почв разных климатических зон, что может быть использовано в диагностических целях.
При отмирании микроорганизмов окружающая среда еще более обогащается ферментами, которые в значительной части адсорбируются почвенными коллоидами, что способствует их стабилизации. Отмечено, что ферментные процессы в почве прекращаются при значительно более низкой влажности, чем деятельность микроорганизмов. Определение активности ферментов почвы может дать представление об их плодородии.
1.2 Влияние минеральных и органических удобрений на активацию микробиологических процессов
Органические удобрения — навоз, городские отходы, компосты и др. способствует интенсификации микробиологических процессов, поскольку они являются источником энергии и элементов питания микроорганизмов.
Содержание органического вещества в навозе составляет 20-25%; количество питательных для растений веществ ограничивается долями процента 0,5% азота, 0,2% P2O5; 0,6% K2O.
В навозе довольно много бактерий рода Pseudomonas, представителей группы кишечной палочки и других неспорообразующих палочковидных аммонификаторов. Некоторые из них могут вызывать денитрификацию. Многие аммонифицирующие бактерии навоза могут вызывать распад мочевины. Многочислена в навозе группа аэробных микроорганизмов, разлагающие целлюлозу, таких как Cytophaga, несколько беднее представлен род Cellvibrio и др. Обнаружены также анаэробные разрушители целлюлозы Clostridium omelianskii.
Внесение в почву удобрений не только улучшает питание растений, но и изменяет условия существования почвенных микроорганизмов, также нуждающихся в минеральных элементах.
При благоприятных климатических условиях количество микроорганизмов и их активность после внесения в почву удобрений значительно возрастают. Усиливая распад гумуса, увеличивается мобилизация азота, фосфора, и других элементов.
Внесение в почву минеральных и органических удобрений усиливает интенсивность микробиологических процессов, в результате чего сопряженно увеличивается трансформация минеральных и органических в-в. Характерным показателем активации микробной деятельности под влиянием удобрений служит усиление «дыхания» почвы, т.е. выделение ею CO2. Это результат ускоренного разложения органических соединений почвы, в том числе гумуса.
Внесение минеральных удобрений вызывало некоторое снижение численности актиномицетов и увеличение грибного населения. Это могло быть следствием сдвига рН в кислую сторону в результате внесения физиологически кислых солей: актиномицеты плохо переносят подкисление, а размножение многих грибов ускоряется в более кислой среде.
Как видно, минеральные удобрения, хотя и активизировали деятельность микроорганизмов, но уменьшили потери гумуса. Навоз оказал на все группы микроорганизмов почвы весьма благоприятное действие.
2. Характеристика объектов и методов исследований
2.1 Характеристика почвы чернозем компостированный, чернозем N120 P90, чернозем влажный и микроорганизмов
Черноземные почвы — это такая растительно-наземная почва, толщина которой в среднем около 60 см. Её плодородие определяется наличием гумуса, который представляет собой перегной, образовавшийся в результате обмена питательными веществами между микроорганизмами и растениями. Гумус состоит из гуминовых кислот и фульвокислот, которые необходимы для полноценного роста растений и укрепления их корневой системы. Чернозем характеризуется самым высоким содержанием питательных элементов среди почв и грунтов, суглинистым механическим составом, зернистой структурой с отдельными агрегатами и нейтральной реакцией среды.
Черноземные почвы отличаются значительным содержанием органических веществ, обусловливающих темный цвет их; такого содержания органических веществ мы не находим в других почвах в недалеком расстоянии от чернозема, при условиях, по-видимому, вполне сходных.
Главная масса микроорганизмов сосредоточенна в пределах верхней 20 -сантиметровой толщи почвы. Микроорганизмы принимают самое активное участие в процессе гумусообразования (биохимический процесс). В то же время определенное количество микроорганизмов является активными деструкторами гумуса.
Необходимо отметить большое влияние микроорганизмов на содержание почвенного воздуха. Колебание кислорода и углекислого газа, почти полностью регулируется микроорганизмами. Исключительно велика роль микроорганизмов в циклах превращения азотосодержащих соединений и фиксации его из атмосферы.
Черноземные почвы являются весьма благоприятной средой для развития таких микроорганизмов: Bacillus cereus, Bacillus idosus, Bacillus megaterium, род Pseudomonas — до 15%, род Azotobacter — до 15%.
2.2 Взятие средней почвенной пробы
Образцы почвы для исследований берутся с соблюдением ряда требований:
а) Образец, должен быть «средней почвенной пробой», которую получают путем смешивания отдельных образцов почвы (со 100 м 2 берут пробу из трех точек, с площади свыше 100 м 2 — из пяти, с 1 га и более из 15 точек);
б) Образец должен отражать характеристику исследуемой почвы: если анализируют пахотную почву, то пробы следует брать из всего пахотного слоя снимая верхние 2 см; если анализируют определенный генетический горизонт или почву по профилю, пробу берут из соответствующего горизонта;
в) Образец берется с соблюдением правил асептики, стерильным буром, стерильной лопатой или ножом в стеклянную широкогорлую стерильную банку, закрывают корковой пробкой, обернутой стерильной ватой, или в стерильные полиэтиленовые мешки. Бур, лопату и нож в поле тщательно очищают, смачивают спиртом и обжигают;
г) Образец почвы должен иметь четкую характеристику, откуда он взят. Для этого на пакеты или банки наклеивают этикетку с указанием места взятия пробы, горизонта и других необходимых сведений;
д) Образец почвы для микробиологического анализа должен быть свежим. Обычно образцы почвы анализируют в первые сутки после взятия пробы. Допускается хранение в холодильнике в течение двух суток;
е) Образцы почвы должны быть однородными. Для этой цели средний образец тщательно перемешивают, соблюдая правила асептики, вынимают корни растений и различные включения, например, камни.
2.3 Определение влажности
Для определения влажности почвы берется 10-20 г почвы. Сначала взвешивается пустой бюкс, затем бюкс с почвой. Данные записываются. Образец высушивается при 105о. С в сушильном шкафу и после достижения постоянной массы определяют содержание сухой почвы в 1 г сырой.
Влажность (А) почвы определяют по формуле:
Где в — масса бюкса с сырой почвой;
с — масса бюкса с сухой почвой;
а — масса пустого бюкса.
2.4 Учет численности микроорганизмов в почве
Учет численности микроорганизмов в почве проводится различными методами, наиболее распространенным является метод питательных пластин (метод Коха). Этот метод позволяет учесть количество живых клеток в почве и выявить родовой, а иногда и видовой состав, выделить чистые культуры бактерий. Для различных физиологических групп микроорганизмов существуют различные среды, так как потребность в питательных веществах у них различная. Используются плотные и жидкие среды.
2.5 Приготовление почвенной суспензии и посев на питательные среды
На стерильное часовое стекло, предварительно взвешенное, стерильным шпателем или алюминиевой ложкой помещают 1 г почвы и накрывают другим часовым стеклом для предупреждения попадания микроорганизмов из воздуха. Стекла, шпатели и ложки стерилизуют фламбированием. почва микробиологический удобрение
Навеску почвы переносят в колбу, емкостью 250 мл содержащую 99 мл стерильной водопроводной воды, интенсивно взбалтывают вращательным движением (не смачивая пробки) в течение 5 минут и дают отстояться грубым частицам почвы.
Одновременно со взятием навески для анализа из средней пробы отбирают 10-20 г почвы для определения влажности.
Затем из почвенной суспензии готовят разведения, содержащие разные концентрации почвы. 1 мл суспензии в первой колбе соответствует разведению 10-2. Последующие разведения (10-3, 10-4, 10-5, 10-6 и т.д.) готовят в пробирках с 9 мл стерильной воды. В этом случае из предыдущего разведения стерильной пипеткой переносят 1 мл суспензии в последующую пробирку. Пипетки каждый раз ополаскивают.
Из полученных разведений проводят посев на плотные и жидкие среды. Посев суспензий на плотные питательные среды проводят, как правило, поверхностно. Для этого агаризованные питательные среды разливают в стерильные чашки Петри и после охлаждения на поверхность среды стерильной градуированной пипеткой (на 1 мл) наносят 0,05 мл почвенной суспензии из соответствующего разведения, затем стерильным шпателем Дригальского растирают калю досуха. При растирании открытую чашку держат почти в вертикальном положении около пламени горелки. Шпатель стерилизуют фламбированием. Посев и каждого разведения проводят минимум на 2-3 параллельные чашки.
При глубинном посеве берут 1 мл почвенной суспензии и вносят в стерильную чашку Петри, заливают охлажденным до 45 о С расплавленным агаром и перемешивают кругообразными движениями. При глубинном посеве выявляется меньше микроорганизмов, чем при поверхностном.
Все засеянные чашки Петри и пробирки ставят в термостат с температурой 28-30 о С на определенный срок инкубации, затем вынимают и учитывают результаты.
2.6 Среды, применяемые для различных физиологических групп микроорганизмов
На мясо-пептонном агаре (МПА) учитывают сапрофитные микроорганизмы, использующие органические формы азота. На крахмало-аммиачном агаре (КАА) выявляют численность микроорганизмов, способных использовать минеральные формы азота (особенно актиномицеты).
Жидкие среды Имшенецкого и Солонцевой используют для учета аэробных целлюлозоразрушающих микроорганизмов, среду Гильтая — для нитрифицирующих бактерий, среду Виноградского — для анаэробных азотфиксаторов (Cl. Pasteurianum).
Для учета азотобактера используют метод обрастания комочков почвы (на агаризованной среде Виноградского или Эшби).
2.7 Учет численности микроорганизмов методом обрастания комочков почвы
Содержание колоний азотобактера определяют на агаризованной среде Эшби. На твердой поверхности среды раскладывают по трафарету 40-50 комочков почвы диаметром 1-2 мм, чашки помещают во влажную камеру и ставят в термостат. На третьи-пятые сутки инкубации развиваются колонии азотобактера, слизистые, бело-серые, которые постепенно приобретают темно-бурый (Azotobacter chroococcum) или зеленый пигмент (Az. Agilis).
Подсчитывают комочки почвы, обросшие микроорганизмами, а затем определяют, какой процент они составляют от общего числа комочков почвы (относительная оценка плотности заселения микроорганизмов учитываемых групп в почве).
После определения процента обрастания комочков почвы азотобактером и определения степени разложения льняного полотна (биологическая активность) результаты общего микробиологического анализа почвенного образца можно представить в виде таблицы.
Общее количество микроорганизмов на МПА
Количество споровых на МПА
Количество неспоровых на МПА
Биологическая активность (% разложения полотна)
2.8 Определение биологической активности почвы по интенсивности разложения полотна
Чем выше в почве содержание подвижного азота и других элементов питания, тем активнее идет окисление клетчатки микроорганизмами. Клетчатка служит для них только источником углерода. Поэтому при отсутствии в почве азота целлюлозоразрушающие микроорганизмы не смогут использовать клетчатку, так как кроме углерода им нужен и азот, а так же и другие элементы питания, которые они берут извне.
Следовательно, биологическая активность почвы, определенная по интенсивности разложения полотна, служит показателем интенсивности не только процессов превращения углерода, но и обеспеченности почвы азотом и другими элементами.
Целлюлозоразрушающие микроорганизмы, разлагая клетчатку, синтезируют и частично выделяют в среду аминокислоты. Поэтому при обработке полуразрушенного полотна 0,5%-ным раствором нингидрина в тех местах, где активно развивались микроорганизмы и разлагалась клетчатка, на полотне образуются сиреневые пятна (реакция аминокислот с нингидрином).
Для опыта хорошо отмытые стекла (10*50) обшивают льняным полотном. Стерильной лопаткой и стерильным ножом делают почвенный разрез на глубину 35 см. К ровной стенке разреза по профилю прикладывают стекло с полотном, с противоположной стороны стекло засыпают почвой и прижимают плотно к стенке. Полотно закладывают ниже поверхности почвы на 2-3 см. В том месте, где помещают полотно, ставят этикетки.
Через 20-30 дней стекла откапывают, подсушивают полотно, осторожно стряхивая с него почвенные частицы, и обрабатывают 0,5%-ным раствором нингидрина в ацетоне для выявления аминокислот.
Для определения степени разложения полотна в процентах вырезают определенную его площадь на глубину горизонта (анализ проводят по горизонтам), промывают остаток полотна водой, высушивают и взвешивают. Потом кусок такой же площадью вырезают из контрольного полотна и тоже взвешивают.
3. Результаты исследований и их обсуждение
3.1 Учет численности микроорганизмов на плотных средах
После инкубации чашки с засеянными средами вынимают из термостата и подсчитывают число выросших колоний, которые отражают число живых клеток микроорганизмов в почве.
При подсчете колоний на плотных питательных средах (МПА) чашки Петри, не открывая, просматривают в проходящем свете и с внешней стороны донышка чашки отмечают колонии тушью или чернилами. Чтобы учесть и мелкие колонии, чашки дополнительно просматривают под лупой. Если на чашке больше 200 колоний, то их можно подсчитать с помощью камеры Вольфюгеля.
Чтобы установить количество клеток бактерий в 1г сырой почвы, число клеток в 1 мл умножают на степень разведения, т.е. число, показывающее, во сколько раз в каждом конкретном случае разбавили 1 г почвы. Например, при разведении 10-3 умножают на 1000, 10-4 на 10000,… 10-6 на 106 и т.д.
При глубинном посеве для подсчета количества микроорганизмов в 1 г сырой почвы число клеток (колоний) умножают на степень разведения.
При поверхностном посеве вначале определяют количество клеток микроорганизмов в 1 мл соответствующего разведения, для чего число колоний умножают на 20 (так как было посеяно 0,05 мл).
Для сравнения количества бактерий в разных почвах необходимо подсчитать их число в 1 г абсолютно-сухой почвы. Для этого количество клеток в 1 г сырой почвы делят на количество абсолютно-сухой почвы, содержащейся в 1 г сырой почвы.
Число клеток в 1 г абс. сухой почвы:
Чернозем компостированный: (среднее число колоний 39)
Чернозем N120 P90: (среднее число колоний 18)
Чернозем: (среднее число колоний 54)
3.2 Определение влажности почвы
Абсолютно сухой почвы в 1 г сырой: 1-0,59 = 0,41 г
Абсолютно сухой почвы в 1 г сырой: 1-0,23 = 0,77 г
Абсолютно сухой почвы в 1 г сырой: 1-0,363 = 0,637 г
3.3 Качественная и количественная оценка микрофлоры на МПА
Таблица 1 Биологическая активность и численность микроорганизмов различных групп в 1 воздушно-сухой почвы чернозем компостированный
Источник
