Учет численности микроорганизмов в почве
Почва – наиболее благоприятная среда для развития микроорганизмов. В связи с большой гетерогенностью ее состава для учета численности в ней микроорганизмов с исследуемого участка берут среднюю пробу.
Среднюю почвенную пробу получают смешиванием отдельных образцов, количество которых зависит от микрорельефа, степени гетерогенности почвы и ее однородности в ботаническом отношении. Рекомендуют с площади 100 м 2 брать пробу из трех точек, с площади, превышающей 100 м 2 , — из пяти по методу «конверта», с 1 га и более – из 15 точек. При исследовании пашни пробы берут с глубины всего пахотного слоя, снимая верхний слой толщиной 2 см; при изучении микрофлоры почвенного профиля – по генетическим горизонтам (снизу вверх).
Почвенный образец берут буром, лопатой и ножом. В поле перед взятием образца их тщательно очищают, затем обрабатывают спиртом и обжигают. Укладывают образец в заранее приготовленную стеклянную широкогорлую стерильную банку, закрывающуюся корковой пробкой, обернутой стерильной бумагой, либо в стерильные пергаментные пакеты. На пакеты и банки наклеиваются этикетки с указанием места взятия пробы, горизонта и других сведений.
Почвенные образцы анализируют в первые сутки. При необходимости допускается хранение их в холодном помещении (в холодильнике) в течение 2 дней.
Приготовление почвенной суспензии и посев
На стерильное часовое стекло стерильным шпателем помещают 5 г почвы. Чтобы при взвешивании в почву не попали микроорганизмы из воздуха, особенно споры грибов, часовое стекло накрывают другим часовым стеклом. Предварительно стекла взвешивают. Часовые стекла и шпатели стерилизуют фламбированием. Навеску почвы переносят в стерильную фарфоровую ступку, увлажняют 0,5 мл воды и растирают пальцем в стерильной резиновой перчатке в течение 5 мин. Перед приготовлением почвенной суспензии для каждого образца готовят 2 стерильные колбы на 250 мл. Одна содержит 50 мл стерильной водопроводной воды, другая — пустая. Водой из первой колбы растертую почвенную массу смывают в пустую стерильную колбу. Колбу с полученной почвенной суспензией взбалтывают 10 мин и дают отстояться крупным частицам почвы.
Далее готовят разведения, содержащие разные концентрации почвы в 1 мл воды. Для этого из колбы стерильной пипеткой берут 1 мл суспензии, содержащей 10 -1 г почвы, и переносят в пробирку с 9 мл стерильной водопроводной воды. Пипетку неоднократно промывают в пробирке, чтобы максимально смыть клетки с ее стенок. Концентрация почвы в пробирке будет 10 -2 г.
Другой стерильной пипеткой берут 1 мл суспензии из первой пробирки и переносят ее во вторую пробирку, тщательно повторяя процедуру промывания пипетки. Концентрация почвы во второй пробирке будет 10 -3 г. Точно также новыми стерильными пипетками производят дальнейшие разведения почвенной суспензии до достижения разведения 10 -5 и 10 -6 г.
Для определения численности микроорганизмов в каждом разведении методом питательных пластин проводят глубинный или поверхностный посев. Методы посева описаны выше. Для учета бактерий используют среду МПА, для учета микроскопических грибов – среду Чапека (см. приложение 1).
Учет численности микроорганизмов
Клетки микроорганизмов, попав в питательную среду, начинают размножаться и образуют видимые невооруженным глазом колонии. Каждая колония на чашке с питательной средой вырастает из одной колониеобразующей единицы (КОЕ), которая может представлять собой бактериальную, дрожжевую клетку, кусочек мицелия актиномицета или гриба.
Подсчет численности бактерий осуществляют через 24-48 часов инкубации чашек в термостате, грибов – через 7 суток, актиномицетов – через 10-14 суток.
Количество КОЕ в 1 г сырой почвы устанавливают, умножая число КОЕ в чашке на степень разведения – число, показывающее, во сколько раз в конкретном случае разбавили 1 г почвы.
Для правильного определения численности КОЕ подсчитывают только чашки, в которых колоний свыше 10 и не более 250-300.
Для сравнения количества КОЕ в разных почвах необходимо подсчитать их число в 1 г абсолютно сухой почвы. Для этого одновременно со взятием навески определяют влажность почвы. Метод определения влажности почвы приведен в приложении 2. Для определения количества КОЕ в абсолютно сухой почве необходимо число клеток в сырой почве разделить на количество абсолютно сухой почвы, содержащейся в 1 г сухой почвы.
Пример расчета. При посеве из пробирки с разведением почвенной суспензии 10 -6 г на чашке выросло 18 колоний. Содержание абсолютно сухого вещества почвы составило 70%, т.е. 0,7 г сухой почвы в 1 г сырой почвы.
Число клеток (КОЕ) в 1 г сырой почвы равно 18000000.
Число клеток (КОЕ) в 1 г сухой почвы равно
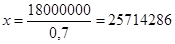
Метод питательных пластин легко выполним, но имеет ряд недостатков, самый существенный из которых – отсутствие универсальной среды для развития всех микроорганизмов, обитающих в почве. Питание у разных бактерий специфично, и на каждой среде выделяется только физиологическая группа. Так, на наиболее часто применяемой среде мясо-пептонном агаре МПА развиваются в основном гнилостные бактерии, способные усваивать легко доступные органические формы азота. Для более полного представления о населенности почвы делают посевы на элективные среды или используют метод прямого подсчета микроорганизмов под микроскопом.
Источник
Учет численности микроорганизмов (КОЕ) в почве методом питательных пластин в сочетании с методом последовательных разведений
Методы учета численности микроорганизмов
Учет численности и выделение чистой культуры микроорганизмов
Почва — наиболее благоприятная среда для развития микроорганизмов. В связи с большой гетерогенностью ее состава для учета численности в ней микроорганизмов с исследуемого участка бepyт среднюю почвенную пробу (см. 10.1.1),
Сначала готовят суспензии (методом разведения), содержащие разные концентрации почвы в 1 мл воды. Для этого на стерильное часовое стекло стерильным фарфоровым шпателем или алюминиевой чайной ложкой 6epyт из банки или мешка навеску почвы в 1 г. Часовое стекло, шпатель, ложку фламбируют в пламени горелки или, смочив в спирте, обжигают. При взвешивании почвы часовое стекло накрывают другим стерильным часовым стеклом.
Навеску почвы, соблюдая условия асептики, переносят в колбу на 250 мл с 49 мл стерильной воды. Смесь в взбалтывают 5 мин, не смачивая пробку. Стерильной пипеткой берут 1 мл суспензии, содержащей 10 -2 г почвы, и переносят в пробирку с 9 мл стерильной водопроводной воды. Пипетку неоднократно промывают водой в пробирке, чтобы максимально смыть клетки с ее стенок. Другой стерильной пипеткой берут из колбы еще 1 мл суспензии и помещают во вторую колбу, также содержащую 99 мл стерильной водопроводной воды. Эту пипетку промывают таким же образом, как и в первом случае. Пробирку и вторую колбу взбалтывают 1 мин. Концентрация почвы в пробирке будет 10-3 г , во второй колбе – 10 -4 г . Точно так же новыми стерильными пипетками переносят по 1 мл суспензии из второй колбы во вторую пробирку с 9 мл и в третью колбу с 99 мл стерильной водопроводной воды и готовят новые суспензии, содержащие в 1мл соответственно 10 -5 и 10 -6 г почвы.
Для определения численности микроорганизмов в каждом разведении методом питательных пластин можно провести глубинный или поверхностный посев. Последний более сложен и занимает больше времени. Поэтому для подсчета численности бактерий в почве методом питательных пластин можно ограничиться глубинным посевом, а поверхностный использовать при учете численности различных физиологических групп микроорганизмов на плотных средах (см. главу 10).
Для определения количества живых клеток, содержащихся в 1 мл суспензии каждого разведения, берут по 1 мл этих суспензий и переносят в стерильные чашки Петри, используя всякий раз новую стерильную пипетку (лучше пипетку Мора). На крышках чашек стеклографом отмечают исследуемый вариант и разведение. Затем в чашки Петри вливают расплавленный МПА, заранее приготовленный и разлитый в пробирки на 20 мл ( 2 /3 объема) из расчета одна пробирка на чашку. Температура агара должна быть примерно 45 °С. Ее определяют, прикладывая пробирку с расплавленным агаром к щеке: если щеке не горячо — среду можно пылить в чашку Петри. Осторожными круговыми движениями чашки, не смачивая крышку, aгар перемешивают с суспензией. Чашки с застывшим агаром переворачивают вверх дном, чтобы избежать попадания на его поверхность конденсационной влаги с крышки, и помещают в термостат при 28—30 °С.
Клетки микроорганизмов, попав в питательную среду, начинают размножаться и образуют видимые невооруженным глазом колонии. Каждая колония на чашке с питательной средой вырастает из одной колониеобразующей единицы (КОЕ), которая может представлять собой бактериальную, дрожжевую клетку, спору, кусочек мицелия актиномицета или гриба. Через 48 ч инкубации чашки вынимают из термостата и предварительно подсчитывают число колоний. В связи с тем, что существуют медленнорастущие формы бактерий, окончательный подсчет делают на 5-е сут.
Количество КОЕ в 1 г сырой почвы устанавливают, умножая число колоний в чашке на степень разведения — число, показывающее, во сколько раз в каждом конкретном случае разбавили 1 г почвы. Казалось бы, во всех вариантах посева должно получиться примерно одинаковое число КОЕ, однако на практике происходит не так.
Иногда клеток так много, что развившиеся колонии микроорганизмов сливаются, что часто наблюдается в чашках при разведении 10 -2 . При высоких разведениях вырастают единичные колонии (меньше 10 на чашке), которые могут образоваться от случайно попавших клеток из воздуха при внесении в чашку почвенной суспензии или питательной среды. Учет таких чашек сделает подсчет недостоверным. Для правильного определения численности КОЕ подсчитывают только чашки, в которых колоний свыше 10 и не более 250—300 (в последнем случае при условии, если колонии очень мелкие).
При подсчете колоний чашки просматривают в проходящем свете и, чтобы дважды не учитывать одни и те же колонии, подсчитанные отмечают чернилами или тушью. Чтобы не пропустить мелкоточечные колонии, чашки дополнительно просматривают под лупой. Можно использовать и специальный прибор для подсчета колоний.
Бывают случаи, когда в последнем разведении (10 -6 ) число колоний значительно больше 300. Такой посев желательно повторить, увеличив число разведений. Если это невозможно, подсчет выполняют, учитывая, что он дает представление лишь о минимальной численности микроорганизмов в почве.
Метод питательных пластин легко выполним, но имеет ряд недостатков, самый существенный из которых — отсутствие универсальной среды для развития всех микроорганизмов, обитающих в почве. Питание у разных бактерий специфично, и на каждой среде выявляется довольно узкая физиологическая группа. Так, на МПА развиваются в основном гнилостные бактерии, способные усваивать легко доступные органические формы азота. Нитрифицирующие, целлюлозоразрушающие, азотфиксирующие и другие бактерии на этой среде не развиваются. Для более полного представления о населенности почвы делают посевы на элективные среды (см. 4.2.1) или используют метод прямого подсчета микроорганизмов под микроскопом.
Второй недостаток метода питательных пластин — вероятность неполного учета клеток в образце в связи с тем, что в одном месте в агаре может застыть не одна, а несколько клеток. Образованные ими колонии сливаются, создавая впечатление одной колонии. Если такие колонии имеют неоднородную структуру, можно внести поправку при подсчете, приготовив из них окрашенный препарат. Если под микроскопом обнаруживаются разные формы клеток, например кокки, палочки и сарцины, то считают, что это не одна колония, а, как в данном примере, три. Если все формы клеток одинаковые, то расценивают колонию как результат развития одной клетки (хотя в этом месте одинаковых клеток могло быть 5, 10 и более).

Для сравнения количества КОЕ в разных почвах необходимо подсчитать их число в 1 г абсолютно сухой почвы. С этой целью одновременно со взятием навески почвы для приготовления разведений в отдельный бюкс (металлический или стеклянный), высушенный до постоянной массы, берут навеску (5—10 г) для определения влажности почвы. Сушат почву при 105 °С до постоянной массы. Для определения числа КОЕ в 1 г сырой почвы определяют разность между массами сырой и сухой почвы, делят ее на массу навески и умножают на 100. Затем число клеток в 1 г сырой почвы надо разделить на количество абсолютно сухой почвы, содержащейся в 1 г сырой почвы.
Пример расчета. В 1 г сырой почвы содержится 5600 клеток. При влажности почвы 30% это число клеток будет соответствовать 0,7 г абсолютно сухой почвы. Определяем численность клеток в 1 г абсолютно сухой почвы:
0,7 г абсолютно сухой почвы содержат 5600 клеток
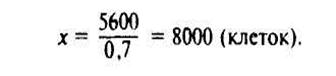 |
Таким образом, в 1 г абсолютно сухой почвы содержится 8 тыс. живых клеток.
Источник
Учет численности микроорганизмов почвы.



Для учета численности микроорганизмов в почве применяют широко распространенный метод питательных пластин (метод Коха). Он позволяет учесть количество живых клеток в почве и выявить родовой и видовой состав, выделить чистые культуры бактерий. Но потребность в питательных веществах у различных микроорганизмов неодинакова, поэтому суспензию почвы высевают на разные среды (плотные и жидкие), предназначенные для различных физиологических групп микроорганизмов.
При посеве почвенной суспензии на жидкие питательные среды методом предельного разведения, численность микроорганизмов бывает несколько занижена.
Приготовление почвенной суспензии и посев на питательные среды.
Для проведения общего микробиологического анализа почвы, необходимо сделать посев микроорганизмов на плотные (МПА, КАА) и жидкие среды (среда Гильтая, среда Виноградского)
мясо – пептонный агар (МПА) – учитывают количество сапрофитных микроорганизмов, использующие в качестве источника углерода органические соединения.
крахмало – аммиачный агар (КАА) – выявляют микроорганизмы, способные использовать минеральные формы азота.
среда Гильтая – используют для выявления денитрифицирующих бактерий.
среда Виноградского – применяется для определения анаэробных азотофиксаторов (Clostridium pasterianum).
Также используют метод обрастания комочков для выявления численности определенных групп микроорганизмов:
— для выявления аэробных целлюлозоразлагающих микроорганизмов раскладывание комочков производится насреде Гетченсона.
— для выявления аэробных азотофиксаторов (в т.ч. Azotobacter) – на среде Эшби.
Приготовление почвенной суспензии: 10г почвы помещают в колбу емкостью 250 мл с 90 мл стерильной водопроводной воды, интенсивно взбалтывают вращательным движением (не смачивая пробки) 10 мин. Затем методом разведения готовят суспензии, содержащие разное количество почвы: из предыдущего разведения стерильной пипеткой переносят 1 мл суспензии в пробирку, содержащую 9 мл воды. В первой пробирке 1 мл суспензии, приготовленной по этому методу, соответствует разведению 10 -1 .
Из полученных разведений делают посев на жидкие и плотные питательные среды.
Если численность отдельных групп микроорганизмов в почве небольшая, их выявляют методом обрастания комочков почвы.
Результаты опыта. Учет численности микроорганизмов различных групп.
Источник


