Условия культивирования микроорганизмов, микробиология
Условия культивирования микроорганизмов, микробиология
Условия культивирования микроорганизмов Для роста микроорганизмов существенное значение имеют не только состав питательной среды, но и такие факторы, как кислотность среды, аэрация, температура, свет, влажность. Развитие микроорганизмов возможно лишь в определенных пределах каждого фактора, причем для различных групп микроорганизмов эти пределы часто не одинаковы. Активная кислотность среды (рН) имеет решающее значение для роста многих микроорганизмов. Большинство бактерий лучше всего растет при рН, близком к 7,0, напротив, микроскопические грибы предпочитают слабокислые среды. Поэтому в приготовленных средах всегда следует определить значение рН. Значение рН сред может измениться в процессе стерилизации, поэтому после стерилизации его следует проверить и довести до нужного, если это требуется, стерильными растворами кислоты или щелочи. В процессе культивирования микроорганизмов кислотность питательной среды часто меняется. Эти изменения могут быть результатом образования продуктов метаболизма или неравномерного потребления отдельных компонентов среды. Поддержание определенного значения рН во время роста особенно важно для тех микроорганизмов, которые образуют в процессе жизнедеятельности кислоты, но не обладают устойчивостью к ним. К их числу относятся мол очно-кислые бактерии, а также многие псевдомонады. Аэрация. По типу дыхания бактерии разделяют на 4 группы:
а) облигатные, или строгие, аэробы, которые могут расти только при наличии кислорода; б) микроаэрофилы, которые нуждаются в кислороде, но лучше растут при парциальном давлении О2 меньшем, чем в воздухе; в) факультативные анаэробы, которые способны расти как в присутствии, так и в отсутствии молекулярного кислорода (например, некоторые дрожжи или энтеробактерии в зависимости от наличия кислорода осуществляют аэробное дыхание или брожение; г) облигатные анаэробы (клостридии ботулизма, газовой гангрены, столбняка, бактероиды и др.) растут только на среде без кислорода, который для них токсичен. Неодинаковые потребности микроорганизмов в свободном кислороде определяют различия и в способах их культивирования. Температура. Интервалы температур, в которых возможен рост различных микроорганизмов, заметно варьируются. У мезофилов, к которым относится большинство известных бактерий, температурный оптимум ле35 жит в интервале 25 — 37 °С. У термофилов он значительно выше — от 45 до 80 — 90 °С. Психрофилы хорошо развиваются в интервале температур 5 — 10 0 С. Отклонения температуры от оптимальной неблагоприятно влияют на развитие микроорганизмов.
мезофильные микроорганизмы выращивают в термостатах или специальных термостатированных комнатах, где с помощью терморегуляторов поддерживается соответствующая оптимальная температура. Для выращивания психрофилов используют холодильные камеры. Периодическое и непрерывное культивирование. Существуют две принципиально разные системы выращивания микроорганизмов в жидкой среде.
В одном случае после инокуляции среды не происходит ни добавления в нее, ни удаления каких-либо компонентов, кроме газовой фазы. Такая закрытая система культивирования носит название периодической и может поддерживать размножение клеток только в течение ограниченного времени, на протяжении которого меняются состав исходной среды и окружающие условия. Непрерывное (проточное) культивирование в отличие от периодического характеризуется постоянной подачей питательной среды со скоростью, равной скорости удаления культуры. При этом объем культуры в ферментере во времени не меняется. Одно из основных условий непрерывного культивирования — хорошее перемешивание культуры в ферментере.
Источник
Микробиология дома: выращиваем полезные бактерии
Процесс выращивания таких клеточных культур, как бактерии, предъявляет особые требования к питательной среде. Особых сложностей при выращивании бактерий нет, данное мероприятие достаточно легко осуществить в домашних условиях при наличии соответствующих знаний из области микробиологии и набора инструментов (основной инвентарь, используемый в лаборатории, – чашка Петри).
Среда представляет собой раствор со специальным составом. Это совокупность компонентов, обеспечивающих благоприятные условия для культивирования микроорганизмов или постепенного накопления продуктов их жизнедеятельности, которые будут после использованы для определенных целей. Широко применяются в пищевой и хозяйственной промышленности. Для каждого вида культур среда должна быть разной. Так, процесс выращивания молочнокислых палочек или бактерий для септика существенно отличаются.
Особенности раствора
Питательные среды классифицируют по составу, назначению, консистенции. Существует две основные группы: производственные и диагностические.
- Производственные среды – основа для изготовления медицинских лекарственных препаратов, бактерий для септика. Растворы позволяют производить контроль качества биовеществ. В таких питательных средах для выращивания культур бактерий не должно быть вредных токсических примесей, способных нанести вред человеку или повлиять на процессы жизнедеятельности колоний.
- В диагностических питательных средах выделяют следующие подгруппы целевого назначения:
- для выделения отдельных видов культур бактерий (дифференциальные);
- для выращивания широкого спектра колоний микроорганизмов;
- для выделения конкретного типа возбудителя; накопительные среды (обогащение бактерий выделяемыми ими продуктами жизнедеятельности).
По консистенции различают:
В плотных и полужидких питательных средах основным компонентом является жидкая основа, к которой добавляется агар. Это полисахарид, который выделяется в лаборатории из некоторых разновидностей морских водорослей.

Наиболее распространенные плотные среды: сыворотка крови свернутая, яйца, также выращивание колоний может производиться на картофеле.
Популярный и доступный инвентарь
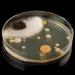
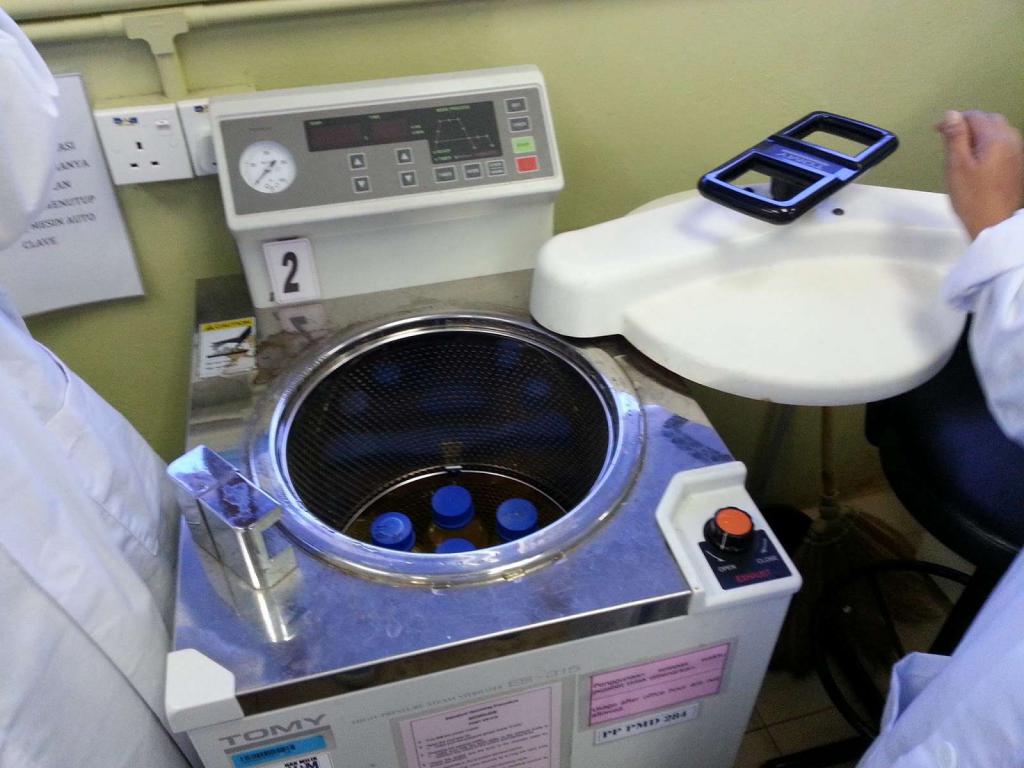
Культивирование микроорганизмов в чашке Петри – один из самых распространенных методов получения необходимых бактерий, отличающийся простотой использования. Он подходит и для молочнокислых культур в том числе.
Чашка Петри – емкость для лаборатории и дома, представляющая собой два плоских блюда с вертикальными невысокими краями. То блюдо, что больше, служит крышкой.
С целью выращивания колоний в питательной среде Петри должна быть подготовлена соответствующим образом. Для стерилизации стеклянный сосуд обдают сухим жаром, используя сушильный шкаф. Затем осторожно выливают на ее поверхность остуженную до 55°C среду (расплавленную), придерживаясь горизонтального положения посуды. Использовать можно любые мазки – с щелей в полу или плинтусов, со стола на кухне, даже с собственной кожи. Аккуратно стряхните ватный тампон с невидимыми подопытными на чашку и закройте крышку. Чашку поставьте и ежедневно следите за изменениями.

Чтобы подсчитать количество колоний культур в домашних условиях или лаборатории, достаточно поднести чашку Петри к источнику яркого света. Доступность, а также простота пользования данным инвентарем значительно упрощает процесс выращивания бактериальных колоний.
Штаммы для пищевой промышленности
Чтобы производство продуктов питания на основе молока было на высоком уровне, обеспечивая потребителям необходимые объемы йогуртов, кефира и других молочнокислых изделий, технологи выделяют бактерии, занимаются их селекционированием и изготавливают закваски.
Штаммы молочнокислых культур получают в лаборатории из молочной сыворотки с добавлением:
- кукурузного экстракта,
- стимуляторов роста,
- буферных солей.
Выращивание молочнокислых микроорганизмов, подразделяющихся на две группы – палочки и стрептококки – требует выдержки временных и температурных рамок.
Выращивание микроорганизмов для очистки сточных вод
Чтобы добиться максимальной эффективности при фильтрации сточных вод, используются определенные виды культур бактерий. Для владельцев септика это незаменимое вещество, позволяющее предотвратить распространение неприятного запаха, активировать механизм переработки органических залежей на дне.
Штаммы для септика представляют собой смесь из ферментов, живых культур, аминокислот. Используемая среда – специальный минеральный носитель. Данный вид бактерий для дачного септика склонен к анабиозу, то есть до момента попадания на дно ямы микроорганизмы находятся в «спящем» состоянии и активизируются только при прямом контакте с водой или органикой. Если в пределах септика недостаточное количество жидкости или постоянно преобладают низкие температуры, независимо от метода выращивания бактерии будут «работать» медленнее.
Культивирование различных видов бактерий (молочнокислых, для лекарств, для септика) производится специалистами. Препараты попадают к потребителю уже готовыми. Однако зная правила выращивания штаммов, необходимую для каждого класса культур питательную среду и имея под рукой чашку Петри (для молочнокислых бактерий в том числе), можно пробовать делать это дома. Шансы на получение хорошего результата высоки, главное – правильно стерилизовать посуду, а также исключить попадание инородных веществ, способных повлиять на чистоту эксперимента. Вырастить бактерии для септика сложнее, чем получить закваску молочнокислых культур.
Работаю врачом ветеринарной медицины. Увлекаюсь бальными танцами, спортом и йогой. В приоритет ставлю личностное развитие и освоение духовных практик. Любимые темы: ветеринария, биология, строительство, ремонт, путешествия. Табу: юриспруденция, политика, IT-технологии и компьютерные игры.
Источник
Культивирование бактерий: методы, принципы, этапы и условия
Микроорганизмы в окружающей нас природе находятся повсеместно: в почвах, водоемах, на поверхностях всевозможных предметов, ими населены люди и животные. Все это может служить источниками загрязнения микробами продуктов питания, лекарств, производственных линий. Культивирование бактерий необходимо для изучения их свойств, потребностей, особенностей. Это в свою очередь является важным этапом в разработке различных лекарственных препаратов, лабораторной диагностике заболеваний, расчете производственных реакторов и многого другого.
Общие понятия
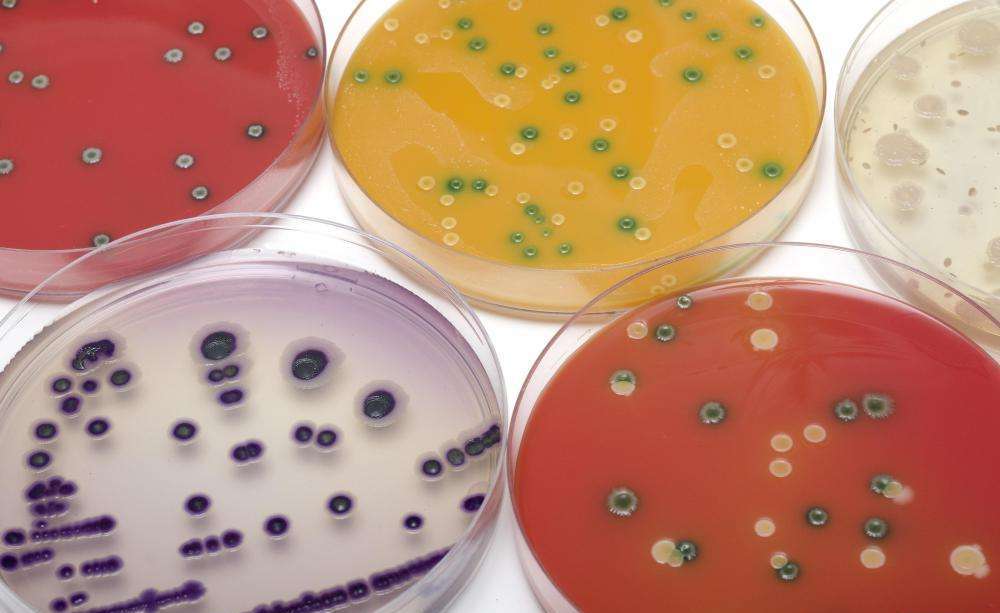
Под культивированием бактерий в микробиологии понимают выращивание микроорганизмов, осуществляемое в лабораторных условиях. В свою очередь микробы, которые выросли на подобранной питательной среде, называют культурой. Культуры могут быть смешанными, если они образованы разными видами микроорганизмов, и чистыми, если представлены только одним видом бактерий.
Если в питательную среду помещают только одну клетку, а получают в результате ее размножения группу особей, то эту совокупность микроорганизмов называют клоном. Когда клон развивается до такого уровня, что становится виден невооруженным глазом, такое скопление бактерий называют колонией.
Обычно культивирование бактерий, выделенных из различных источников, производят отдельно друг от друга. Каждую такую отдельно выращенную группу микробов называют штаммом. Так, если один вид стафиллококка выделен из трех источников (или разных порций одного и того же продукта, разных человек), говорят о трех штаммах этого вида стафилококка.
Факторы роста бактерий
К ним относят различные аминокислоты, липиды, пуриновые основания и другие соединения, необходимые для развития микроорганизмов. Некоторые микробы могут самостоятельно вырабатывать необходимые им вещества, а другим необходимо получать их в готовом виде. По потребности микроорганизмов в тех или иных ростовых факторах проводят идентификацию и дифференциацию бактерий. Также этот параметр важен для правильного изготовления питательной среды в целях проведения лабораторных и биотехнологических работ:
- Аминокислоты. Бактерии могут нуждаться в одной конкретной аминокислоте или какой-либо группе кислот. Так, клостридиям необходим лейцин и тирозин, стрептококкам — лейцин и аргинин. Микроорганизмы, которым для роста необходимо получение аминокислот извне, называют ауксотрофными.
- Пуриновые и пиримидиновые основания, а также их производные (аденин, гуанин и другие). Они являются важным фактором роста многих видов стрептококков.
- Витамины. Они входят в состав коферментов, требуемых бактериям. Так, никотиновая кислота, а также ее амид, входящие в состав НАД и НАДФ, нужна коринебактериям дифтерии, шигеллы. Тиамин, как составная часть пирофосфата, требуется золотистому стафилококку, пневмококку, бруцеллам. Пантотеновая кислота, входящая в кофермент КоА, требуется бациллам столбняка и отдельным видам стрептококка. Цитохромы, а значит, образующие их фолиевая кислота, гемы и биотин, необходимы микобактериям туберкулеза и гемофильным бактериям.
Требования к средам
Условия, предъявляемые к питательным средам для культивирования бактерий:
- Питательность. Они должны содержать вещества, причем находящиеся в легко усвояемом виде, необходимые микроорганизмам для питания и пополнения энергии. К ним относят органогены и минеральные вещества. Для некоторых микроорганизмов дополнительно необходимы витамины и аминокислоты, которые они не могут синтезировать.
- Оптимальный уровень рН. Он влияет на проницаемость клеточной оболочки и, соответственно, на возможность усвоения питательных веществ бактерией. Чаще всего значение водородного показателя должно быть на уровне 7,2–7,4. Многие микроорганизмы в ходе своей жизнедеятельности вырабатывают продукты с кислой или щелочной реакций, и для того, чтобы рН питательной среды не изменялся, она должна обладать буферностью.
- Изотоничность. Осмотическое давление в питательной среде для культивирования бактерий должно иметь те же значения, что и внутри микробных клеток. Обычно оно соответствует 0,5 % раствору NaCl.
- Стерильность. Связано это с тем, что появление посторонних бактерий исказит результаты изучения анализируемого штамма.
- Уровень влажности. Этот показатель наряду с консистенцией среды должен иметь оптимальные характеристики для конкретного вида бактерий.
- Окислительно-восстановительный потенциал (RH2). Он показывает соотношение веществ, которые отдают и которые принимают электроны, а также уровень насыщения кислородом питательной среды. Для аэробов и анаэробов условия культивирования бактерий несколько разнятся по данному показателю. Анаэробные микроорганизмы лучше всего размножаются при значениях RH2, не превышающих 5, а аэробные – не менее 10.
- Унифицированность. Важно, чтобы питательная среда содержала неизменные количества отдельных ее ингредиентов. Кроме того, предпочтительны прозрачные растворы, на которых легче отслеживать рост культуры или заметить ее загрязнение.
Виды питательных сред
На выбор той или иной среды для выращивания микроорганизмов влияет множество факторов, среди которых — особенности их питания и цели исследования. Основными признаками, положенными в основу классификации питательных сред, являются:
1. Компоненты. По исходным веществам, используемым для создания субстрата, различают:
- натуральные, которые готовятся из продуктов животного или растительного происхождения (например, мяса, молока, фруктов) и удобны для выращивания смешанных культур;
- полусинтетические, в которых дорогостоящие натуральные пищевые продукты заменены на непищевые (например, костную муку, сгустки крови), и которые оптимальны для культивирования бактерий отдельных видов или выделения из среды продуктов их жизнедеятельности;
- синтетические, которые готовятся из точных количеств химических соединений, имеют известный постоянный состав и легко воспроизводятся.
2. Консистенция (плотность). Различают среды:
Последние две готовят из специальных растворов или жидких веществ с добавлением агар-агара или желатина для создания необходимой плотности. Кроме того, плотной средой для роста бактерий является свернутая сыворотка крови, картофель, среды с силикагелем, каррагинан.
3. Состав. По данному признаку среды бывают:
- простые, список которых короток — это мясопептонный бульон (МПБ), бульон и агар Хоттин-гера, мясопептонный агар (МПА), питательный желатин и пептонная вода.
- сложные, приготовляемые из простых с добавлением крови, сыворотки, углеводов и другие веществ.
4. Назначение. Выделяют следующие питательные среды:
- основные служат для выращивания многих патогенных микробов (обычно простого состава);
- специальные применяют для выделения и культивирования бактерий, которые не растут на простых субстратах;
- элективные (они же избирательные) подходят для выделения конкретного вида бактерий и подавляют рост сопутствующих микробов (селективность создается путем прибавки к средам некоторых веществ, например антибиотиков или солей, или коррекцией рН);
- дифференциально-диагностические дают возможность отличить один вид бактерий от другого путем оценки ферментативной активности, например, среды;
- консервирующие нужны для первичного посева с последующей транспортировкой образцов, поскольку предотвращают отмирание микроорганизмов, а также подавляют рост других бактерий.
Приготовление питательных сред
Важнейшим этапом культивирования анаэробных бактерий является приготовление подходящей питательной среды. После того, как выбраны оптимальные параметры, переходят к следующим стадиям:
- взвешивание, путем отбора навески компонентов на аналитических весах;
- растворение, проводимое в подогретой до 70 °С дистиллированной воде, причем отдельно растворяют фосфаты, микро- и макросоли;
- кипячение, осуществляемое на водяной бане на протяжении двух минут;
- определение pH, выполняемое индикаторной бумагой или потенциометром;
- фильтрация, производимая через смоченный матерчатый или бумажный фильтры для жидких, а также расплавленных плотных сред, и через ватно-марлевый фильтр для агаровых;
- розлив, выполняемый на 3/4 емкости;
- стерилизация, зависящая от состава среды;
- контроль на стерильность осуществляется путем отстаивания в течение двух суток в термостате с последующим просмотром;
- химический контроль для установления рН и содержания необходимых элементов;
- биологический контроль путем пробного засева.
Стерилизация посуды и сред
Одним из основных принципов культивирования бактерий является стерильность. Рост и развитие посторонних микроорганизмов может повлиять на характеристики питательной среды путем изменения ее химического состава и рН. Стерилизация является главным условием выращивания чистых культур. На практике под этим термином подразумевают методы уничтожения абсолютно всех жизненных форм на поверхности и в объеме стерилизуемых объектов. Стерилизации подвергается посуда, применяемые инструменты, среды, а также другие предметы, используемые в ходе исследования.
Некоторые виды стерилизации:
- Прокаливание. Стерилизацию петель и игл для посева, предметных стекол, некоторого инструмента можно выполнять с помощью горелки или спиртовки.
- Кипячение. Годится для обработки шприцов, игл, пищевых продуктов, но не убивает споры бактерий.
- Сухожаровая стерилизация. Проводится в особом сушильном шкафу и подходит для обработки колб, пробирок и прочей лабораторной посуды.
- Стерилизация паром. Проводимый в автоклаве этот метод является высокоэффективным. Но он не годится для питательных сред, в состав которых входят белки или какие-либо другие соединения, разрушающиеся при высоких температурах. Более щадящей можно назвать тиндализацию. Она проводится в кипятильнике Коха и сочетает проращивание спор с их уничтожением.
- Пастеризация. Применяется для сред, меняющих свои свойства при кипячении (например, молоко, вино, пиво), способна избавить их от неспороносных микроорганизмов. Температура обработки составляет всего 50-60 °С на протяжении пятнадцати-тридцати минут. В некоторых случаях применяют холодную стерилизацию, осуществляемую с помощью фильтров или УФ-лучей.
Условия культивирования бактерий
Рост и развитие бактерий возможны лишь при определенных факторах и значениях каждого из них:
1. Температура. Различают три группы бактерий, отличающихся температурными предпочтениями:
- термофилы, или теплолюбивые микробы, растут при 45-90°С, а значит, не размножаются в организмах человека и животного;
- психрофилы, или холодолюбивые микроорганизмы, предпочитают температуру в интервале 5-15 °С и выращиваются в холодильных камерах;
- мезофилы, развиваются при температуре 25-37 °С, к ним относится основная масса бактерий.
2. Свет. Является особенностью культивирования бактерий-фототрофов, поскольку они осуществляют фотосинтетический процесс. Но для большинства микробов освещение не является обязательным условием. И даже наоборот, солнечный ультрафиолет может подавлять их развитие.
3. Вода. Всем микроорганизмам необходима вода в доступной (жидкой) форме. Вот почему в замороженных продуктах бактерии практически не развиваются.
4. Кислотность среды. Этот принцип культивирования бактерий уже был подробно разобран выше.
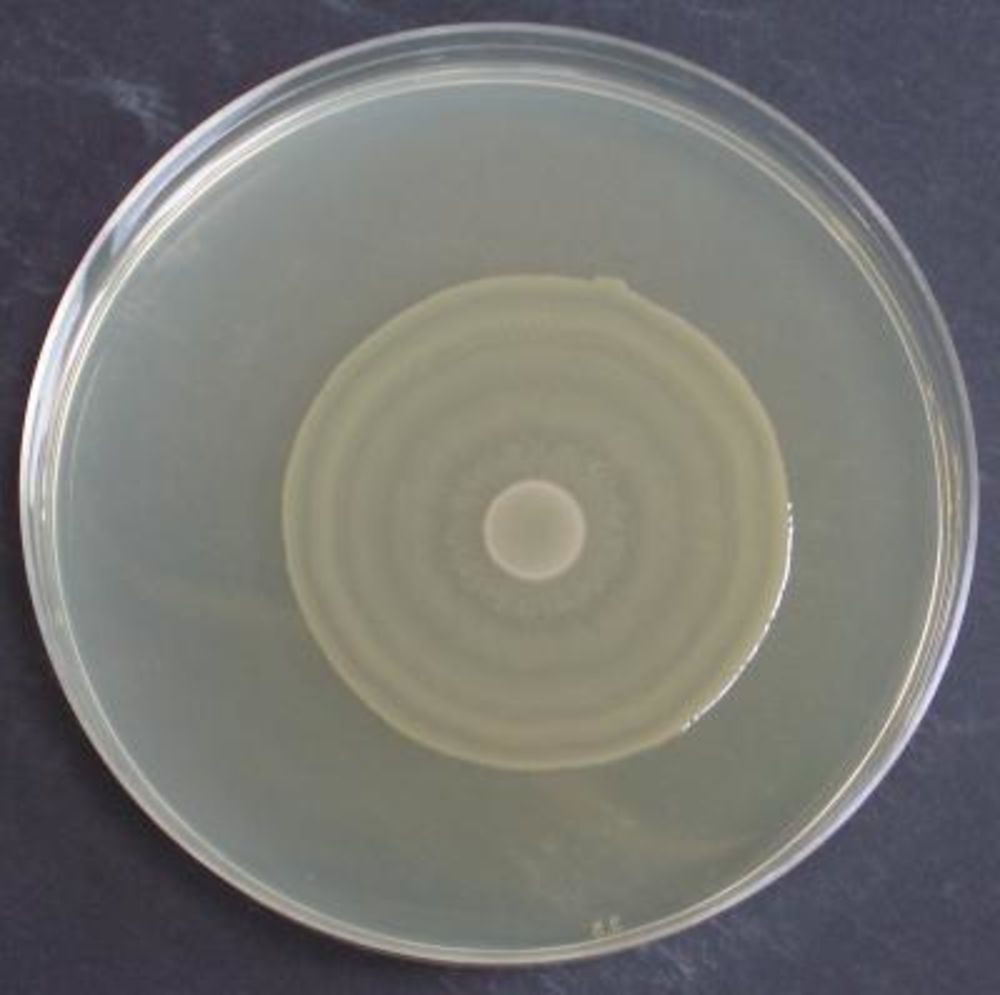
5. Аэрация. Кислород, как химический элемент, является составной частью воды и немалого количества соединений, применяемых для выращивания микроорганизмов. Газообразный кислород также может содержаться в воде и прочих жидкостях в растворенном виде. Существенная часть бактерий нуждается в постоянном поступлении молекул кислорода. Но ряду микроорганизмов он без надобности, или, хуже того, газообразный кислород токсичен для них, поскольку они не имеют каталазы и пероксидазы, разрушающих токсичные продуты дыхания. Поэтому важнейшим этапом культивирования анаэробных бактерий является удаление молекул О2 из питательной среды.
6. Культивирование микроорганизмов. Выращивание аэробных и анаэробных бактерий проводится в различных слоях среды и в разных режимах.
Выращивание аэробных микроорганизмов
Для культивирования аэробных бактерий требуется молекулярный кислород. Для получения чистых культур аэробов, которые можно успешно применять в медицине и пищевой промышленности, используются следующие методы:
- поверхностное выращивание на плотных средах или в жидких средах (их тонком слое), когда кислород поступает прямо из воздуха;
- глубинное культивирование в жидких средах, когда повышения количества растворенного в них кислорода добиваются путем постоянной аэрации.
Выращивание анаэробных микроорганизмов
Основным принципом культивирования бактерий этого типа является минимальный их контакт с кислородом воздуха. Обеспечить условия их роста гораздо сложнее, чем для аэробов. Для изоляции анаэробов от молекулярного О2 применяются следующие методы:
- Физические. Этот метод культивирования анаэробных бактерий сводится к их выращиванию в специальном вакуумном аппарате — микроанаэростате. Воздух в нем заменен на особую газовую смесь из азота с добавлением 10 % водорода и 5 % углекислого газа.
- Химические. К ним относятся: использование поглощающих агентов (например, Fe, Na2S2O4, CuCl) или восстанавливающих агентов (например, аскорбиновая кислота).
- Биологические. Сводится к совместному выращиванию аэробов и анаэробов в закрытой системе. Этот метод культивирования бактерий предполагает засевание одной половины чашки Петри каким-то из аэробных видов бактерий, а второй — изучаемым анаэробом. Развитие его начнется в тот момент, когда истратится весь кислород.
Для культивирования анаэробных бактерий подходят следующие способы посева:
- в поверхностном слое;
- в поверхностном слое с заливкой стерильным парафином;
- в толще плотной питательной среды;
- в глубинных слоях вязких сред.
Получение чистой культуры
Микробиологи в своей работе обычно имеют дело с образцами, заселенными множеством различных видов микробов. Однако для определения систематического положения микроорганизмов (семейство, род, вид), а также изучения их особенностей необходимо их изолировать и вырастить чистую культуру. Они имеют важнейшее значение во многих пищевых производствах, например, сыра, хлеба, кваса, вина и т. д. Культивирование молочнокислых бактерий позволяет получить важнейший компонент для производства кисломолочных продуктов, теста, какао, силоса и даже пластика.
Способ выделения чистой культуры в плотной среде основан на механическом отделении клеток микроорганизмов с последующим их изолированным выращиванием. Образец переносится в стерильный объем воды или физраствора (объемом 10—100 мл), а затем встряхивается на протяжении двух минут. Чтобы извлечь микроорганизмы, находящиеся в толще исследуемого материала (например, колбасы или сыра), сначала выполняют растирание кусочков образца стерильными инструментами с песком. Материал, прошедший предварительную подготовку, массой 1 г или объемом 1 мл разбавляют стерильной водой в 10, 100, 1000 и т. д. раз. Выбирают ту степень разведения, которая дает концентрацию клеток, соответствующую возможностям метода.
Последующее выращивание микроорганизмов заключается в подготовке питательной среды. Обычно выбирается плотная среда (МПА). Ее предварительно расплавляют и остужают до 45—50 °С, а уже потом разливают в несколько чашек Петри (три-пять штук), на дно которых помещены смывы с исследуемого вещества различных концентраций. Далее проводят перемешивание еще не застывшей питательной среды и внесенного в нее материала. Так добиваются фиксирования клеток в различных точках объема субстрата.
Далее чашки Петри помещают в термостат на 2 суток при 22 °С. За это время клетки размножаются до такой степени, что колония, образованная каждой из клеток, становится видна невооруженным глазом. Каждая из них является чистой культурой того вида бактерий, из клеток которого она выросла.
После этого с чашек Петри микроорганизмы пересевают в отдельные пробирки, наполненные питательной средой. Таким образом проводится выделение чистых культур из смешанного образца. Этот метод носит имя своего разработчика — Р. Коха. Также его принято называть чашечным методом, или истощающим посевом. После получения чистых культур различных видов бактерий выполняют установление их формы, обнаружение спор, семейства.
Все работы должны выполняться согласно принципам асептики. Чтобы избежать преждевременного развития микроорганизмов, исследование необходимо проводить сразу после отбора проб. Водопроводную воду анализируют после слива первых порций, поскольку в них могут находиться накопившиеся в трубах и кранах микробы. Микрофлора фруктов, ягод и овощей преимущественно размещена на поверхности (кожуре), поэтому выполняют смывы с нее. Для этого в стерильную емкость помещают плод и заливают его необходимым количеством воды. Затем их довольно энергично встряхивают и сливают воду в другую емкость. Посевы с матерчатых изделий также получают смывами, но предварительно из них вырезают кусочки заданного размера.
Источник