Mse-Online.Ru
Реакция почвы
Почва обладает определенной реакцией, которая проявляется при взаимодействии с водой или растворами солей. Реакция почвы может быть нейтральной, кислой или щелочной. Эти свойства почвы имеют чрезвычайно важное значение для роста и развития растений, так как каждый вид растений лучше всего развивается при определенной реакции почвы.
Кислотность почвы — одно из важных ее свойств, обусловленное определенной концентрацией водородных ионов. Источник кислотности почвы — органические кислоты, образующиеся при распаде растительных остатков и вымывающиеся в нижние горизонты. Среди этих кислот наиболее распространены перегнойные кислоты и прежде всего — креновые.
В зависимости от направления и развития почвообразовательного процесса в отдельных типах и разностях почв кислотность проявляется по-разному. Если в почвенном растворе имеются ионы кальция и противодействие повышению кислотности почвы высокое, вредное действие кислотности почвы уменьшается, а если раствор содержит ионы алюминия, железа и марганца, ее токсичность для растений и почвенных микроорганизмов увеличивается.
Высокая кислотность всегда отрицательно влияет на микробиологические процессы в почве и на развитие растений. Если реакция почвы очень кислая (подзолистые почвы), то в почвенном растворе кроме водорода находятся ионы алюминия, высокая концентрация которых также отрицательно влияет на развитие растений. Особенно чувствительны к кислой реакции клевер, пшеница, лен, свекла.
Кислая реакция почвы затрудняет усвоение растениями азота, кальция, магния и способствует поступлению в них алюминия и марганца. В растениях, которые растут на кислых почвах, задерживается превращение моносахаридов в дисахариды и другие сложные соединения, нарушаются процессы образования белков и обмена.
Различают актуальную, или активную, и потенциальную, или пассивную, кислотность почв.
Актуальная кислотность обусловливается наличием ионов водорода в почвенном растворе, а потенциальная — водородных ионов и ионов алюминия в почвенном поглощающем комплексе. Актуальную кислотность почвенного раствора обусловливают в основном растворимые органические кислоты, которые образуются в почве в результате биохимических процессов.
В ряде случаев отрицательное действие кислой реакции связано с подвижностью ионов алюминия, который токсичен для растений, особенно при низком рН.
Условным общим показателем кислотности почвы является кислотность почвенного раствора — рН, которая зависит от содержания в почве свободных кислот и обменных ионов водорода. Сельскохозяйственные растения лучше всего развиваются при рН от 5,5 до 7,5. Величина рН наиболее распространенных типов почв колеблется в пределах от 3 до 9, в зависимости от чего почвы делятся на такие группы: очень кислые — рН 3—4, кислые — рН 4—5, слабокислые — рН 5—6, нейтральные — рН 6—7, щелочные — рН 7—8, сильно щелочные — рН 8—9.
Почва с рН 6,5—7 практически нейтральна.
Потенциальную кислотность можно определить, если выделить из поглощающего комплекса поглощенные ионы водорода. В зависимости от того, какими солями определяют потенциальную кислотность, ее разделяют на обменную и гидролитическую.
Обменная кислотность обусловливается наличием в ППК водорода и алюминия, которые вытесняются из почвы под действием нейтральных солей. Обменную кислотность обозначают так же, как и активную, но с обязательным указанием, что это рН солевой вытяжки. Обменная кислотность сильно кислых почв равна 4,5, кислых — 4,6—5,5, слабокислых — 5,6—6, близких к нейтральным — 6,1—6,5, нейтральных — 7. Обменную кислотность можно также определять в миллиграмм — эквивалентах суммы водорода и алюминия на 100 г почвы.
Гидролитическая кислотность — это количество ионов водорода, которые вытесняются из почвы водным раствором солей слабых кислот и сильных щелочей. Обычно для этой цели применяют уксуснокислые соли — ацетат натрия или кальция.
Величина гидролитической кислотности в разных почвах бывает от 0,1 до 10 мг-экв и более на 100 г почвы. В обыкновенных черноземах гидролитической кислотности практически нет, реакция их нейтральная, тогда как в черноземах оподзоленных и серых лесных почвах она иногда достигает 3 мг-экв и более на 100 г почвы. Самая высокая гидролитическая кислотность в некоторых торфяных горизонтах болотных почв и их разностей. Обычно гидролитическая кислотность почвы больше, чем обменная. Она практически является общей кислотностью почвы, потому что при определении ее учитываются как активная, так и обменная формы.
Знание кислотности почвы имеет большое практическое значение для определения потребности почвы в известковании. Чаще всего пользуются данными гидролитической кислотности. Если она составляет 1—2 мг-экв, то нет потребности в известковании почв, а если почва имеет большую кислотность, то ее нужно обязательно известковать. Слабоподзолистые песчаные почвы известкуют даже при гидролитической кислотности менее 2 мг-экв на 100 г почвы.
При известковании почв кроме гидролитической кислотности учитывают степень насыщенности основаниями и актуальную кислотность. В известковании нуждаются все почвы с рН 8. Такая реакция неблагоприятная для большинства сельскохозяйственных культур.
Повышенная щелочность в почве не только вредна для развития растений, но и усиливает пептизацию коллоидов, вследствие чего резко ухудшаются физические свойства и водный режим почв.
В зависимости от содержания обменного натрия (в % к сумме поглощенных оснований) различают такие почвы: свыше 20 % — солонцы, 10—20 — солонцеватые, 5—10 — слабосолонцеватые, менее 5 % — несолонцеватые.
Почвы, в водном растворе которых есть растворимые соли натрия (в основном хлориды, сульфаты и карбонаты), называются солончаками. Обычно в составе таких почв есть также растворимые соли кальция и магния.
Источник
Понятие о кислотности и щелочности почвы
Характерным свойством почвы является ее реакция. Она определяется соотношением свободных ионов Н + и ОН — в почвенном растворе. Концентрация свободных ионов Н + выражается величиной РН, представляющей отрицательный логарифм концентрации ионов водорода. РН=7 характеризует нейтральную реакцию, РН 7 – щелочную.
Реакция почвенного раствора в различных почвах колеблется от РН 3,5 до 8-9 и выше. Наиболее кислую реакцию имеют болотные почвы верховых торфяников. Кислой реакцией почвенного раствора характеризуются подзолистые и дерново-подзолистые почвы, а также красноземы (РН 4-6). Черноземы имеют реакцию близкую к нейтральной. Наиболее щелочная реакция у солончаков, особенно содовых (РН-8-9 и выше).
Сельскохозяйственные растения предъявляют разные требования к реакции почвы. Наиболее благоприятная слабокислая и слабощелочная реакция. С реакцией почвенного раствора тесно связана жизнедеятельность почвенной микрофлоры. В кислой среде преобладает грибная микрофлора, в нейтральной или слабощелочной – бактериальная.
С реакцией почвенного раствора связаны процессы превращения компонентов минеральной и органической частей почв, растворение веществ, образование осадков, миграция и аккумуляция веществ в почвенном профиле. Кислая среда является следствием развития в почве кислотности, щелочная реакция – следствие щелочности почвы.
Кислотность почвы — способность почвы подкислять воду и растворы нейтральных солей. Различают актуальную (активная) и потенциальную (скрытая) кислотность.
Актуальная кислотность обусловлена концентрацией свободных ионов Н + и характеризует кислотность почвенного раствора. Потенциальная кислотность характерна для твердой фазы почвы. Между актуальной и потенциальной кислотностью в почве сохраняется подвижное равновесие
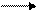
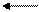
В большинстве почв актуальная кислотность обусловлена угольной кислотой и ее кислыми солями. Причиной потенциальной кислотности почвы являются обменные ионы Н + и Al +++ , т.к. при взаимодействии почвы с растворами солей эти катионы вытесняются в раствор и подкисляют его:
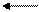
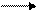
В зависимости от характера вытеснения Н+ и Al +++ различают 2 формы потенциальной кислотности: обменную и гидролитическую.
Обменная кислотность проявляется при взаимодействии почвы с растворами нейтральных солей, которые образуются при соединении сильных оснований с сильными кислотами (KCl, BaCl2, NaCl и т.п.)





ППК Аl +++ +4КСl ППК — Mg ++ + HCl + AlCl3



Гидролитическая кислотность обычно больше обменной. Она может рассматриваться как суммарная кислотность почвы, состоящая из актуальной и потенциальной кислотности. Кислотность выражается в миллиграмм – эквивалентах (м-экв) на 100г почвы.
Для устранения кислотности почв проводят известкование.При определении степени нуждаемости почвы в известковании следует учитывать насыщенность почвы основаниями (таблица 2), а также ее гранулометрический состав и набор культур в севообороте.
Таблица 2 -Деление почв по степени нуждаемости в известковании.
| Степень нуждаемости в известко-вании | РН – солевой вытяжки | Степень насыщен-ности почвы основа-ниями (%) |
| Сильная | До 4,5 | До 50 |
| Средняя | 4,6-5,0 | 50-70 |
| Слабая | 5,1-5,5 | >70 |
| Отсутствует | >5.5 | >80 |
Дозу извести чаще всего рассчитывают по величине гидролитической кислотности. Для этого гидролитическую кислотность умножают на коэффициент 1,5; полученная величина означает дозу (в т/га), которая должна быть внесена в почву для доведения ее реакции до слабокислой
Если для известкования используют не чистый СаСО3, то проводят перерасчет на содержание СаСО3 в применяемом известковом материале, а для MgСО3, СаО и Са(ОН)2 пользуются соответственно коэффициентами 0,84;0,56 и 0,74. Можно также пользоваться дозами извести, предлагаемыми справочниками по удобрениям для отдельных почвенных разновидностей с учетом рН солевой вытяжки. На легких почвах с низкой буферностью полную дозу извести, рассчитанную по гидролитической кислотности, обычно уменьшают на 25-30%. Для отдельных культур (лен, картофель) дозу извести можно снизить на 50%. При расчете доз известкования освоенных торфяников необходимо иметь в виду значительно меньший объемный вес их по сравнению с минеральными почвами
Щелочность почвы обуславливается повышенной концентрацией в почве ионов гидроксила ОН — . Различают актуальную и потенциальную щелочность. Актуальная щелочность обуславливается наличием в почве гидролитически щелочных солей (Na2CO3, NaHCO3, Ca(HCO3)2 и др.).
Потенциальная щелочность обнаруживается у почв, содержащих поглощенный Na.








Щелочность почвы устраняют гипсованием- традиционный способ ее нейтрализации. Дозу гипса для замены натрия на кальций в ППК вычисляют по формуле:
где, Х – доза гипса в т/га;
0,086 – миллиэквиваленты гипса, в г;
Na – содержание обменного натрия, в м-экв. на 100г почвы;
Н- мощность пахотного слоя, в см;
d – плотность массы мелиорируемого горизонта, г/см 3 .
С изменением реакции среды тесно связано важное свойство почв – их буферность, т.е. буферная способность.
Буферностью называют способность почвы противостоять изменению реакции почвенного раствора. Буферная способность различных почв неодинакова. Почвы, богатые карбонатами (черноземы, каштановые), хорошо противостоят смещению реакции в кислую сторону, тогда как почвы, обедненные основаниями (подзолы, красноземы), имеют высокую буферность при изменении реакции в щелочную сторону. Особенно низка буферность песчаных и супесчаных почв, а также содержащих мало органического вещества.
Благодаря этому замечательному свойству почвы (буферности) возможно применение хорошо растворимых солей в качестве минеральных удобрений, в противном случае в зонах вокруг гранул удобрений создавались бы губительные для растений концентрации солей.
Контрольные вопросы:
1 Происхождение, состав и основные свойства почвенных коллоидов?
2. Что такое ацидоиды, базоиды и амфолитоиды? Дайте им характеристику.
3. Охарактеризуйте процессы коагуляции и пептизации коллоидов?
4. Как Вы понимаете поглотительную способность почвы, от чего она зависит?
5.Назовите закономерности обменного поглощения катионов и анионов в почве.
6. Назовите состав обменных катионов в основных типах почв.
7. Какова роль поглотительной способности в плодородии почв?
8. Что называется емкостью поглощения почв, от чего она зависит, в каких пределах колеблется?
9. Каковы происхождение и виды почвенной кислотности и щелочности?
Источник