3 важнейших открытия в современной биологии (из научных журналов)
Осознание того, что животные могут исчезнуть
Если вы идете по пляжу и находите интересный камешек-окаменелость, вы сразу понимаете, что она может принадлежать давно вымершему виду. Мысль о том, что виды вымирают, настолько привычна нам, что трудно даже представить время, когда люди думали, что каждый отдельный тип существ все еще живет где бы то ни было. Люди верили, что Бог создал все — зачем бы ему стало создать что-то, что не сможет выжить?
Джордж Кювье был первым человеком, который задался таким вопросом. В 1796 году он написал статью о слонах, в которой описал африканские и азиатские разновидности. Также он упомянул о третьем типе слонов, известному науке только по его костям. Кювье отметил ключевые отличия в форме челюсти третьего слона и предположил, что этот вид должен быть совершенно отдельным. Ученый назвал его мастодонтом, но где же тогда живые особи?
По мнению Кювье, «все эти факты находятся в соответствии между собой и не противоречат ни одному другому сообщению, поэтому мне кажется возможным доказать существование мира, предшествующего нашему и разрушенному вследствие своего рода катастрофы». Он не остановился только на этой революционной идее. Кювье изучил окаменелости других древних животных — попутно введя термин «птеродактиль» — и выяснил, что некогда рептилии были доминирующим видом.
Первые клетки, выращенные вне тела
Если биолог хочет провести исследование внутренней работы животных клеток, гораздо проще, если эти клетки не являются частью животного в это время. В настоящее время биологи культивируют широкие полоски клеток в пробирке, что значительно облегчает задачу. Первым человеком, который попытался сохранить клетки живыми вне тела хозяина, был Вильгелм Ру, немецкий зоолог. В 1885 году он поместил часть эмбриона курицы в солевой раствор и сохранял его живым в течение нескольких дней.
В течение нескольких десятилетий продолжались исследования с использованием именно этого метода, но в 1907 кто-то вдруг решил вырастить новые клетки в растворе. Росс Харрисон взял ткани эмбриона лягушки и смог вырастить на их основе новые нервные волокна, которые затем сохранял живыми в течение месяца. Сегодня клеточные образцы можно поддерживать живыми почти бесконечно — ученые до сих пор экспериментируют с клеточными тканями женщины, которая умерла 50 лет назад.
Предположение, что у всей жизни есть общий предок
Кто первым предположил, что вся жизнь развилась из одной твари? Вы скажете: конечно же, Чарльз Дарвин. Да, Дарвин развил эту идею — в своем «Происхождении видов» он писал следующее: «Есть определенное величие в таком взгляде на такую жизнь, с ее различными проявлениями, которая изначально воплотилась в несколько форм или в одну». Тем не менее, хотя мы нисколько не преуменьшаем достижения Дарвина, идея общего предка была высказана десятилетиями ранее.
В 1740 году знаменитый француз Пьер Луи Моро де Мопертюи предположил, что «слепая судьба» произвела широкий круг индивидуумов, из которых выжили только самые способные. В 1790-х Иммануил Кант отмечал, что это могло бы относиться к изначальному предку жизни. Спустя пять лет Эразм Дарвин написал: «Было бы слишком смелым предположить, что все теплокровные животные произошли от одной живой нити?». Его внук Чарльз решил, что нет никакого «слишком» и предположил.
Источник
Бог из пробирки Эмбрион впервые вырастили вне утробы матери
Биологам впервые удалось вырастить в пробирке эмбрионы, достигшие стадии внедрения в стенку матки. До этого исследователи получали зародышевые тельца, которые не развивались дальше этого этапа. Теперь специалисты могут создавать удобные платформы для изучения развития животных и человека, а также решить проблемы разработки искусственной утробы. «Лента.ру» рассказывает о научной работе ученых из Кембриджского университета, опубликованной в журнале Science.
Развитие позвоночных животных от одной клетки до многоклеточного организма — процесс очень сложный. В нем несколько стадий, в результате которых формируются различные группы влияющих друг на друга клеток. Хотя во всех одна и та же ДНК, от их местоположения в зародыше зависит то, какие гены будут активными. Это, в свою очередь, определяет функции клеток в тканях формирующегося организма.
У млекопитающих развитие эмбриона может происходить как в теле матери, так и в яйце (у ехидны и утконоса). Зародыш возникает при оплодотворении ооцита (яйцеклетки). После этого происходит ее дробление — ряд делений с образованием все более мелких клеток (бластомеров). В результате формируется морула — шар, все внутреннее пространство которого заполнено 16-ю бластомерами.
За стадией морулы следует стадия бластоцисты. Бластомеры продолжают делиться, все более уплотняясь и образуя полую сферу. В ней запускается процесс дифференцировки клеток, и образуются два типа клеток: трофобласт, формирующий внешний слой бластоцисты, и эмбриобласт (внутренняя клеточная масса), находящийся внутри нее. Эмбриобласт создает компактное образование у одного из полюсов бластоцисты.
На стадии бластоцисты в клетках зародыша происходят процессы, которые устанавливают оси симметрии, а также регулируют экспрессию генов, что на следующих этапах приведет к формированию различных тканей. Эмбрион, который ранее напоминал сферу, становится асимметричным. Трофобласт дает начало экстраэмбриональным (внезародышевым) тканям, из которых затем образуются плацента, желточный мешок и амнион. Из эмбриобласта развиваются еще две группы клеток — эпибласт и гипобласт.
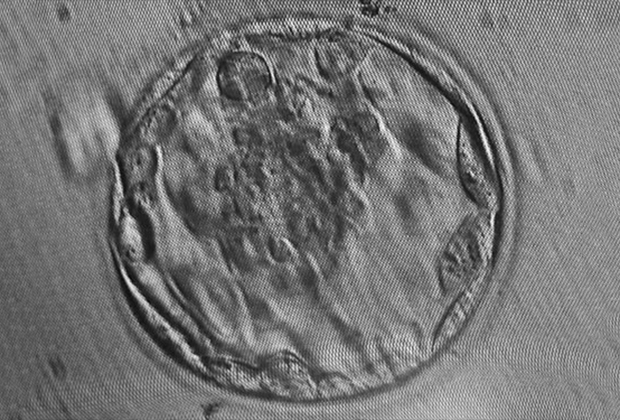
Бластоциста человека через 5 дней после оплодотворения
Из эпибласта в итоге формируется тело будущего организма. Однако это происходит только при том условии, что клетки данной группы взаимодействуют с внезародышевыми тканями. Гипобласт способствует образованию некоторых внезародышевых структур, в том числе примитивной энтодермы, которая дает потом висцеральную энтодерму, окружающую эпибласт и выполняющую регуляторные функции.
После того как бластоциста внедряется в слизистую матки в процессе беременности, структура зародыша меняется, постепенно усложняясь. Клетки эпибласта упорядочиваются, образуя форму розетки. Внутри возникает полость. Трофобласт в это время превращается во внезародышевую эктодерму (ExEc), в которой также есть полость. В конце концов обе полости соединяются. Кроме того, возникают мезодерма и первичные половые клетки, образуется зародышевый цилиндр.
Эпибласт состоит из эмбриональных стволовых клеток (ЭСК), способных дифференцироваться в три зародышевых листка: эктодерму, мезодерму и энтодерму. Клетки этих трех слоев — плюрипотентные, то есть могут превратиться во все типы клеток взрослого организма. Именно поэтому ЭСК используются для создания зародышеподобных структур — эмбриоидов. Они помогают понять механизмы развития плода, однако проблема в том, что в них не воспроизводятся процессы, протекающие in vivo (в живом организме) после внедрения в стенку матки.
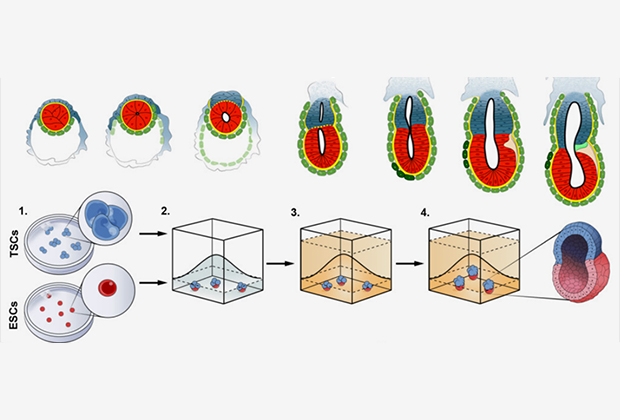
Развитие эмбриона мыши in vitro
Изображение: Magdalena Zernicka-Goetz, University of Cambridge
Ученые решили убедиться в том, что внезародышевые ткани обеспечивают дальнейшее развитие эмбриона, проведя соответствующие эксперименты in vitro (в пробирке). Взяли эмбриональные стволовые клетки и небольшие группы стволовых клеток из трофобласта (ТСК) — предшественников клеток внезародышевых органов. Из них были получены клеточные культуры, имитирующие взаимодействие эпибласта с трофобластом. Связи между клетками осуществлялись через трехмерные внеклеточные структуры из коллагенового матрикса «Матригель».
Матрикс заменял в культуре примитивную энтодерму, обеспечивая поляризацию клеток эпибласта и формирование полости. Оказалось, что в этих условиях ЭСК и ТСК образовывали форму, напоминающую зародышевый цилиндр и характерную для эмбрионов мышей после имплантации. Однако была не только внешняя схожесть. Тщательный анализ морфологии, размера, числа клеток и активности генов, характерных для определенных клеточных линий, показал, что в эмбрионах как in vivo, так и in vitro присутствовали отдельные структуры, полученные из стволовых клеток эпибласта и трофобласта.
Исследователи выделили несколько этапов развития зародыша в пробирке. Сначала наблюдается спонтанная самоорганизация, которая приводит к поляризации клеток и образованию полостей внутри эмбриональной и экстраэмбриональной частей зародыша. Затем полости объединяются в один большой эквивалент проамниотической полости. Потом две группы стволовых клеток взаимодействуют через сигнальный путь Nodal. Сигналами служат белки, участвующие в эмбриональной индукции; они направляют развитие отдельных частей зародыша — например, способствуют формированию нервной системы. Все завершается выделением костного морфогенетического белка, который индуцирует образование клеток, напоминающих первичные половые клетки.
Результаты исследования важны для решения проблемы создания искусственной утробы. В этом устройстве можно было бы вынашивать зародыши без участия живого существа. Однако до сих пор известны не все факторы, влияющие со стороны организма матери на дифференцировку клеток. Например, пока совершенно непонятна роль имплантации бластоцисты. Культивирование плодов in vitro в постимплантационный период невозможно без изучения того, что происходит с клетками зародышей в этот период. Новые эмбриоиды позволят проводить соответствующие исследования.
Источник
Выращивание клеток вне организма. I
Зачатков органов, выращенные вне организма (in vitro). В основе выращивания клеток и тканей лежит строгое соблюдение стерильности и использование специальных питательных сред, обеспечивающих поддержание жизнедеятельности культивируемых клеток и максимально сходных со средой, с которой клетки взаимодействуют в организме. Метод получения культуры клеток и тканей является одним из важнейших в экспериментальной биологии. Культуры клеток и тканей могут быть заморожены и сохраняться длительное время при температуре жидкого азота (-196°С). Основополагающий эксперимент по культивированию клеток животных провёл американский учёный Р. Гаррисон в 1907 году, поместив кусочек зачатка нервной системы зародыша лягушки в сгусток лимфы. Клетки зачатка оставались живыми несколько недель, из них вырастали нервные волокна. Со временем метод был усовершенствован А. Каррелем (Франция), М. Берроузом (США), А. А. Максимовым (Россия) и другими учёными, использовавшими в качестве питательной среды плазму крови и вытяжку из тканей зародыша. В дальнейшем успехи в получении культуры клеток и тканей были связаны с разработкой сред определённого химического состава для культивирования различных типов клеток. Обычно они содержат соли, аминокислоты, витамины, глюкозу, факторы роста, антибиотики, предупреждающие заражение культуры бактериями и микроскопическими грибами. Начало созданию метода культуры клеток и тканей у растений (на кусочке флоэмы моркови) положено Ф. Стюардом (США) в 1958.
Для культивирования клеток животных и человека могут быть использованы клетки разного происхождения: эпителиальные (печень, лёгкие, молочная железа, кожа, мочевой пузырь, почка), соединительнотканные (фибробласты), скелетные (кость и хрящи), мышечные (скелетные, сердечная и гладкие мышцы), нервной системы (глиальные клетки и нейроны), железистые клетки, секретирующие гормоны (надпочечники, гипофиз, клетки островков Лангерганса), меланоциты и различные типы опухолевых клеток. Выделяют 2 направления их культивирования: культура клеток и органная культура (культура органов и тканей). Для получения культуры клеток — генетически однородной быстро пролиферирующей популяции — кусочки ткани (обычно около 1 мм 3) извлекают из организма, обрабатывают соответствующими ферментами (для разрушения межклеточных контактов) и образующуюся суспензию помещают в питательную среду. Культуры, полученные из эмбриональных тканей, характеризуются лучшей выживаемостью и более активным ростом (из-за низкого уровня дифференцировки и наличия стволовых клеток-предшественников в эмбрионах) по сравнению с соответствующими тканями, взятыми из взрослого организма. Нормальные ткани дают начало культурам с ограниченным временем жизни (так называемый предел Хейфлика), тогда как культуры, полученные из опухолей, способны пролиферировать неограниченно долгое время. Однако даже в культуре нормальных клеток некоторые клетки спонтанно иммортализуются, то есть становятся бессмертными. Они выживают и дают начало клеточным линиям с неограниченным сроком жизни. Исходно клеточная линия может быть получена из популяции клеток или из отдельной клетки. В последнем случае линию называют клоновой, или клоном. При длительном культивировании под воздействием различных факторов свойства нормальных клеток изменяются, происходит трансформация, основными признаками которой являются нарушения морфологии клеток, изменение числа хромосом (анеуплоидия). При высокой степени трансформации введение таких клеток животному может вызывать образование опухоли. В органной культуре сохраняются структурная организация ткани, межклеточные взаимодействия, поддерживается гистологическая и биохимическая дифференцировка. Ткани, зависимые от гормонов, сохраняют чувствительность к ним и характерные ответы, железистые клетки продолжают секретировать специфические гормоны и т.д. Такие культуры выращивают в культуральном сосуде на плотиках (бумажных, миллипоровых) или на металлической сетке, плавающих на поверхности питательной среды.
У растений культивирование клеток основано, в общем, на тех же принципах, что и у животных. Различия же в способах культивирования определяются структурными и биологическими особенностями клеток растений. Большинство клеток растительных тканей обладают тотипотентностью: из одной такой клетки при определённых условиях может развиться полноценное растение. Для получения культуры растительных клеток используется кусочек любой ткани (например, каллуса) или органа (корня, стебля, листа), в котором присутствуют живые клетки. Его помещают на питательную среду, содержащую минеральные соли, витамины, углеводы и фитогормоны (чаще всего цитокины и ауксины). Растительные культуры поддерживают при температурах от 22 до 27°С, в темноте или при освещении.
Культуры клеток и тканей находят широкое применение в разных областях биологии и медицины. Культивирование соматических клеток (все клетки органов и тканей за исключением половых) вне организма определило возможность развития новых способов изучения генетики высших организмов с использованием, наряду с методами классической генетики, методов молекулярной биологии. Наибольшее развитие получила молекулярная генетика соматических клеток млекопитающих, что связано с появившейся возможностью постановки прямых экспериментов с клетками человека. Культуру клеток и тканей используют при решении таких общебиологических проблем, как выяснение механизмов экспрессии генов, раннего эмбрионального развития, дифференцировки и пролиферации, взаимодействия ядра и цитоплазмы, клеток со средой, адаптации к различным химическим и физическим воздействиям, старения, злокачественной трансформации и др., её применяют для диагностики и лечения наследственных заболеваний. В качестве тест-объектов клеточные культуры являются альтернативой использованию животных при испытании новых фармакологических средств. Они необходимы при получении трансгенных растений, клонального размножения. Важную роль клеточные культуры играют в биотехнологии при создании гибридов, производстве вакцин и биологически активных веществ.
Смотри также Клеточная инженерия.
Лит.: Методы культивирования клеток. Л., 1988; Культура животных клеток. Методы / Под редакцией Р. Фрешни. М., 1989; Биология культивируемых клеток и биотехнология растений. М., 1991; Freshney R. I. Culture of animal cells: а manual of basic technique. 5th ed. Hoboken, 2005.
О. П. Кисурина-Евгеньева.
В зависимости от техники приготовления культуры клеток классифицируют на:
— однослойные – клетки способны прикрепляться и размножаться на поверхности химически нейтрального стекла или пластика.
— суспензионные – клетки размножаются во всем объеме питательной среды при ее перемешивании.
— органные — цельные кусочки органов и тканей, сохраняющие исходную структуру вне организма (применение ограничено).
Наибольшее распространение имеют однослойные культуры клеток, которые можно разделить в зависимости от числа жизнеспособных генераций на
1) первичные (первично трипсинизированные),
2) полуперевиваемые (диплоидные)
По происхождению они классифицируются на эмбриональные, опухолевые и из взрослых организмов.
По морфогенезу — на фибробластные, эпителиальные и др.
Первичные культуры клеток — это клетки какой-либо ткани человека или животного, которые имеют способность расти в виде монослоя на пластмассовой или стеклянной поверхности, покрытой специальной питательной средой. Срок жизни таких культур ограничен. В каждом конкретном случае их получают из ткани после механического измельчения, обработки протеолитическими ферментами и стандартизации количества клеток. Первичные культуры, полученные из почек обезьян, почек эмбриона человека, амниона человека, куриных эмбрионов, широко используются для выделения и накопления вирусов, а также для производства вирусных вакцин.
Полуперевиваемые (или диплоидные ) культуры клеток — клетки одного типа, способные in vitro выдерживать до 50-100 пассажей, сохраняя при этом свой исходный диплоидный набор хромосом. Диплоидные штаммы фибробластов эмбриона человека используются как для диагностики вирусных инфекций, так и при производстве вирусных вакцин. Чаще всего используют культуры фибробластов эмбриона человека (WI-38, MRC-5, IMR-9), коров, свиней, овец и т.д.
Перевиваемые клеточные линии характеризуются потенциальным бессмертием и гетероплоидным кариотипом. Источником перевиваемых линий могут быть первичные клеточные культуры (например, СОЦ – сердце обезьяны цинамобус, ПЭС – почки эмбриона свиньи, ВНК-21 — из почек однодневных сирийских хомяков; ПМС — из почки морской свинки, Vero – почка зеленой обезьяны и др.) отдельные клетки которых обнаруживают тенденцию к бесконечному размножению in vitro. Совокупность изменений, приводящих к появлению из клеток таких особенностей, называют трансформацией, а клетки перевиваемых тканевых культур — трансформированными. Другим источником перевиваемых клеточных линий являются злокачественные новообразования . В этом случае трансформация клеток происходит in vivo. Наиболее часто в вирусологической практике применяются такие линии перевиваемых клеток: HeLa — получена из карциномы шейки матки; Нер-2 — из карциномы гортани; Детройт-6 — из метастаза рака лёгкого в костный мозг; RH — из почки человека, КВ – карцинома ротовой полости, RD – рабдомиосаркома человека.
Культуры органов – представляют собой приготовленные в стерильных условиях срезы органов животных, которые на протяжении определенного срока (дни, недели) сохраняют свою жизнедеятельность в особенных условиях культивирования
Клеточные культуры — это генетически однородные популяции клеток, растущих в постоянных условиях окружающей среды. Это могут быть штаммы нормальных клеток человека, животных, растений или тканей злокачественных опухолей.
Условия культивирования
Клетки обычно помещают в стеклянные сосуды, отсюда и исследования получили название изучение in vitro (от лат. In — в, vitro — стекло), хотя теперь чаще культуры выращивают в пластмассовых сосудах. Выделенные из тканей клетки инкубируют при температуре 38 ° C 39 ° C (для клеток животного и человеческого организмов) и при 22 ° C 28 ° C (для растительных клеток) в питательной среде соответствующего состава. Клетки тогда растут в виде суспензии или монослоя. Суспензионная культура — это выращивание отдельных клеток или небольших их групп во взвешенном состоянии в жидкой питательной среде с использованием аппаратуры, обеспечивающей их аэрацию и перемешивание. Характерной особенностью суспензионных культур является их морфологическая и биохимическая гетерогенность. Клеточная популяция содержит клетки, которые отличаются по размеру и форме.
Применение
Применение в цитологии
В цитологии данный метод удобен тем, что клетки в культуре легко доступны для различных биохимических манипуляций. При работе с ними радиоактивные вещества, яды, гормоны и др. могут быть введены в нужной концентрации в течение требуемого времени. Количество этих веществ может быть на порядок меньше, чем при эксперименте на животных. Исчезает угроза того, что вещество будет Метаболизированный печенью, экскретироваться почками или отложится в мышцах. Это обеспечивает получение реальных значений скорости действия вещества на клетку или ее усвоения клеткой.
Для исследования живых растительных клеток используют культуру изолированных протопластов. Изолированные протопласты можно определить как «голые» клетки растений, поскольку клеточная стенка удаляется механическим или ферментативным способом. Система изолированных протопластов дает возможность вести селекцию на клеточном уровне, работать в малом объеме с большим количеством индивидуальных клеток, получать новые формы растений путем прямого переноса генов, получать соматические гибриды между удаленными в систематическом отношении видами. Поскольку в изолированных протопластах сразу начинается регенерация клеточной оболочки, то они являются удобным объектом для изучения формирования целлюлозных микрофибрилл.
Применение в вирусологии
В вирусологии культуры клеток используются очень широко, поскольку с ними сравнительно легко работать в лаборатории, в отличие от других методов — выращивание вирусов на куриных эмбрионах или в организме живых животных. Кроме того, на монослое клеточной культуры можно хорошо изучить цитопатическое действие вирусов, по образованию внутри- клеточных включений, бляшек, в реакциях гемадсорбции и гемагглютинации и по цветовой пробоя. При работе с культурами клеток существенные результаты могут быть получены при работе с небольшим количеством культур. Эксперименты, которые требуют для подтверждения того или иного факта сотни или тысячи лабораторных животных могут быть с равным статистической достоверностью поставлены на таком же количестве культур клеток. Таким образом при лаборатории не надо держать виварий и отсутствуют этические аспекты обращения с больными животными.
Также изучается трансформация клеток вирусами, механизм которой подобен механизму возникновения злокачественных опухолей.
Применение в фармакологии
Культуры клеток широко применяются для тестирования действия веществ, которые могут быть использованы в качестве лекарственных препаратов. Несмотря на то, что результаты, полученные на культурах клеток нельзя экстраполировать на весь организм, не вызывает сомнения, что если то или иное вещество нарушает деятельность клеток из нескольких разных линиях культур, то необходимо ожидать негативного эффекта и при введении этого вещества в организм.
Применение в биотехнологии
Специфические культуры клеток является ценным источником гормонов и других биологически активных веществ. Уже сейчас они применяются для производства противовирусного белка интерферона.
Применение в генетике
В генетике способность клеток к росту в культуре используется в следующих направлениях:
- Клонирование
- Хранение клеток
- Получение мутантных клеток и работа с ними
Типы культур клеток
1. Первично-трипсинизовани — получают из измельченных тканей человека и животных путем их обработки трипсином или другими ферментами. Выдерживают лишь 5-10 делений (пассажей).
2. перевиваемых — клетки, которые приобрели способность к безграничному размножению, поскольку являются производными опухолей человека и животных.
3. Напивперещеплювани (диплоидные) — могут выдерживать до 100 пассажей, сохраняя при этом исходный диплоидный набор хромосом.
Наиболее распространенные линии клеток
| Линия клеток | Расшифровка сокращения | Организм | Ткань | Морфология | Примечания и ссылки |
|---|---|---|---|---|---|
| 293-T | человек | почка (эмбриональная) | Производная от HEK-293 ECACC | ||
| 3T3 cells | «3-day transfer, inoculum 3 x 105 cells» | мышь | эмбриональные фибробласты | Известна также как NIH 3T3 ECACC | |
| 721 | человек | меланома | |||
| 9L | крыса | глиобластома | |||
| A2780 | человек | яичник | рак яичника | ECACC | |
| A2780ADR | человек | яичник | производное A2780 с резистентностью к адриамицин | ECACC | |
| A2780cis | человек | яичник | производное A2780 с резистентностью к цисплатина | ECACC | |
| A172 | человек | глиобластома | злокачественная глиома | ECACC | |
| A431 | человек | кожаный эпителий | плоскоклеточная карцинома | ECACCCell Line Data Base | |
| A-549 | человек | карцинома легких | эпителий | DSMZECACC | |
| B35 | крыса | нейробластома | ATCC | ||
| BCP-1 | человек | периферические лейкоциты | HIV + лимфома | ATCC | |
| BEAS-2B | bronchial epithelium + adenovirus 12-SV40 virus hybrid (Ad12SV40) | человек | легкие | эпителий | ATCC |
| bEnd.3 | brain endothelial | мышь | кора головного мозга | эндотелий | ATCC |
| BHK-21 | «Baby Hamster Kidney» | хомяк | почка | фибробласты | ECACCOlympus |
| BR 293 | человек | молочная железа | рак | ||
| BxPC3 | Biopsy xenograph of pancreatic carcinoma line 3 | человек | панкреатическая аденокарцинома | эпителий | ATCC |
| C3H-10T1 / 2 | мышь | эмбриональные мезенхимальные клетки | ECACC | ||
| C6 / 36 | комар | ткани личинки | ECACC | ||
| CHO | Chinese hamster ovary | Cricetulus griseus | яичник | эпителий | ECACCICLC |
| COR-L23 | человек | легкие | ECACC | ||
| COR-L23 / CPR | человек | легкие | ECACC | ||
| COR-L23 / 5010 | человек | легкие | ECACC | ||
| COR-L23 / R23 | человек | легкие | эпителий | ECACC | |
| COS-7 | Cercopithecus aethiops, origin-defective SV-40 | обезьяна Cercopithecus aethiops | почка | фибробласты | ECACCATCC |
| CML T1 | Chronic Myelod Leukaemia T-lymphocyte 1 | человек | хроническая миелоидна лейкемия | T-клеточная лейкемия | Blood |
| CMT | canine mammary tumor | собака | молочная железа | эпителий | |
| D17 | собака | остеосаркома | ECACC | ||
| DH82 | собака | гистиоцитоз | моноциты / макрофаги | ECACC | |
| DU145 | человек | карцинома | простата | ||
| DuCaP | Dura mater Cancer of the Prostate | человек | эпителий | 11317521 | |
| EL4 | мышь | T-клеточная лейкемия | ECACC | ||
| EMT6 / AR1 | мышь | молочная железа | эпителий | ECACC | |
| EMT6 / AR10.0 | мышь | молочная железа | эпителий | ECACC | |
| FM3 | человек | метастазы в лимфатический узел | меланома | ||
| H1299 | человек | легкие | рак | ||
| H69 | человек | легкие | ECACC | ||
| HB54 | Гибридома | Гибридома | секретирует L243 mAb (против HLA-DR) | Human Immunology | |
| HB55 | Гибридома | Гибридома | секретирует MA2.1 mAb (против HLA-A2 и HLA-B17) | Journal of Immunology | |
| HCA2 | человек | фибробласты | Journal of General Virology | ||
| HEK-293 | human embryonic kidney | человек | почка (эмбриональная) | эпителий | ATCC |
| HeLa | Henrietta Lacks | человек | рак шейки матки | эпителий | DSMZECACC |
| Hepa1c1c7 | clone 7 of clone 1 hepatoma line 1 | мышь | гепатома | эпителий | ECACC |
| HL-60 | human leukemia | человек | миелобласты | клетки крови | ECACCDSMZ |
| HMEC | human mammary epithelial cell | человек | эпителий | ECACC | |
| HT-29 | человек | эпителий толстого кишечника | аденокарцинома | ECACC |
Cell Line Data Base