Выращивание кристаллов как бизнес
Как вырастить кристаллы в домашних условиях и на этом заработать? Как заработать на этом интересном бизнесе, мы расскажем чуть позже в нашей статье. Сначала мы коснемся вопроса выращивания кристаллов и, что для этого нужно знать.
Как вырастить кристалл?
Что такое кристалл? И всем сразу же представился красивый многогранник, весь переливающийся и сверкающий. Выращивать кристаллы в домашних условиях можно двумя способами: охлаждением раствора и выпариванием воды. Метод охлаждения раствора заключается в том, что при охлаждении растворение солей в растворе замедляется и они выпадают в осадок. Если раствор охлаждается быстро, то получается множество мелких кристаллов, если медленно, то несколько крупных. Второй способ – постепенное удаление воды из насыщенного раствора путем простого испарения жидкости.
Выращивание кристаллов достаточно интересный процесс. В интернете описаны случаи, когда энтузиасты выращивали кристаллы такого размера, что поднять или сдвинуть его приглашали своих друзей. При работе с выращиванием кристаллов следует помнить о собственной безопасности и не пренебрегать некоторыми правилами:
Нельзя для опытов использовать неизвестные реактивы;
Нельзя во время опыта одновременно принимать пищу;
Нельзя реактивы для выращивания кристаллов держать в открытом и доступном месте, особенно если у вас маленькие дети и животные;
Желательно во время опыта использовать резиновые перчатки, при попадании раствора солей, кислоты на кожу или в глаза следует промыть все проточной водой, при необходимости обратиться к врачу.
Такой инструктаж поможет вам быть несколько внимательнее к своему здоровью и здоровью членов вашей семьи. Также для выращивания кристаллов вам понадобится терпение, место, где будут стоять растворы (желательно подальше от батареи) и желание сделать нечто такое, от чего все ахнут.
Технология выращивания кристалла
А теперь посмотрим, что же мы сможем вырастить? Начнем с простого, с сахара.
Как вырастить кристалл из сахара.
Такие кристаллы часто подаются вместе с дорогими сортами чая в кафе и ресторанах. Выглядит это просто, сахарные кристаллы, с различными вкусами и цветовой палитры на палочке. Стоимость таких палочек от 100 рублей, в зависимости от размера. Подают их для размешивания чая, очень красиво. Выращивать такие кристаллы будет интересно и с детьми дома, ведь после того как кристаллы подрастут их можно рассасывать как леденец на палочке.
Для 5 кристаллических сахарных палочек понадобится:
Два стакана воды;
Пять стаканов сахара;
Пять деревянных палочек (можно использовать китайские палочки или зубочистки);
Пищевой краситель для цвета;
Берем четверть стакана воды, две столовые ложки сахарного песка и делаем сироп, путем нагревания на огне. Возьмите палочку, обмакните в сироп и обваляйте в сахарном песке. Пусть песчинки сахара хорошо прилипнут, оставьте палочку на ночь. С утра берем кастрюлю, выливаем туда два стакана воды и два с половиной стакана сахара и ставим все это на плиту. Когда весь сахар растворился, то высыпаем остатки сахара (2,5 стакана) и перемешиваем. И все это варится на небольшом огне до полного растворения, после оставляем его на 20 минут для остывания. В период варки можно добавить пищевой краситель. Далее сироп разливается по стаканам и в них опускаются сахарные палочки, крепим их прищепками для белья, чтобы они не касались стенок стакана и его дна. Сверху стаканы закрываем пленкой, чтобы не попала пыль. Через семь дней можем увидеть красивые сахарные кристаллические палочки. Очень вкусно!
Кристаллы из хлорида натрия или поваренной соли.
Это второй ингредиент после сахара, который есть на каждой кухне. Единственное, не берите соль “Экстра” или йодированную соль, напрасно потратите время. Кристаллы из этой соли не получаются. Растворять соль можно при комнатной температуре, можно для ускорения растворения немного нагреть раствор, но не кипятите, обязательно профильтруйте его. Для придания раствору цвета также можно использовать пищевой краситель, акварельные краски. Гуашь использовать нельзя, рост кристаллов остановится.
Итак, берем стакан воды, растворяем в ней соль малыми порциями до тех пор, пока растворение не прекратится. Перелить раствор в стеклянную банку и оставить на сутки. Через сутки, на дне, вы заметите маленькие кристаллики, выберите один из них пинцетом и привяжите на шелковую нитку. Так у вас получилась так называемая “затравка” для выращивания кристалла.
Далее процедите раствор еще раз и уберите все маленькие кристаллы со дна. Опустите “затравку” в соляной раствор и начинаем наблюдать за ростом нашего кристалла. В среднем, понадобится от двух до трех недель для выращивания небольшого кристалла. Кстати, “затравкой” может выступить также любой предмет, покрытый застывшими крупинками соли.
Кристаллы из медного купороса.
Вот из этого химического реактива получаются отменные кристаллы. Сульфат меди или медный купорос можно купить в любом магазине садоводства. Берем 70-100 грамм медного купороса (на первый раз хватит), стеклянную банку, теплую воду. Засыпаем в банку купорос и начинаем потихоньку лить воду, до тех пор, пока наш ингредиент не перестанет растворяться. Процеживаем раствор от всяких примесей и ставим на окно. Через сутки на дне выпадут несколько кристаллов, берем самые крупные, а раствор снова фильтруем.
Кристалл привязали на нитку и подвесили, главное, чтобы не касался стенок и дна банки. Можно кристаллик положить на дно и переворачивать первое время и потом уже его привязать. В результате вырастают голубовато-синие кристаллы, форма – параллелограмм.
Кристаллы из поваренной соли и медного купороса очень хрупкие. После того, как вы достанете их из раствора, обсушите полотенцем, покройте их бесцветным лаком. После этого их свободно можно брать в руки и использовать для сувениров и поделок.
Из чего еще можно делать кристаллы?
Например, хлорид кальция. Это всем известный химический препарат также продается в магазине для садоводов. Кристаллы имеют форму параллелепипеда, также можно добавить краситель. Следующим ингредиентом для выращивания кристаллов является железный купорос. Он также встречается в магазинах для садоводства. С добавкой серной кислоты, меняя ее концентрацию, кристаллы из железного купороса можно получать различного цвета и формы.
Еще можно для изготовления кристаллов использовать никелевый купорос, углекислую медь, сульфат алюминия-аммония, сульфат алюминия-калия, сульфат хрома-калия, сульфат железа-аммония, сульфат марганца (производить реакцию только при наличии промышленной вытяжки или на улице), сульфат цинка, сульфат натрия, иодид натрия. Почти все эти кристаллы быстро выветриваются и превращаются в порошок, поэтому для поделок не очень годятся.
А вот кристаллы из дигидрофосфата аммония совсем другое дело. Они очень похожи на горный хрусталь и если их покрыть лаком, то долгое время будут радовать глаз. Сам дигидрофосфат продается в магазине для удобрений и стоит совсем не дорого.
Еще очень интересной формы вырастают кристаллы из сульфата калия. По форме напоминают бриллиант крупной огранки. Сульфат калия также продается в магазине для садоводов, называется калий сернокислый. Лаком кристалл можно не покрывать, хранится хорошо.
Очень красивые кристаллы получаются из красной кровяной соли и серы. Не плохие кристаллы получаются из лимонной кислоты, правда, долго не хранятся.
Ну вот, наверное, и весь перечень веществ, который известен нам для изготовления кристаллов.
Что можно делать из выращенных кристаллов. Как можно заработать на выращивании кристаллов.
Вот вопрос вопросов для чего и писалась эта статья. Первое, что приходит на ум – это набор юного химика. Не просто набор, а набор с приложенной на диске подробной инструкции по выращиванию кристаллов. Главное в этом деле – не завышайте цену. Так как многие ингредиенты продаются в магазинах для садоводов и стоят не большие деньги.
Второе, это такие наборы для взрослых. Называются “банка желаний”, выращиваете кристаллики и загадываете желание. Вырастет, значит, сбудется, вырастет маленьким, значит не так, как хотели. Ну а не вырастет совсем, то и ответ сразу известен.
Третье. Сахарные палочки для владельцев кафе и ресторанов. Они будут приятной неожиданностью для клиентов и разнообразят досуг детей.
Четвертое. Это изготовление различных сувениров, при выращивании кристаллов можно использовать различные бусинки, колечки. Склеивать кристаллы друг с другом, особенно красиво будет, если цвета кристаллов будут немного разных оттенков. Можно соединять их с полудрагоценными камнями, украшать различными изделиями из холодного фарфора и т.д.
Ну и наконец, пятое. Это выращивание больших кристаллов для подарков на заказ.
Источник
Выращивание кристаллов хлорида калия
Уважаемые посетители сайта, если Вы используете информацию или фотографии данного сайта, то обязательно указывайте ссылку на данный ресурс.
Выращивание кристаллов по истине увлекательное занятие и, пожалуй, самое простое, доступное и недорогое для большинства начинающих химиков, максимально безопасное с точки зрения ТБ, что немаловажно для тех, кто проводит эксперименты дома. Тщательная подготовка и выполнение оттачивают навыки в умении аккуратно обращаться с веществами и правильно организовывать план своей работы. Советская и современная литература по демонстрационному эксперименту зачастую охватывает этот раздел, но авторы, как правило, не всегда указывают на детали. Ниже я излагаю свою методику по выращиванию кристаллов, которой пользуюсь с 1997 года. Отнесёмся к данному опыту, как к любому химическому эксперименту, в котором также существует своя предварительная подготовка, стадии выполнения.
Рост кристаллов я бы разделил на пункты:
1. Естественный (образование кристаллов в природе);
2.1. для научно-технических целей;
2.2. на занятиях экспериментальных, практических, внеклассных работ;
2.3. случайный рост кристаллов ( рис. 1) – результат был достигнут непреднамеренно, опыт прошёл без контроля экспериментатора, имели место неучтённые факторы или условия, имели место дополнительные химические и (или) физические процессы (пример: испарение растворителя через треснувшую пробку, пролонгированное окисление вещества в растворе способствовало кристаллизации другого и др.);
Рис. 1. Примеры, иллюстрирующие случайный рост кристаллов:
( а,б,в) треснутая крышка способствовала постепенному испарению воды, поскольку вещество оказалось не очень гигроскопичным, оно выкристаллизовалось (это могут быть и KI , Pb ( NO 3)2 и др.)
( г) окисление бензальдегида кислородом воздуха со временем дало бензойную кислоту, которая постепенно выкристаллизовалась из него в виде бесцветных игл:
А следующая фотография иллюстрирует пример, так называемой «промышленной забывчивости». Так получилось что в 20 кг (!) бочке плотно слежалась соль Мора ( NH 4)2 SO 4∙ FeSO 4 (не путать с квасцами, здесь железо двухвалентное) и чтобы хоть как получить из неё раствор вещество так и залили водой. Про соль вспомнили уже спустя длительное время. Друза этих кристаллов была сфотографирована мною на сиденье обычного офисного стула и превышает размер ладони. Вот так может пойти процесс получения кристалликов, если обычный лабораторный стаканчик вырастет в 10-15 раз.


Растворимость веществ в любых растворителях можно отнести к физическим явлениям со следующей позиции: происходит разрушение кристаллической решётки, теплота при этом поглощается из окружающей среды (иногда так сильно, что это можно ощутить тактильно, например, при растворении нитрата NH 4 NO 3 или роданида аммония NH 4 SCN , иодида калия KI , красной кровяной соли K 3[ Fe ( CN )6] и др.). Это растворение называется эндотермическим. Другой физический процесс – диффузия. Возьмите несколько кристалликов марганцовки и киньте в высокий цилиндр. Вы увидите, как вокруг них появятся розовые завихрения. Диффузию можно наблюдать и на бесцветных веществах: влейте тонкой струйкой в высокий стакан с насыщенным раствором поваренной соли дистиллированную воду – обратите внимание, как происходит самоперемешивание раствора. Подобным перемешивание происходит, когда пресная вода рек попадает в солёное море или океан, так рождаются течения.
Однако зачастую мы наблюдаем и химические процессы: гидролиз и сольватацию.
Гидролиз – (греч. «гидрос» — вода, «лизис» — разложение) разрушение веществ под действием молекул воды, наглядный пример – в пробирку с 10 мл воды внесите каплю концентрированного раствора соли серебра, свинца ( II ), олова ( II ) или ( IV ), висмута ( III ), сурьмы ( III ) или ( V ), будете наблюдать помутнение раствора ( рис. 2):
SnCl 2 + H 2 O ⇄ Sn ( OH ) Cl ↓ + HCl
Кстати, как видно, уравнение гидролиза иллюстрирует причину изменения окраски индикаторов в растворах данных солей подобно в кислотах. Для многих веществ, образованных сильной кислотой и слабым основанием, гидролиз обратим. Для его предотвращения можно добавить кислоту с соответствующим соли кислотным остатком. Несмотря на противоречие (химики поймут), увеличение концентрации исходного вещества в какой-то момент подавит гидролиз, муть исчезнет и раствор станет насыщенным и бесцветным.
В водных растворах многие вещества образуют так называемые «аквакомплексы». К примеру, сульфат меди ( II ) CuSO 4 – белый порошок, а его кристаллогидрат – пентагидрат сульфата меди ( II ) или медный купорос CuSO 4·5 H 2 O – голубого цвета, а разбавленные растворы солей меди ( II )– синие или голубоватые (возьмите тот же зелёный дигидрат хлорида меди ( II ) CuCl 2 ∙2 H 2 O и разбавьте посильнее водой). Так вот это всё образование аквакомплексов, и тот же купорос можно записать: [ Cu ( H 2 O )5] SO 4. Другой пример – растворение серной кислоты в воде, вспомните, сколько теплоты выделяется при этом процессе:
При растворении таких веществ (обезвоженные кристаллогидраты, щёлочи, концентрированные кислоты), наблюдается выделение теплоты – экзотермическое растворение. Вот таблица некоторых кристаллогидратов и их безводных солей:
Таблица: «Безводные соли и кристаллогидраты»
Цвет безводной соли
пентагидрат c ульфата меди ( II )
хлорид кобальта (II)
гептагидрат хлорида кобальта ( II )
хлорид никеля (II)
гептагидрат хлорида никеля ( II )
гептагидрат хлорида меди ( II )
гептагидрат c ульфата железа ( II )
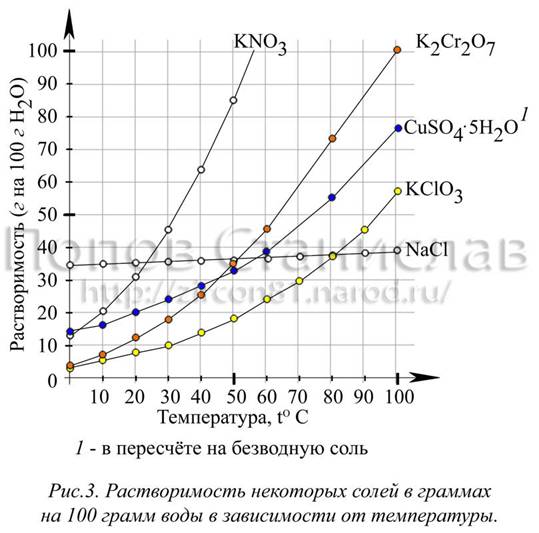
На графике ( рис. 3) изображена растворимость некоторых солей в воде. Как показывает практика, наиболее распространёнными веществами для выращивания кристаллов являются: хлорид натрия NaCl , медный купорос CuSO 4·5 H 2 O , квасцы (алюмокалиевые KAl ( SO 4)2·12 H 2 O , хромокалиевые KCr ( SO 4)2·12 H 2 O и др.). Менее распространены, но также используемы: бихромат K 2 Cr 2 O 7 и хромат K 2 CrO 4 калия, сульфат железа ( II ) FeSO 4·7 H 2 O , соль Мора ( NH 4)2 Fe ( SO 4)2∙6 H 2 O , перхлорат натрия NaClO 4, красная кровяная K 3[ Fe ( CN )6] и жёлтая кровяная K 4[ Fe ( CN )6] соли, многие соединения тяжелых металлов, органические соединения (гидрофталат калия KHC 8 O 4 H 4, сахар C 12 H 22 O 11, салициловая кислота C 7 H 6 O 3, тиомочевина CS ( NH 2)2, сегнетова соль KNaC 4 H 4 O 6·4 H 2 O (натрий-калий винно-кислый или тартрат натрия-калия) и другие различные соли органических кислот).
Границы в этом перечне нет и экспериментировать можно с любыми другими соединениями и растворителем, заменяя воду на легколетучие спирт и эфир. Но, поскольку, самым распространённым растворителем является вода, в экспериментах будет использоваться она, и разговор будет идти, в основном, о соединениях в ней растворимых.
Как правило, при выборе материала важны следующие факты :
– вещество не должно быть токсичным. Забавно узнать: какие кристаллы, к примеру, даёт сульфид натрия Na 2 S или цианид калия KCN . Но данные вещества легко окисляются кислородом воздуха и гидролизуются влагой, в результате выделяются токсичные вещества, которые могут привести к отравлению и даже смерти;
– вещество должно быть стабильным. Не должно заметно или необратимо гидролизоваться. Должно быть, стабильно к повышению температуры, так как многие вещества могут разрушаться в горячей воде ( см. гидролиз ), что характерно для некоторых органических веществ; вещество не должно вступать в химическую реакцию со средой (здесь имеется в виду и растворитель, и воздух) или давать с растворителем устойчивую систему, несклонную к кристаллизации. Попытки кристаллизовать гигроскопичные вещества, такие как щёлочи или вещества, которые, находясь в банках, «хватают» влагу из воздуха (соли алюминия, соли железа ( III ) и др.), тяжело кристаллизующиеся в домашних условиях сахарные сиропы – к успеху не приведут;
– доступность и приемлемая цена реактивов. Ставьте опыты с теми реактивами, которые Вам по средствам, не всегда первые опыты удачны, поэтому желательно набивать руку на недорогих реактивах. Для эксперимента Вам понадобится много дистиллированной воды (исходный минимум 2 л ), которую иногда продают в аптеках и в магазинах автотоваров;
– вещество должно быть достаточно химически чистым. Как правило, для указания чистоты на этикетке с реактивом пишут: «очищенный» (очищ.) или «технический» (техн.) – самые грязные, но и самые дешёвые. Иногда чего в них только не бывает, на моей практике в таких реактивах попадались пыль, солома, помёт грызунов. Картина при фасовке вырисовалась такая, что некий дядя Вася, куря папиросу, в болотных сапогах совковой лопатой с пола в раздробленном цеху собирал и рассыпал это вещество по баночкам. Далее «ч» — чистый, «чда» — чистый для анализа, «хч» — химически чистый, рекомендуемая и часто используемая марка, «осч» — особо чистый, лучший по чистоте, но самый дорогой. Если Вы не можете найти для опытов дистиллированную воду, то за марками «хч» и «осч» гнаться не желательно;
– способность вещества растворяться в доступном растворителе. Узнайте, как растворяется Ваше вещество в воде с изменением температуры на малых объёмах. Пометка «растворим в воде» не указывает количественный расход вещества. Представьте, например, если растворимость Вашего вещества подобна растворимости сахара: потребуется более 2 кг такого вещества, чтобы растворить его в 1 л воды (!). Попробуйте сделать график растворимости для вашего вещества исходя из 50 мл растворителя. От массы стакана с водой вычтите массу стакана с профильтрованным раствором, после прекращения растворения вещества и выравнивания температуры. Небольшие потери вещества при этом будут, то так вы получите представление о том, сколько требуется вещества на определённый объём растворителя.
– должен быть известен характер растворения вещества. Иногда приходится наблюдать экзо- (с выделением теплоты) или эндотермическое (с поглощением) растворение, и как вследствие этого растворимость вещества будет меняться до тех пор, пока температура раствора не выровняется до комнатной (кстати, помните, что комнатная у всех своя);
– образующиеся кристаллы должны быть стабильны. Кристаллы некоторых веществ, вынутые из раствора в течение нескольких минут или часов способны «выветриваться» — необратимо разрушаться в результате потери влаги и превращаться в невзрачный порошок. Это следует помнить при работе с веществами:
— хромокалиевые и железоаммонийные квасцы,
— некоторые соли цинка,
— некоторые соли никеля,
— жёлтая кровяная соль,
с увеличением температуры в помещении этому подвержены алюмокалиевые квасцы и медный купорос (!). С последними тремя можно подстраховаться – храните кристаллы в дверце холодильника. Но для других веществ требуется хранение в сосудах с притёртыми пробками. Даже бюксы и чашки Петри не защищают кристаллы – печально, но факт. Из перечисленных веществ достаточно длительное время не разрушаются квасцы и медный купорос, но сроки на их стабильность разные, в моём случае происходило разрушение кристалла из-за того, что его догадались положить в бюкс с ватой, чтобы не повредить при перевозке. Медный купорос, тоже ведёт себя по-разному, иногда кристаллы сохраняют некоторую стабильность и лишь со временем местами покрываются белыми пятнами (от полугода до 2 лет), потом разрушение протекает быстро.
Этот неприятный факт может отбить охоту выращивать кристаллы данных веществ. К сожалению, найти приемлемый спасительный способ защиты таких кристаллов я не нашёл. Покрытие бесцветным лаком защищает кристалл на какой-то период времени, но сильно меняет его блеск, а вид кристалла делается искусственным. Затем плётка трескается, если за ней не уследить в этих местах кристалл превращается в пыль и дальше по цепочке. Предположу, что можно было бы такие кристаллы запаивать в изготавливаемых на заказ ёмкостях, но позволить воспользоваться данной технологией может не каждый.
Рис. 4. Выветривание кристаллов.
Пожалуй, самый печальный момент — кристаллы превращаются в прах. Выветривание — разрушение кристаллов в результате «потери» влаги, которая изначально входила в структуру вещества и обеспечивала его прочность.
Бюксы – стеклянные ёмкости с притёртой пробкой на шлифе. Туда помещают кристалл и немного (5-10% от объёма) насыщенного раствора. Их недостаток – попавший на шлиф раствор может намертво «запаять» крышку, и открыть бюкс Вы больше не сможете. К тому же бюксы хрупки и любое изменение внутреннего давления может вызвать образование трещин. Как правило, это место шлифа – муфты и керна, так как последний более тяжёлый и толстый.
Эксикатор – ёмкость созданная изначально для высушивания веществ, хранения в атмосфере какого-либо газа, приготовления очищающей хромовой смеси «хромки» и др., принципы те же, но большие размеры позволят хранить большие кристаллы.
Рис. 5. Бюксы (слева) и эксикатор (справа).
Другой выход – используйте любую ёмкость необходимого диаметра с прозрачными бесцветными стенками и притёртой пробкой. Если пробка резиновая, то для предотвращения от разрушения, оберните её в полиэтилен, фторопласт или целлофан.
Дополнение: кристаллы водорастворимых веществ очень чувствительны к сильным и резким перепадам температур, так как в их составе всегда остаётся какой-то процент влаги, при частых демонстрациях могут появиться сколы и отпечатки пальцев, острые и ровные грани оплывут, кристаллический блеск сменится матовостью, – помните это, если уважаете свой труд. Выращивание кристалла, как и выращивание чего-то живого – долгое и требующее терпения процедура. Научиться растить кристаллы – задача первая, вторая задача – научиться сохранять результат своего занятия.
– химическая посуда – большие термостойкие плоскодонные стаканы от 0,05 до 3 л (и более, если такое возможно). Обратите внимание на то, нет ли изъянов у дна и стенок;
– водяная баня (в домашних условиях это м.б. старая кастрюля и электроплита);
– сосуд для кипячения на водяной бане (круглодонные термостойкие колбы от 1 л и более);
– тонкие, прочные суровые нитки (на таких меньше кристаллических наростов);
– фильтровальная бумага (ёю может быть любая непроклеенная, тонкая бумага промокашка, салфетки, туалетная бумага) или стерильно чистая хлопковая вата;
– дополнительные мелочи, которые требуются при выполнении, будут указаны далее в тексте (воронки (это м.б. срезанное горлышко пластмассовой бутылки); стеклянные, деревянные или пластиковые палочки и т.п.);
Описание методик выращивания кристаллов (из раствора, где растворитель – вода) можно свести к трём пунктам:
1. Выращивание больших монокристаллов (длина рёбер от 1 см и более) соединений, растворимых в воде.
2. Получение кристаллов мало- или нерастворимых соединений в воде.
3. Получение кристаллов простых веществ (металлов и неметаллов).
Основой выращивания кристаллов, как описано в любой литературе, является насыщенный раствор соли. Однако здесь есть свои нюансы, которые следует оговорить.
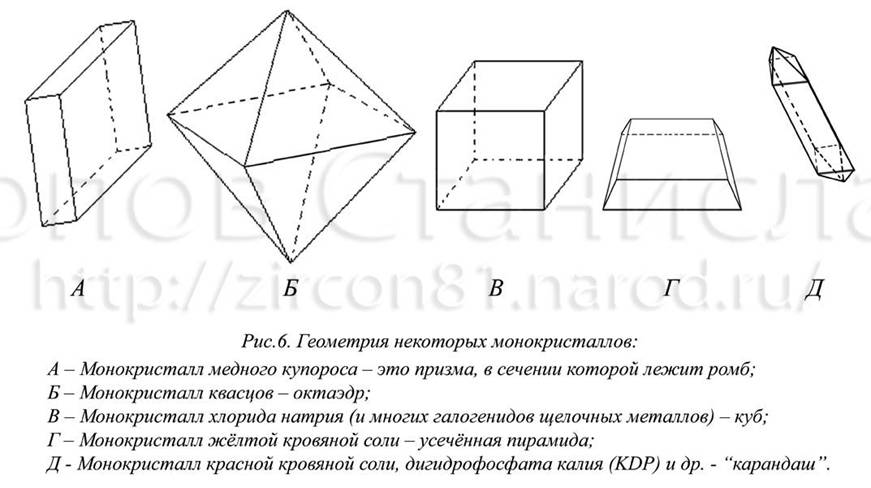
Начинающему экспериментатору рекомендую начать опыт, используя в качестве исходного материала для получения кристаллов: медный купорос, гидрофталат калия, красную кровяную соль, бихромат или хромат калия, алюмокалиевые квасцы (ещё часто в литературе советуют хлорид натрия, но растить его крупные правильные кристаллы труднее (см. рис. 3 и методику в фото)). Крупные кристаллы с этими веществами получаются всегда, другое дело, что может быть неправильно воспроизведена форма (см. рис. 6).
Авторы многих книг по выращиванию кристаллов свои методики основывают:
– на приготовлении пересыщенных растворов с дальнейшей кристаллизацией в открытом сосуде (самая распространённая методика) или закрытом. Закрытый – промышленный метод, для его осуществления используется огромный стеклянный сосуд с термостатом, имитирующим водяную баню. В сосуде находится раствор с готовой затравкой, и каждые 2 дня температура раствора понижается на 0,1 о С [4], этот способ позволяет получать технологически правильные и чистые монокристаллы. Но это требует высоких затрат электроэнергии и дорогое оборудование (несколько млн рублей).
– на испарении насыщенного раствора открытым способом (см. ранее пример случайного роста KHSO 4), когда постепенное испарение растворителя, например, из неплотно закрытого сосуда с раствором соли, может само собой породить кристаллы. Закрытый способ подразумевает выдерживание насыщенного раствора в эксикаторе над сильным осушителем (оксид фосфора ( V ) или концентрированная серная кислота).
Я использую первый («открытый») вариант. Да! Это не поможет полностью защитить раствор от пыли (даже накрывая фильтровальной бумагой, используя дистиллированную воду, идеальных стерильных условий для раствора дома Вы не создадите), но Вы и не собираетесь растить кристалл год, верно?! К тому же примеси будут в кристаллах всегда (другие ионы из исходного нечистого вещества или кипячёной воды, пылинки-включения и т. п.), мы можем только слегка уменьшить их содержание. И помните, что идеального кристалла по всем «правилам природы» не существует, дефекты есть даже в очень правильных (однородных) кристаллах.
Ниже речь пойдёт о медном купоросе.
В каждой методике выращивания можно выделить несколько подпунктов:
— приготовление маточного раствора;
I . Приготовление маточного раствора (прямой и обратный способ):
Примечание: Многие авторы в своих книгах для простоты указывают таблицы веществ, и сколько их требуется в граммах на приготовление насыщенного раствора [8]. Я буду использовать «столовую» терминологию Вы, вдруг, скажите: «Точность никогда не бывает лишней. Скока вешать в граммах?!» А я отвечу: «У большинства начинающих химиков, экспериментирующих дома, лабораторные весы, как правило, отсутствуют; во-вторых, точность массы здесь не всегда обязательна, – вещества может требоваться очень много («комнатная температура» у всех разная), а определить насыщенность раствора ещё проще – по прекращению растворения вещества в сосуде». Когда вещество имеется в ограниченном количестве (до 500 грамм ), с ним получают небольшие монокристаллы (длина ребра до 2 см ), и расходуют его частями, имея запас. Так иодид калия KI (см. в «Фото кристаллов») вырос у меня из 50 мл концентрированного (но ненасыщенного) раствора, который находился в открытой аптекарской бутылочке, его рост – чистая случайность: вода испарялась, и кристалл рос. Как видите, для малых количеств методика сохраняется, но меняются объёмы посуды и растворителя.
Самое важное условие: для выращивания кристаллов используют только свежеприготовленные растворы. Так как в процессе стояния в растворах у многих веществ накапливающиеся определённого состава комплексы (например, аквакомплексы) меняют структуру кристалла (такие кристаллы могут начинать быстрее выветриваться). Какие-то растворы сильно гидролизуются (их ещё можно очистить фильтрованием). В некоторых могут начать процветать случайно попавшие споры грибов (алюмокалиевые квасцы и чаще всего органические вещества).
Прямой способ. Для приготовления маточного раствора требуется чистый, хорошо вымытый термостойкий стакан на 1 л . В него наливают горячую ( t =50 о С, при высоких температурах вещество сильно гидролизуется) кипячёную воду или, что лучше, дистиллированную 700-800 мл. В стакан засыпают вещество небольшими порциями (1 порция = 1 столовая ложка без горки), каждый раз перемешивая и добиваясь полного растворения. Когда раствор «насытится» – т. е. вещество будет оставаться на дне , добавляют ещё две порции и оставляют раствор при комнатной температуре на сутки. Чтобы в раствор не попала пыль, его накрывают листом фильтровальной бумаги и оставляют в той части помещения, где сохраняется постоянная температура, где в дальнейшем Вы будете продолжать опыт. Если проходит отопительный сезон, то можно оставить стакан и около батареи, но помните, что растворимость у вещества теперь будет другая. И стоит измениться температуре, как возникнет кристаллизация – лишнее вещество выкристаллизуется из раствора. Помните: чтобы кристаллы росли как можно правильно, кристаллизация должна идти медленно, на бесцветных веществах, чьи кристаллы должны быть прозрачны как стекло, скорость роста проявляется заметнее – при быстром росте кристаллы мутнеют.
Возможен и обратный способ приготовления насыщенного раствора. Вы максимально растворяете вещество при комнатной температуре, и когда растворение достигнет предела (вещество будет оставаться на дне), добавляете ещё 1-2 порции и греете сосуд с раствором на плите до t =50-60 о С. Условие этого способа – используемая посуда должна быть термостойкой, а конфорка плиты ровной, это может создать неудобство при нагревании объёмов, например, в 1 л . Но есть из чего выбирать.
Примечание: Экспериментатору следует знать, что любая примесь в растворе может стать включением в кристалле или быть источником дефекта. В итоге вместо монокристалла появятся «химеры», состоящие из наростов и искажений (это возникшие из-за разных центров кристаллизации микрокристаллики пробуравили друг друга); они будут увеличиваться по мере роста кристалла. Иногда это выглядит более эффектно, чем правильный монокристалл (вырастить который, кстати, задача сложная). Но помните, всякое отклонение следует расценивать, как не соблюдение каких-либо условий. В природе попадающие примеси становятся включением в кристалле и иногда не искажают его форму: рост одних минералов в других, явление изоморфизма для квасцов ( рис. 7), насекомые, попавшие в воду и закристаллизовавшиеся там (например, град) и т. п.
Рис. 7. Изоморфизм.
«Кристалл в кристалле» — такое выращивание, когда один кристалл растёт поверх затравки другого кристалла, можно осуществлять с веществами одинаковой природы, например, с квасцами общей формулы
Me I Me III ( SO 4)2∙12 H 2 O ( Me I = щелочной металл и NH 4 + , Me III = Al 3+ , Cr 3+ , Fe 3+ и др.)
На следующий день осматривают раствор. В нём не должны плавать примеси; если это раствор алюмокалиевых квасцов, то он должен быть бесцветным и прозрачным. Раствор же медного купороса не должен содержать мути. На дне должен выпасть избыток вещества в виде кристаллов. В том случае, если обнаружены примеси, раствор подогревают на 20 о C (поставьте стакан с раствором в таз с тёплой водой на 1-2 часа) и фильтруют на воронке, внутрь которой помещают фильтр или (что быстрее и лучше) кусочек ваты. Поскольку нам осадок не нужен, зачем усложнять процесс фильтрования. Кусочек ваты должен лежать неплотно на дне воронки, не затруднять ток жидкости, но и не проваливаться с нею в стакан, иначе фильтровать придётся заново, смачивать вату водой, как фильтр не надо. Затем повторяют охлаждение до комнатной температуры. Этот раствор будет необходим нам в большом количестве, поэтому вы должны иметь посуду для его хранения и по необходимости запастись им дополнительно. Хранить его можно в колбе, либо пластиковых бутылках из-под воды, не содержащей красителей и ароматизаторов (объём которых варьирует от 0,33 до 30 л ), с притёртой пробкой (если пробка резиновая, то её оборачивают полиэтиленовой плёнкой, чтобы она не взаимодействовала с раствором), на дне должны оставаться кристаллы вещества.
II . Получение кристалла-затравки:
Готовый очищенный раствор аккуратно сливают с осадка кристаллов и в количестве 1 л помещают в термостойкую круглодонную колбу. Туда же помещают 1 чайную ложку (с горкой) химически чистого вещества (это могут быть те же выпавшие кристаллы). Теперь колбу нагревают на водяной бане, добиваясь полного растворения, как правило, в окрашенных растворах окраска, из-за избытка вещества, становится интенсивнее. Полученный раствор греют ещё 5 мин на водяной бане при температуре не выше 60-70 о С, после чего его переливают в чистый, подогретый до температуры раствора термостойкий стакан (можно ополоснуть кипятком). Стакан обворачивают плотно сухим полотенцем, накрывают фильтровальной бумагой и оставляют остывать. Сейчас раствор надо беречь от сквозняков, от резких перепадов температур.
Резкий перепад температур, как и резкое перемешивание остывшего раствора, могут вызвать преждевременную кристаллизацию, но кристаллы при этом получатся мелкие и бесформенные, они плотно осядут на стенках раствора и нагревание придётся повторять снова.
Спустя сутки, убирают полотенце, не стараясь колыхать стакан, чтобы не вызвать незапланированную кристаллизацию. Осматривают содержимое – на дне и на стенках должны образоваться небольшие плоские синие кристаллики-параллелограммы.
– Если образовалось множество мелких сросшихся бесформенных кристалликов, как после резкого охлаждения, то количество соли уменьшают и повторяют описанную стадию.
– Если кристаллики не образовались, Ваша вина – Вы не насытили раствор как следует и поэтому раствору следует постоять ещё сутки; либо следует увеличить количество растворяемого вещества, повторив этап заново.
Эта стадия эксперимента должна вас обучить правильно выращивать затравку, которая далее будет исходным кирпичиком для получения «огромной конструкции». Отберите подходящие по структуре кристаллики (с длинной ребра от 0,3 см и более) и храните их отдельно в банке с притёртой пробкой вдали от источников высоких температур и света. С каким-то одним вы будете продолжать эксперимент.
Помните: чем меньше выбранная вами затравка, чем она правильнее, тем легче раствору (системе) подстроиться под неё (как перламутру к песчинке, попавшей в мантию моллюска).
III . Выращивание монокристалла:
Монокристалл выращивают из полученной затравки. Используя суровую нить, плотно на 1-2 раза обвивают затравку, чтобы она не соскользнула после намокания нити, желательно за самую длинную грань, либо выберите затравку с длинной гранью. Придётся помучиться, создавая петельку, в которую ляжет кристалл размером около 3- 5 мм . Главное – терпение, попросите кого-нибудь помочь Вам, пусть разделяют Ваше увлечение, скажем, родители. Это не сложнее, чем попасть ниткой в ушко иголки. Второй конец нити можно примотать к крестовине из деревянных или пластиковых палочек, чья длина больше диаметра стакана. Намотайте нить так, чтобы при повороте крестовины Вы могли легко регулировать высоту подъёма затравки.
Снова готовят насыщенный раствор на основе исходного маточного. Для этого готовый раствор ставят на водяную баню и добавляют 0,5 чайной ложки вещества (иногда меньше). Чем меньше Вы добавите его на этом этапе, тем лучше (можно также просто нагреть насыщенный раствор, без добавления вещества). Греют и перемешивают. Как только вещество растворилось, колбу вынимают, и раствор переливают в заранее приготовленный нагретый стакан. Стакан с раствором ставят на выбранное место, и дают 20-30 секунд постоять, чтобы жидкость немного успокоилась. Наш раствор непересыщенный, поэтому «лишние градусы» могут вызвать растворение затравки, что нам не нужно. Если раствор тёплый, ему дают остыть до 30 о C или чуть меньше. Желателен термометр, но проверить при его отсутствии приблизительную температуру – легко, температура нашего тела 36,6 о C , поэтому всё, что кажется теплее – выше её, наоборот – ниже. Следить за остыванием раствора следует очень внимательно, чтобы не допустить её понижения до комнатной (обычно на остывание раствора выделяю около двух часов, в зависимости от температуры воздуха в помещении). Затем затравку располагают в тёплом растворе (температура на 5-7 о С выше комнатной) таким образом, чтобы кристаллик как бы висел в нём, на высоте1/2 или 3/5 от дна. Поместив затравку в раствор, понаблюдайте на просвет не оплывают ли грани у Вашей затравки, не создаются ли вокруг неё волнообразные завихрения. Если да – раствор ещё тёплый для затравки, такое бывает с хорошо растворимыми в воде веществами, надо затравку вынимать и подождать ещё. Мой обычный температурный предел выжидания: раствор должен быть минимум на 5 о С выше комнатной температуры. Когда, наконец, разместили – всё, осталось только ждать, при этом стакан вертеть, наклонять, перемешивать раствор не рекомендуется.
Бывает и такое: пришли на утро смотреть на затравку, а в растворе только петля болтается и затравка лежит на дне. Если нить была толстая, она набухла, петля увеличилась и кристалл выпал. Но стоп, трогать, вынимать что-либо, а уж тем более расстраиваться не нужно! Читайте ниже.
Следует сказать, что можно вырастить кристалл и без нити. Для этого требуется широкий стакан с плоским дном, так как для этой цели затравку аккуратно укладывают на середину дна (можно помочь ей лечь нагретой стеклянной палочкой), и она повторит его рельеф. Здесь рост кристалла будет ограничен стенками стакана, и преимущественно, он будет расти в стороны – это хорошо для медного купороса и для плоских кристаллов в принципе (жёлтая кровяная соль, гидрофталат калия). Если такое получилось случайно, следите, чтобы на дне не стали расти ещё кристаллы, а то они врастут в исходный. На петле со временем тоже могут начать расти кристаллы, иногда их бывает несколько, а иногда растёт 1-2 правильных и выросшие таким образом, они окажутся лучше затравки.
В случае с квасцами лучше использовать нить. Но здесь требуется следить за тем, чтобы она не обрастала. Если такое произошло, то нить с кристаллом вынимают, счищают лишнее и заново готовят раствор 1 (греют, подготавливают к температуре кристалл и т.п.) Порой нить трудно очищать, соскабливая лишние кристаллические наросты, высок риск её разорвать. Для этого надо поднести нить к тонкой струе горячей воды, и поводить «проблемный» участок так, чтобы вода не задела затравку до их растворения.
Помните: чтобы не было наростов на нити, нить должна быть тонкой без волосков, и должна быть опущена с затравкой в раствор на 5-7 о С теплее комнатной температуры. Такая нить успевает пропитаться раствором и «сливается» с системой в единое целое. О.Ольгин советует смазать нить вазелином [1], но мне это не помогало, при этом часто загрязнялся раствор маслянистой плёнкой. Но я не спорю с идеей, в своей книге «Опыты без взрывов» он не преследует целей вырастить крупный однородный кристалл, а жаль…
Затравку иногда советуют прилеплять супер-клеем, лично я не пробовал.
Теперь следует следить за ростом кристалла каждый день, ни в коем случае не поднимая, не поворачивая и не сотрясая стакан с раствором, иначе эта встряска породит в системе незапланированную, иногда мгновенную кристаллизацию.
Так многие авторы советую доливать раствор в систему по мере его испарения. Для небольших объёмов очень сложная операция, поскольку возникшая сильная диффузия также может вызвать сбои в росте кристалла. В насыщенную систему растворы я не доливаю, я готовлю большой объём вещества сразу и выращиваю кристаллы в стаканах от 1 л и выше, когда уровень жидкости опускается до верхушки кристалла, я переподготавливаю раствор снова и вношу подросший кристалл в новую систему. Иногда эти повторения могут отражаться на кристалле тонкими полосками – одна полоска, значит, раствор меняли один раз (типа годичных колец на дереве).
Вначале вы увидите, как система будет «обживать» затравку, как они будут подстраиваться друг под друга. По мере роста нить начнёт уходить внутрь кристалла, получится что-то вроде кулона. В итоге вы должны получить следующее:
Рис.8. Выращенные кристаллы медного купороса (I) и алюмокалиевых квасцов (II) 2 , один кристалл — за одну неделю.
Как видите, у кристаллов есть своя особенность, они должны быть гладкими и прозрачными, как стекло. Однако, при частом прикасании к кристаллу, хранении на открытом воздухе, на свету, мы наблюдаем его помутнение: кристалл выветривается, т.е. теряет, всегда входящую в его состав воду. Есть несколько веществ, которые в моей практике превосходно сохранились и не потеряли вошедшую в их состав воду: гидрофталат калия, красная кровяная соль, хлорид натрия. Вода в кристалл входит в разных количествах и в красной кровяной соли, алюмокалиевых квасцах, к примеру, она удерживается лучше, чем в жёлтой кровяной соли и в хромокалиевых квасцах. Избежать выветривания для кристаллов, выращенных из растворов, сложно. Поэтому хранить кристаллы следует в герметичных пакетах или баночках в холодильнике (см. ранее). Хромокалиевые квасцы лучше хранить в концентрированном сотрясённом растворе в банке с плотно прилегающей пробкой в месте, где температура может измениться максимум на 5 о .
Более подробная информация о росте кристаллов представлена на отдельной ссылке рядом с их фотографиями.
1). Некоторые кристаллы (гидрофталат калия) можно выращивать, погрузив только один раз в раствор, в слегка тёплых растворах. При высокой (или наоборот – низкой) температуре кристалл покрывается трещинами и мутнеет. Идеальный кристалл гидрофталата калия – шестиугольная призма-таблетка, прозрачная как стекло. Если вы посмотрите на химическую формулу (рис.9), которая отражает его состав, вы поймёте, почему у кристаллов такая форма:
2). Очень часто, вместо идеального октаэдра (т.е. тетрагональная бипирамида) у квасцов получается усечённый октаэдр – кубоктаэдр. Поэтому обращайте внимание на выбор затравки (кристалл создаётся по подобию затравки), тупая грань повториться везде! Так устроена система: она влияет на рост кристалла и сам кристалл влияет на свой рост.
3). Выращивание кристаллов хромокалиевых квасцов сопряжено с трудностями: во-первых, раствор не прозрачен, во-вторых, полученные кристаллы можно хранить только под слоем раствора при постоянной температуре или под толстым слоем лака (бесцветный лак для ногтей) в холодильнике. Однако смеси полученные при смешении растворов алюмокалиевых и содержащие от 5% до 30% хромокалиевых квасцов дают растворы различного оттенка от нежно-розового до цвета аметиста и граната, выращенные из них кристаллы, также имеют форму октаэдра, и хранятся намного дольше хромокалиевых без какой-либо защиты.
4). При выращивании кристаллов бихромата калия, в раствор добавляют немного хромового ангидрида CrO 3 (количество его приходится угадывать на практике), полученные кристаллы не совсем отвечают формуле K 2 Cr 2 O 7 , скорее формуле K 2 Cr 3 O 10 (трихромат калия), и имеют вид ярко-красных и почти коричневых параллелепипедов. А вот для роста K 2 CrO 4 подобные условия излишни, да и кристаллы у хромата калия – гексагональные бипирамиды.
5). Очень дорогая сегнетова соль может дать прозрачные кристаллы-цилиндры до 30 см длины, но раствор для этих целей должен быть очень чистым (прозрачным и бесцветным, не жёлтым!). Если раствор имеет желтизну, обусловленную органическими примесями, его подвергают очистке: перекристаллизации. Каждый раз выпадающие чистые без включений кристаллы отделяют от раствора, пока не останется осадок («грязь»), обуславливающий желтизну, который удаляют. Очистка активированным углём не помогает.
6). Ромбические призмы, подобные медному купоросу дают тиосульфат натрия (фиксаж) и сульфит натрия, полученные кристаллы похожи на лёд, однако не стабильны и на воздухе рассыпаются в белый порошок спустя несколько часов. Хранение подобно хромокалиевым квасцам, но под лаком кристалл также мутнее.
7). У хлорида натрия можно вырастить небольшие кубики, для получения крупных кристаллов используют большие сосуды с затравками, поскольку растворимость его меняется слабо. Более другой, эффективный способ – выращивание из концентрированного раствора хлорида меди ( II ) CuCl 2 , который, испаряясь, высаливает в первую очередь хлорид натрия. Однако полученные кристаллы имеют зелёный оттенок. И второй вариант – добавление к раствору соли мочевины (на 200 мл насыщенного раствора 3 ч/ложки карбамида) – эту методику предлагали в своей книге Кантор Б. З.; «Минерал рассказывает о себе», М.: Недра, 1985 г . [5], кристаллы будут уже крупнее – до 1 см, но октаэдрических кристаллов NaCl , мне получить не удалось (есть какой-то авторский секрет, очевидно, заключённый в добавке чего-то ещё). При выращивании NaCl из растворов KCl , RbCl получаются смешанные соли.
8). Иногда можно наблюдать и такой процесс. В насыщенном растворе с кристаллами на дне всегда существует круговорот: вещество из кристаллического осадка переходит в раствор и обратно. Каждый раз «возвращаясь» в кристалл вещество его укрупняет, так спустя несколько месяцев, мелкокристаллический осадок превращается в крупнокристаллический монолит, которые может дилетантами восприниматься как один большой кристалл.

Я предлагаю заменить данный прибор хорошо отрегулированной капельной воронкой, в которую доливать насыщенный раствор по мере его расходования удобнее. Авот некоторые ребята могут получить такой сталактит за несколько секунд, жаль, что временя этот результат сохраняет ненадолго. В химии опыты с ацетатом натрия известны, как «горячий лёд»:
9). Игольчатые, пушистые кристаллы камфары или салициловой кислоты длиной 0,3- 0,8 см можно получить, оставив испаряться их спиртовые медицинские растворы (1-2%), разумеется, вдали от огня (поэтому работа с органическими растворителями крайне не удобна: они горючи и имеют запах).
11). Если из нержавеющей проволоки или спичек сделать буквы, их плотно обмотать ниткой и поместить в раствор для выращивания кристаллов, то можно получить красивые буквы для оформления стендов. Их вынимают из раствора, сушат и покрывают бесцветным лаком или клеем для склеивания пластмасс. Рекомендуемые соли: поваренная соль, хромат и бихромат калия, квасцы. А вот кристаллическая мебель (рис. 11) – пример того, что будет, если не мыслить размерами стакана и оценивать возможности нитки:
Источник