ИНФОФИЗ — мой мир.
Весь мир в твоих руках — все будет так, как ты захочешь
Весь мир в твоих руках — все будет так, как ты захочешь
Как сказал.
Все мы гении. Но если вы будете судить рыбу по её способности взбираться на дерево, она проживёт всю жизнь, считая себя дурой.
Альберт Эйнштейн
Вопросы к экзамену
Для всех групп технического профиля

Я учу детей тому, как надо учиться
Часто сталкиваюсь с тем, что дети не верят в то, что могут учиться и научиться, считают, что учиться очень трудно.
Урок 23 (дополнительный материал) Лабораторная работа Наблюдение роста кристаллов из раствора
Тема: «Наблюдение роста кристаллов из раствора»
Цель: научиться создавать кристаллы, пронаблюдать за ростом кристалла
Теоретические сведения
Существуют два простых способа выращивания кристаллов из раствора: охлаждение насыщенного раствора соли и его выпаривание. Первым этапом при любом из двух способов является приготовление насыщенного раствора. В условиях школьного физического кабинета проще всего выращивать кристаллы алюмокалиевых квасцов. В домашних условиях можно выращивать кристалл медного купороса или обычной поваренной соли.
Растворимость любых веществ зависит от температуры. Обычно с повышением температуры растворимость увеличивается, а с понижением температуры уменьшается.
При охлаждении горячего (примерно 40°С) насыщенного раствора до 20°С в нем окажется избыточное количества соли на 100 г воды. При отсутствии центров кристаллизации это вещество может оставаться в растворе, т.е. раствор будет пересыщенным.
С появлением центров кристаллизации избыток вещества выделяется из раствора, при каждой данной температуре в растворе остается то количество вещества, которое соответствует коэффициенту растворимости при этой температуре. Избыток вещества из раствора выпадает в виде кристаллов; количество кристаллов тем больше, чем больше центров кристаллизации в растворе. Центрами кристаллизации могут служить загрязнения на стенках посуды с раствором, пылинки, мелкие кристаллики соли. Если предоставить выпавшим кристалликами возможность подрасти в течение суток, то среди них найдутся чистые и совершенные по форме экземпляры. Они могут служить затравками для выращивания крупных кристаллов.
Чтобы вырастить крупный кристалл, в тщательно отфильтрованный насыщенный раствор нужно внести кристаллик — затравку, заранее прикрепленный на волосе или тонкой леске, предварительно обработанной спиртом.
Можно вырастить кристалл без затравки. Для этого волос или леску обрабатывают спиртом и опускают в раствор так, чтобы конец висел свободно. На конце волоса или лески может начаться рост кристалла.
Если для выращивания приготовлен крупный затравочный кристалл, то его лучше вносить в слегка подогретый раствор. Раствор, который был насыщенным при комнатной температуре, при температуре на 3-5°С выше комнатной будет ненасыщенным. Кристалл-затравка начнет растворяться в нем и потеряет при этом верхние, поврежденные и загрязненные слои. Это приведет к увеличению прозрачности будущего кристалла. Когда температура понизится до комнатной, раствор вновь станет насыщенным, и растворение кристалла прекратится. Если стакан с раствором прикрыть так, чтобы вода из раствора могла испаряться, то вскоре раствор станет пересыщенным и начнется рост кристалла. Во время роста кристалла стакан с раствором лучше всего держать в теплом сухом месте, где температура в течение суток остается постоянной. На выращивание крупного кристалла в зависимости от условий эксперимента может потребоваться от нескольких дней до нескольких недель.
Ход работы
1. Тщательно вымойте стакан и воронку, подержите их над паром.
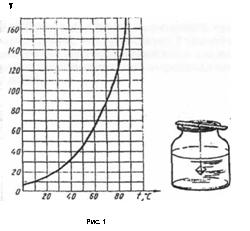
2. Налейте 100, г дистиллированной (или дважды прокипяченной) воды в стакан и нагрейте её до 30°С-40°С. Используя кривую растворимости, приведенную на рисунке 1, определите марсу соли, необходимую для приготовления насыщенного раствора при 30°С.
Приготовьте насыщенный раствор и слейте его через ватный фильтр в чистый стакан. Закройте стакан крышкой или листком бумаги. Подождите, пока раствор остынет до комнатной температуры. Откройте стакан. Через некоторое время начнут выпадать первые кристаллы.
3. Через сутки слейте раствор через ватный фильтр в чистый, вновь вымытый и попаренный стакан. Среди множества кристаллов, оставшихся на дне первого стакана, выберите самый чистый кристалл правильной формы. Прикрепите кристалл-затравку к волосу или леске и опустите его в раствор. Волос или леску предварительно протрите ватой, смоченной спиртом. Можно также положить кристалл-затравку на дно стакана перед запивкой в него раствора. Поставьте стакан в теплое чистое место. В течение нескольких суток или недель не трогайте кристалл и не переставляйте стакан. В конце срока выращивания выньте кристалл из раствора, тщательно осушите бумажной салфеткой и уложите в специальную коробку. Руками кристалл не трогайте, иначе он потеряет прозрачность.
Видеоопыт.
Опыт 1. Выращивание кристалла из медного купороса.
Опыт 2. Выращивание кристалла из поваренной соли.
Контрольные вопросы
1. Что может служить центром кристаллизации?
2. Чем объясняется неодинаковая скорость роста различных граней одного и того
же кристалла?
3. Каким способом можно насыщенный раствор сделать пересыщенным без
добавления растворенного вещества?
Источник
Практическая работа «Выращивание кристаллов»
опыты и эксперименты по химии (8 класс)
Скачать:
| Вложение | Размер |
|---|---|
| p.r.vyrashchivanie_kristallov.docx | 382.27 КБ |
Предварительный просмотр:
Практическая работа №4. Выращивание кристаллов соли.
Цель: Вырастить кристалл соли в домашних условиях.
- рост кристаллов длится 2-3 недели.
- Форма кристаллов медного купороса несимметричная напоминающая косые параллелепипеды; железного купороса — моноклинные кристаллы, похожие на ромб; алюмокалиевых квасцов и хлорида натрия — кубической формы. Кристаллы хлорида натрия сильно срастаются.
- Цвет: медного купороса ярко-синий; железного купороса — светло-зеленый; алюмокалиевые квасцы и хлорид натрия — бесцветные.
- Кристаллы алюмокалиевых квасцов и хлорида натрия прозрачные; медного и железного купороса, преимущественно, — нет.
- Размеры указаны на фотографиях.


Предлагаемую лабораторную работу можно проводить в домашних условиях, так так выполняемые действия не являются опасными, но требуют длительного времени.
Практическое исследование проблемы:
Целью моей работы является: узнать, что такое невидимые чернила; какие бывают невидимые чернила; и изготовить невидимые чернила в домашних условиях своими руками.
С правилами по ТБ ознакомлен(на): ___________
- Рецепты получения невидимых чернил.
Как сделать исчезающие чернила? Этот вопрос волновал не одно поколение людей, ведь секреты, которые необходимо скрыть, существовали всегда. Из прочитанных книг и Интернета я узнал, что невидимые чернила широко применялись для тайной переписки.
Для некоторых из них нужны химические вещества, которых у меня нет. Но оказалось, что для приготовления невидимых и исчезающих чернил есть несколько доступных способов, которые легко можно применить дома.
Я решил попробовать. Вот несколько рецептов, с помощью которых каждый ребенок сможет приготовить исчезающие чернила:
- Невидимые чернила из лимона – выдавить сок половины лимона и развести его таким же количеством воды, проявлять воздействием тепла;
- Невидимые чернила из лука – приготовить сок лука и использовать его в качестве чернил, проявлять воздействие тепла;
- Невидимые чернила из молока – взять молоко и использовать его в качестве чернил, высушить, проявлять над свечой или лампой;
- Невидимые чернила из соды – приготовить концентрированный раствор соды – 1 чайная ложка на 10 мл. – 2 – 3 чайные ложки воды, все перемещать, использовать в качестве чернил, которые долго сохраняются, проявлять воздействием тепла.
В Интернете я нашел еще множество рецептов изготовления невидимых чернил, но для приготовления в домашних условиях не все подойдут. Поэтому я остановился на самых доступных для домашнего изготовления рецептах.
- Получение невидимых чернил в домашних условиях.
Приготовление невидимых чернил из лимона
Для этого нам понадобятся: половинка лимона, стаканчик, кисточка, белый лист бумаги. Выдавим сок из лимона в стакан, добавим такое же количество воды. Обмакнем кисточку в раствор лимонного сока и воды и напишем что-нибудь на бумаге. После того, как надпись сделана, ей надо дать высохнуть. Чтобы проявить надпись, надо нагреть листок бумаги, например, прогладить горячим утюгом. Лимонная кислота темнеет при воздействии температуры и таким образом, мои чернила становятся видимыми. Лимонный сок приятно пахнет, не заметен при высыхании, но долго сохнет, проявляется слабо желто-коричневым оттенком букв.
Приготовление невидимых чернил из лука
Для эксперимента нам понадобится то же самое, что и для предыдущего.
Возьмем половину луковицы, натрем ее на мелкой терке и выдавим через кусочек марли сок в стаканчик. Нанесем сок лука с помощью кисти на бумагу, подождем высыхания. При высыхании сок лука немного заметен на бумаге, и имеет не очень приятный запах, что делает эти чернила несовершенными. Будем проявлять тем же способом – нагреванием. Сок лука темнеет при воздействии тепла, и чернила становятся видимыми, приобретают коричневый оттенок.
Приготовление невидимых чернил из молока
Налить в стаканчик молоко. Обмакнуть кисточку в молоко и написать ей на листке белой бумаги. Дать молоку высохнуть. От букв не останется ни следа, ни запаха. Затем нагреть бумагу над свечой, и на ней проступит написанное, так как молоко при нагревании изменит цвет. Молоко действительно изменило цвет, но цвет надписи оказался не однородным, а свечой пользоваться не очень удобно и безопасно потому, что постоянно боишься, что листок может загореться, гораздо удобнее пользоваться утюгом. Но эксперимент позволил доказать, что надпись проявляется от воздействия любого тепла.
Приготовление невидимых чернил из соды
Необходимо приготовить насыщенный раствор обыкновенной питьевой соды в воде. Эти чернила могут очень долго храниться, не портясь. В этом их преимущество перед способом письма молоком или соками лимона и лука. Для удобства письма этими чернилами лучше всего заправить авторучку. Но я воспользовался, как и в предыдущих рецептах кисточкой. Сразу же за кистью вода испаряется, и на листе бумаги вроде бы ничего нет. Проявляется тайное письмо тоже очень просто: воздействием тепла. При нагревании утюгом проступает темно-коричневый текст. Причем, этот текст оказался самым ярким и однородным из всех предыдущих. Эти невидимые чернила оказались лучшими!
- Получить невидимые чернила в домашних условиях можно из легкодоступных в домашнем обиходе веществ.
- Не все виды симпатических (невидимых) чернил можно получить в домашних условиях, в основном только теплочувствительные чернила. Так как их легко проявить в домашних условиях воздействием тепла. Симпатические чернила, для которых нужны химические вещества или химические проявители, можно получить только в специальной химической лаборатории.
- Проявлять невидимые записи в домашних условиях можно с помощью, свечи, лампы, утюга, но наиболее удобный и безопасный способ — это с помощью утюга.
- В ходе своего эксперимента я установил, что самыми подходящими самодельными невидимыми чернилами можно считать – чернила из соды. Они легко готовятся, долго храниться, не имеют запаха, высыхают быстрее других чернил, участвующих в эксперименте и абсолютно незаметны на бумаге. Их можно даже заправлять в авторучку, так как они не портятся. И эти чернила проявляются ярче и однороднее других невидимых чернил, которые я получил и исследовал. Таким образом, невидимые чернила из соды — самые лучшие в моем эксперименте.
- В ходе своей исследовательской работы мы убедились, что эксперимент – это очень увлекательное и интересное занятие.
В ходе своего эксперимента я почувствовал себя не только настоящим исследователем, но и настоящим разведчиком на секретном задании. - Результатами своего исследования я поделился с одноклассниками и очень надеюсь, что это их вдохновит на собственные эксперименты.
Источник
Практическая работа по химии «Выращивание кристаллов»
Разделы: Химия
Цель:
- Образовательная: формирование понятий «кристаллы, кристаллическое состояние вещества» на основе исследовательской и проблемно-поисковой деятельности,
- изучение условий образования кристаллов
- Развивающая: развитие практических умений и навыков работы с химическими веществами, оборудованием; умений применять теоретические знания для объяснения наблюдаемых явлений
- Воспитательная: эстетическое воспитание; воспитание компетентной, коммуникативной, всесторонне развитой личности.
Оборудование, реактивы: 2 термостойких химических стакана, толстая нить, затравка, стеклянная палочка для перемешивания, палочка для закрепления нити, фильтр, воронка, чашка Петри, порошок медного купороса, микроскоп, предметное стекло, препаровальная игла, пинцет, кристаллик медного купороса.
Задачи исследования:
- вырастить кристаллы разных солей;
- изучить условия образования кристаллов;
- проанализировать полученные результаты.
Оборудование: 2 термостойких химических стакана, толстая нить, стеклянная палочка для перемешивания, палочка для закрепления нити, фильтр, воронка, чашка Петри, микроскоп, предметное стекло, препаровальная игла.
Реактивы: порошок медного купороса, дистиллированная вода
1. Организационный момент. Объявление темы, постановка цели.
Вводная часть, создание мотивации к восприятию учебного материала
Ребята, прежде чем начать урок, я хочу проверить Ваше эмоциональное состояние. У вас на парте таблички «Шкала эмоционального состояния». Поставьте галочку на таблице из 6 лиц, чье выражение отражает ваше настроение в начале урока.
Рис.1. Определи свое эмоциональное состояние






 А вот внешний вид медного купороса, у вас в стаканчиках с притертыми крышками. Медный купорос — пятиводный сульфат меди (II) CuSO4 • 5H2O. В древности его называли витриолом (от латинского слова vitrum — стекло), так как крупные кристаллы напоминают цветное синее стекло.
А вот внешний вид медного купороса, у вас в стаканчиках с притертыми крышками. Медный купорос — пятиводный сульфат меди (II) CuSO4 • 5H2O. В древности его называли витриолом (от латинского слова vitrum — стекло), так как крупные кристаллы напоминают цветное синее стекло.