Показатель pH почвы (как определить кислотность почвы)
Большинство растений предпочитают слабокислые и нейтральные почвы. Но если грунт сильнокислый или щелочной, выращивать на нем даже неприхотливые растения сложно. Для определения кислой, нейтральной или щелочной среды почвы используют показатель pH.
Содержание
Показатель pH — специальный показатель, отражающий кислотно-щелочной баланс почвы. В этом материале даны понятия что такое показатель pH, какие типы почвы (от слабокислой до сильнощелочной) соответствуют численным значениям показателя рН, а также способы для его определения или измерения.
ЧТО такое показатель pH почвы
Кислотность показывает концентрацию ионов водорода, определяющих кислотно-щелочной баланс грунта. Для этого есть показатель pH. Показатель, отражающий кислотно-щелочной баланс почвы, раствора или другой среды. Измеряется в единицах от 0 до 14 (см таблицу):
| Значение показателя pH | Характеристика |
| 0 … 6,9 | среда кислая (преобладают кислоты) |
| 7,0 | среда нейтральная (кислоты и щелочи нейтрализуют друг друга). |
| 7,1 … 14 | среда щелочная (преобладают щелочи). |
| Примечание: а) чем больше pH: тем меньше кислотность почвы; тем больше щелочность почвы. б) чем меньше pH: тем больше кислотность почвы; тем меньше щелочность почвы. |
Показатель pH почвы (его численное значение) чаще всего колеблется в диапазоне 3,5-8,5.
Типы почвогрунтов, в зависимости от показателя pH принято разделять на следующие типы (см. таблицу):
| Значение показателя pH | Тип почвы |
| менее 4 | сильнокислая |
| 4 … 5 | среднекислая |
| 5 … 6 | слабокислая |
| 6 … 7 | нейтральная |
| 7 … 8 | слабощелочная |
| 8 … 8,5 | среднещелочная |
| более 8,5 | сильнощелочная |
Также принято различать два типа кислотности — актуальную кислотность (отражает реальное состояние, сколько сейчас в почве есть ионов водорода) и потенциальную кислотность (потенциально возможное состояние):
- АКТУАЛЬНАЯ определяет присутствие в почве ионов водорода: чем их больше, тем выше кислотность (соответственно, тем меньше значение pH).
- ПОТЕНЦИАЛЬНАЯ определяет присутствие в почве обменно поглощенных ионов водорода и других частиц – марганца, железа, алюминия.
Всем садоводам и огородникам следует ориентироваться ТОЛЬКО на актуальную кислотность, которая измеряется химическими индикаторами, приборами и другими способами. Далее рассмотрим как определить показатель pH почвы.
КАК определить показатель pH почвы (кислотность почвы)
Способов определения множество – это и «народные» (с использованием уксуса или лакмусовой бумаги), и современные (с применением электронных приборов pH-метров/ кислотомеров).
Самые распространенные способы определения кислотности почвы:
- Лакмусовой бумагой;
- Измерительные приборы pH-метры;
- Визуальный способ (по растениям-маркерам);
- С помощью уксуса;
- Заказ исследование почвы в лаборатории.
а) Лакмусовая бумага
Показатель pH почвы определяется по цвету бумаги. Лакмусовая бумага есть в продаже в любом садовом центре.

б) Измерение pH-метром (кислотомером)
Для определения кислотности разработаны и внедрены в производство целый ряд pH-метров (кислотомеров) – специальных портативных приборов, позволяющих определять не только кислотность, но и другие ключевые показатели почвы – влажность, температуру, освещённость и пр.
pH-метр — это прибор для измерения водородного показателя, характеризующего активность ионов водорода в растворах/средах (почва, вода, пищевая продукция и сырье, объекты производственных системах, в том числе в агрессивных средах). Действие pH-метра основано на измерении величины ЭДС электродной системы, которая пропорциональна активности ионов водорода в растворе — pH (водородному показателю).
Для использования в ЛПХ и в сельскохозяйственном производстве выпускается широкий ряд простых в применении электронных или электронно-механических pH-метров. Популярность их из года в год растет. Это самый точный и актуальный на сегодня способ определения кислотности почвы.

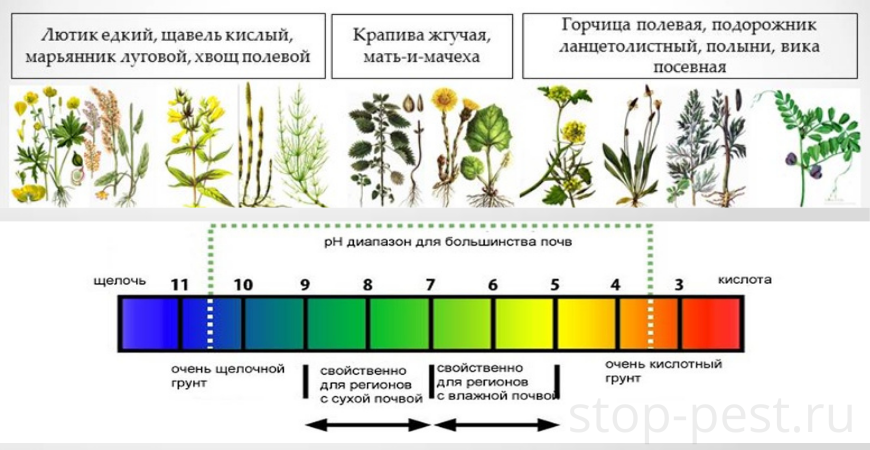
в) Визуальный способ
В данном случае речь идет по определению кислотности почвы по растениям – маркерам. Например, если на участке хорошо растет щавель и хвощ, то почва кислая, а если мак и вьюнок – щелочная.
| Значение pH | Тип почвы | Растения-маркеры |
| менее 4 | сильнокислая | растений нет, на верхнем слое бархатистый зеленый налет |
| 4 … 5 | среднекислая | подорожник, дикий щавель, мята дикая, хвощ, фиалка и др. |
| 5 … 6 | слабокислая | папоротник, ромашка, пырей, одуванчик, сныть обыкновенная, клевер, мать-и-мачеха и др. |
| 6 … 7 | нейтральная | мокрица, лебеда, пастушья сумка, |
| более 7 | щелочная | мак, вьюнок, дрема белая |
г) С помощью уксуса
В плоскую емкость помещается небольшое количество почвогрунта. Затем заливается 6% раствором уксуса. По реакции определяем кислотность почвы:
- реакции нет, то почва кислая;
- реакция слабая (мало пузырьков) — почва слабокислая или близкая к норме;
- реакция бурная — значит, щелочная среда.
д) Заказать исследование почвы в лаборатории
Раскисление почвы
Раскисление почвы – единственный способ поднять ее рН до нужной отметки (т. е. до 5,0 и выше). Раскисление почвы процесс не сложный, но требует определенных знаний. Процесс не быстрый, около полугода. Осень самое благоприятное время, чтобы к весне кислотно-щелочной баланс почвы был на оптимальном уровне.
Для раскисления используют следующие способы/материалы:
Источник
Кислотность как фактор, влияющий на плодородие почвы
Кислотность почвы – важный агрохимический параметр, характеризующий пригодность субстрата для выращивания тех или иных культур. Начинающие огородники часто совершают ошибку – регулируют рН на всем участке, в то время, когда нужно создавать оптимальные условия для каждого растения индивидуально. Рассмотрим связь уровня кислотности с плодородием почвы и урожайностью культур.

Кислотность и показатели рН почвы
Кислотность или ph почвы – биохимический показатель, который характеризует ее способность проявлять (нейтрализовать) свойства кислот. В процессе обмена ионов водорода с почвенными минералами и органическими веществами в плодородном слое образуются кислоты и основания (щелочи). РН указывает на их баланс в почвенном растворе, обозначают его числами от 1 до 14. Чем ниже числовое обозначение pH, тем кислее среда. От чего зависит кислотность почвы?
Определяющий фактор – изначальный материал, из которого сформированы почвы: на песчанике, граните – более кислые, на известняке – щелочные.
Постепенное повышение кислотности происходит в регионах с частыми обильными осадками. Влага, накапливаясь в почве, вымывает минералы и соли из корнеобитаемого слоя.
Причиной выщелачивания может быть интенсивный полив водой с низким показателем рН (кислой).
Подкисление происходит при чрезмерном внесении в землю растительных остатков, органических и минеральных удобрений.
Увеличению кислотности способствует плохая воздухопроницаемость грунта. Если органика разлагается без доступа кислорода, освобождаемые в результате химической реакции органические кислоты и углекислый газ остаются в почве.
Интересно! В РФ примерно треть сельскохозяйственных земель – кислые и требуют регулярного известкования. Это большая часть дерново-подзолистых, дерновых и серых лесных почв средней полосы и Сибири. В Западной Европе таких земель почти 60 %.
Рассмотрим оптимальные показатели кислотности почвы для растений, а ниже в таблице конкретизируем их в разрезе садовых и огородных культур.
Наиболее приемлемый для большинства культурных растений уровень кислотности находится в диапазоне от 5,5 до 7,5 – это слабокислые (5–6), нейтральные (6,5–7) и слабощелочные(7–8) почвы. РН ниже 5 означает средне и сильнокислую реакцию, выше 8 – щелочную. Кислотно-щелочной баланс выше 9 говорит о том, что перед нами солонцово-карбонатные почвы или даже солончаки.
Оптимальный диапазон кислотности для распространенных садово-огородных культур
Источник
Сельское хозяйство | UniversityAgro.ru
Агрономия, земледелие, сельское хозяйство
Популярные статьи
Кислотность почвы
Кислотность почвы — свойство почвы, обусловленное наличием ионов водорода в почвенном растворе и обменных ионов водорода и алюминия в поглощающем комплексе почвы.
Интервал pH 5,5-7 соответствует наиболее агрономически благоприятной структуре почвы, высокому качеству гумуса и оптимальному водному режиму.
Реакция среды почвенного раствора
Реакция среды почвенного раствора — соотношение концентрации Н + и OH — ионов почвенного раствора, выраженное в виде pH водной или солевой вытяжки. Удобрения, как правило, изменяют реакцию почвенного раствора.
Реакция почвы оказывает влияние на питательный режим почв, рост, развитие и урожайность растений, деятельность микроорганизмов почвы, трансформацию форм питательных элементов удобрений и почвы, агрофизические, агрохимические, физико-химические и биологические свойства почв. Удобрения и мелиоранты позволяют регулировать реакцию почв в желаемую для возделываемых культур сторону.
Реакция почвенного раствора определяется концентрацией ионов водорода (Н + ) и гидроксид-иона (OH — ). В чистой воде с нейтральной реакцией, концентрация ионов водорода совпадает с концентрацией гидроксид-иона и равна 1⋅10 7 моль/л. При добавлении 1 ммоль соляной и азотной кислоты к 1 л воды, которые полностью диссоциируют в водном растворе, концентрация ионов водорода составит 1 ммоль Н + , или 1⋅10 3 моль/дм 3 . Концентрацию ионов водорода выражают через показатель pH, равный:
где CH + — концентрация ионов водорода в растворе, моль/дм 3 .
В растворе с нейтральной реакцией концентрация ионов водорода равна 0,0000001 = 1 · 10 -7 моль/дм 3 , или pH = 7.
По реакции среды (рН) почвы деляться на:
Реакция почвенных растворов может колебаться в широких пределах от pH = 3-3,5, характерная для сфагновых торфов и лесных подстилок сфагновых лесов до pH = 10-11 у солонцов.
Для большинства возделываемых сельскохозяйственных культур благоприятны почвы с нейтральной или близкой к нейтральной реакцией, однако значительные площади сельскохозяйственных угодий характеризуются неблагоприятной реакцией.
Источник
Кислотность почвы (рН)
Оглавление
Почвенный поглощающий комплекс
Поверхность частиц глины, ила или органического вещества несет отрицательный заряд и может притягивать к себе положительные ионы (катионы) водорода (H + ), кальция (Ca 2+ ), магния (Mg 2+ ), калия (K + ), натрия (Na + ) и др. Сумма мельчайших коллоидных частиц почвы, определяющих ее способность удерживать питательные вещества (поглотительную способность), называется почвенным поглощающим комплексом (катионной емкостью почвы).
Эти мельчайшие частицы почвы действуют как слабая кислота, оговариваясь, кислую реакцию почвы (низкий уровень рН почвы). Напротив, частицы почвы, содержащие кальций, магний, калий и натрий обусловливают щелочную реакцию (высокий уровень рН почвы). Кальций, магний, калий и натрий вытесняют ионы водорода, снижая кислотность. Поэтому щелочными является не только почвы, где много извести (кальция), но и засоленные почвы, имеют избыток натрия, хотя там и мало кальция.
Если почва кислая, то это вовсе не означает, что нейтральные частицы почвы находятся в растворе слабой кислоты. Кислотность большинства почв обусловлена сосредоточением на поверхности мелких (коллоидных) почвенных частиц (гумуса, глины). Именно на поверхности мельчайших частиц почвы содержатся питательные элементы и от размера суммарной поверхности этих частиц зависят свойства почвы и ее плодородие.
Что такое pH
Определение реакции почвы относится к числу наиболее распространенных анализов. Реакция среды (рН) зависит от содержания ионов водорода (Н + ) и служит показателем кислотности или щелочности почвы. Этот показатель зависит, в основном, от ионного обмена с минеральными и органическими коллоидами и наличия карбонатов кальция, натрия, калия и других катионов. Реакция среды почвы варьируется от 3.5 (сильнокислая) — 7 (нейтральная) — до 11 (сильнощелочной).
С повышением рН возрастает вероятность образования нерастворимых гидроксидов и карбонатов. При снижении до минимума доступности токсичного металла растениям рН должно поддерживаться около 6.5. Кислотность почв обусловлена многими факторами, одним из которых является диссоциация функциональных групп гумуса, а другим — микробиологическое разложение органического вещества. Остальными источниками кислотности почв служат глинисто-силикатные минералы и гидроксида железа и алюминия.
Интенсивность подкисление почв в определенной степени зависит от равновесия между ионами водорода и алюминия. При сильном подкислении почв появляется растворимый алюминий, и снижается жизнедеятельность многих микроорганизмов. Кислотность выражается в терминах pH (десятичная степень) обратной величины концентрации водородных ионов (H + ), в единицах от 0 до 14:
Значение pH 7.0 означает нейтральную реакцию, выше — щелочную, ниже — кислую. Уменьшение pH на каждую единицу означает увеличение кислотности почвы в 10 раз.
Катионный обмен почвы
Непрерывное образование водородных ионов H + происходит при растворении в почвенной воде углекислого газа (CO 2 ), образования угольной кислоты. Углекислый газ выделяется корнями живых растений при дыхании, а также при распаде органических веществ (органических удобрений).
Ионы водорода могут вытеснять в почвенный раствор минеральные катионы, более того, ионы кальция, магния, калия и натрия, находятся в постоянном движении между почвенными частицами, почвенным раствором и корнями растений. Заполнение кальция, магния, калия и натрия происходит за счет распада минеральных почвенных частиц и внесения органических и минеральных удобрений. Высокий уровень катионного обмена характерен для глинистых и органических почв, низкий — для песчаных.
При внесении большого количества одного катиона, другие могут быть вытеснены в почвенный раствор, и вымытые в глубокие слои почвы. Такое может происходить при внесении большого количества несбалансированного минерального удобрения. Особенно это опасно на легких песчаных почвах, где мало мельчайших (коллоидных) частиц, поэтому дозы минеральных удобрений там снижают, разбивая на несколько внесений.
Почему почва подкисляется
В общем, кислые почвы характерны для районов, где количество осадков достаточно высокая. Дождь и снег повышают количество влаги в почве, и концентрация кальция и магния в почвенном растворе снижается. Ионы кальция и магния из частиц почвы переходят в почвенный раствор и, в конечном счете, вымываются из почвы. Их место на частицах почвы занимают ионы водорода H + , почва подкисляется и требуется повторное внесение извести.
Там, где количество осадков превышает 500 мм / год, происходят значительные ежегодные потери кальция из-за вымывания. Примерно такое же количество кальция выносится из почвы с высоким урожаем. Внесение минеральных удобрений, например сернокислого аммония или использования серы тоже может подкислять почву.
Углекислый газ, растворенный в грунтовой воде, является мощным растворителем соединений кальция, переводя, в частности нерастворимый карбонат кальция CaCО 3 в растворимый бикарбонат кальция Ca(HCO 3 ) 2 . При росте активности почвенных микроорганизмов в почву выделяется много углекислого газа, ведет к потерям кальция из-за вымывания его из почвы в виде бикарбоната.
Почему важна кислотность почвы
Чрезмерно высокий (выше 9) или низкий (ниже 4) уровень кислотности почвы токсичен для корней растений. В пределах этих значений pH определяет поведение отдельных питательных веществ, осаждение их или преобразования в недоступные растениям формы. В кислых почвах (pH 4.0-5.5) железо, алюминий и марганец находятся в формах доступных растениям, а их концентрация достигает токсического уровня.
При этом затруднено поступление в растения фосфора, калия, серы, кальция, магния, молибдена. На кислой почве может наблюдаться гибель растений без внешних причин (гибель от мороза, развитие болезней и вредителей). Напротив, в щелочных почвах (pH 7.5-8.5) железо, марганец, фосфор, медь, цинк, бор и большинства микроэлементов становятся менее доступными растениям из-за образования нерастворимых гидроокисей. Оптимальным считается pH = 6.5 (слабокислая реакция почвы) .
Это не ведет к недостатку фосфора и микроэлементов, большинство основных питательных веществ становятся доступными растениям, то есть находятся в почвенном растворе. Такая грунтовая реакция благоприятна для развития полезных почвенных микроорганизмов, обогащают почву азотом. Хотя отдельные виды растений приспособились к существованию в кислой или, наоборот, в щелочной среде, однако большинство растений хорошо развиваются при нейтральной или слабокислой реакции почвы (диапазон pH 6.0-7.0).
Источник
