Химические снег и иней
Снег из пенопласта
Для получения искусственного снега можно воспользоваться многими материалами белого цвета и, в частности, пенопластами: пенополистирол, вспененный полиэтилен и т.д. Как вы знаете, пенопласты — это класс материалов, представляющий собой вспененные (ячеистые) пластические массы.
Мы воспользуемся пенополистиролом, который в больших количествах используется в качестве упаковочного материала. Размельчить пенопласт можно с помощью кухонной терки. Ветви елки слегка смажьте клеем, например, крахмальным клейстером и посыпьте измельченным пенопластом с добавкой блесток. Созданным вами снег будет красиво сверкать на ветках.
Данный способ можно использовать и для оформления отдельных крупных ветвей, которые можно украсить гирляндами, бантами, шарами и др. и поставить в вазы.
Иней из соли
Из курса химии вы знаете, какой раствор называется насыщенным — это раствор, который находится в динамическом равновесии с растворяющимся веществом.
Насыщенный раствор содержит максимальную массу растворенного вещества при данной температуре. Например, при температуре 20 0 С в 100 г воды растворяется 35,86 г хлорида натрия, а при 100 0 С — 39,2 г, т.е. растворимостьповаренной солипри повышении температуры повышается незначительно.
Если полученный насыщенный раствор хлорида натрия осторожно и медленно охладить, то в этом случае получается раствор, содержащий значительно больше растворенного вещества, чем его требуется для насыщения при данной температуре. Такие растворы называются пересыщенными.
Иней можно имитировать с помощью кристаллов поваренной соли. Получится настоящий химический иней, а для домашних и знакомых – волшебное превращение. Соль лучше брать крупного помола, тогда кристаллы будут эффектнее. Итак, начнем. В 1 л кипящей воды растворяем примерно 450 г поваренной соли. В горячий солевой раствор опускаем чистые и обязательно сухие веточки. Оставляем раствор с веточками медленно остывать. Затем аккуратно вынимаем ветки и даем высохнуть. На веточках образуется сверкающий иней. Конечно, этим способом можно создавать иней только на небольших веточках, засушенных травах, зонтиках укропа и т.п., а также и на елочных игрушках.
Покрытые «инеем» ветки прекрасно смотрятся не только отдельно, но и в новогодних композициях.
С Новым годом!
Автор В.Е. Никитин
1. Новошинский И.И., Новошинская Н.С.. Химия: учебник для 10 (11) класса общеобразовательных учреждений. Углубленный уровень / И.И. Новошинский, Н.С. Новошинская. — М.: ООО «Русское слово — учебник», 2014. — 440 с.: ил. — (Инновационная школа).
Источник
Зимний пейзаж на стекле
Деревья Сатур на и Юпитера
«Сатурново дерево» называют иногда «деревом Парацельса» — врача-алхимика, основателя фармацевтической химии. Готовя одно из своих лекарств растворением в уксусной кислоте металлического свинца, он задумал добавить еще и ртуть, а потому внес в сосуд кусочки цинка. В те времена многие химические элементы и даже очень распространенные металлы еще не были по-настоящему идентифицированы и считалось, что цинк содержит много ртути, от этого он такой легкоплавкий.
Не имея времени продолжить опыт, Парацельс оставил сосуд на несколько дней, и как же сильно он был поражен, когда увидел на кусочках цинка блестящие веточки неизвестной природы! Он подумал, что ртуть, затвердев, вышла из цинка. Позже красивое «дерево» получило название «сатурнова» по алхимическому названию свинца.
Чтобы вырастить «сатурново дерево», или «дерево Парацельса», наливают в высокий стакан или стеклянный цилиндр водный раствор 25—30 г ацетата свинца Pb ( CH 3 COO )2 в 100 мл воды и погружают в него очищенную тонкой наждачной бумагой пластину или стержень из цинка. Можно вместо этого подвесить на нитке несколько кусочков цинка, тоже очищенных наждачной бумагой. С течением времени на цинковой поверхности вырастают ветвистые и блестящие, сросшиеся между собой кристаллы свинца.
Их появление вызвано реакцией восстановления свинца из его соли более активным в химическом отношении металлом цинком:
Парацельсу приписывают также получение кристаллов олова на гранулах цинка — «дерева Юпитера». Чтобы вырастить такое «дерево», в высокий стеклянный сосуд наливают водный раствор 30—40 г хлорида олова( II ) SnCl 2 в 100 мл воды и погружают цинковую пластинку. Очень быстро на ней вырастает дерево из черных кристалликов олова.
Серебряное дере вце Дианы
Древнегреческая мифология связывает девственную богиню-охотницу Артемиду с Луной, а Луна в алхимии — символ серебра. Древнеримская богиня Луны носила имя Дианы. В Риме существовало знаменитое святилище Дианы, где утварь и светильники были изготовлены из чистого серебра. Диана считалась покровительницей серебряных дел мастеров. Поэтому алхимики, выделявшие серебро из его солей при помощи ртути, называли его «серебром Дианы».
Попробуйте выделить серебро из водного раствора нитрата серебра при помощи ртути. Это получается при точном, прямо-таки ювелирном соблюдении всех перечисленных ниже условий. В стеклянный стакан с каплей ртути Hg на дне надо налить водный раствор нитрата серебра AgNO 3 (10 г соли в 90 мл воды). Сначала ртуть покрывается серой пленкой амальгамы серебра (сплава ртути с серебром), а через 5—10 секунд на ней начинают очень быстро расти блестящие игольчатые кристаллы серебра. Спустя несколько минут иглы начинают ветвиться, а через час в сосуде вырастает сверкающее серебряное деревце.
Здесь очень важно точно следовать рекомендованной концентрации нитрата серебра: при более низком содержании AgNO 3 роста кристаллов металлического серебра не наблюдается. Так, при содержании в 100 мл воды всего 5 г AgNO 3 через 2 минуты будет наблюдаться рост лишь одиночных кристаллов. А при более высоком содержании AgNO 3 (например, при 20—40 г в 100 мл воды) кристаллизация серебра идет по всей массе раствора без образования ветвистых кристаллов.
Растущие кристаллы, как насос, выкачивают катионы серебра Ag + из окружающего раствора, и идет окислительно-восстановительная реакция:
Кристаллы меди н а графите
В коллекцию химических домашних растений можно включить и своеобразное деревце, ствол которого представляет собой стержень из графита, а ветки — блестящие красные кристаллы меди. Это «растение» выращивают так.
В стеклянный цилиндр наливают отфильтрованный водный раствор, содержащий сульфат меди( II ) и хлорид натрия. Чтобы приготовить такой раствор, вносят в 100 мл воды 15 г медного купороса CuSO 4∙5Н2 O и 15 г поваренной соли. Затем готовят графитовый стержень длиной 6 — 8 см (его можно взять из толстого карандаша или из электрической батарейки) и надевают на него поролоновый кружок толщиной 5 мм и диаметром, почти равным внутреннему диаметру цилиндра. Выше кружка на графитовый стержень наматывают 5 — 6 витков алюминиевой проволоки, которую прижимают к стержню в верхней части узкой полоской липкой ленты. Стержень с кружком и проволокой вставляют в цилиндр так, чтобы поролон касался налитого раствора без воздушной прослойки. Поверх кружка наливают концентрированный водный раствор хлорида натрия. Поролоновый кружок не дает смешиваться двум растворам.
Вскоре на алюминиевой проволоке появляются пузырьки водорода, а вокруг графитового стержня под кружком образуется коричневое облачко, и раствор приобретает коричневую, почти черную окраску. Через несколько часов верхний слой раствора под кружком начинает светлеет, а на стержне появляются кристаллики меди красновато-кирпичного цвета. В конце концов весь графитовый стержень ниже кружка покрывается кристаллами меди, причем самые крупные из них будут располагаться внизу.
Цилиндр является «электролизером», в котором на катоде (графитовом стержне) из образовавшегося ранее анионного комплекса тетрахлорокупрата( II ) натрия Na 2[ CuCl 4] протекает реакция восстановления меди:
[CuCl4] 2- + 2e − = Cu ↓ + 4С l −
Верхняя часть графита служит анодом, на котором алюминий, теряя электроны, переходит в раствор в виде гексааквакатиона:
Цианоферратные кустар ники Ломоносова
Русский физикохимик Михаил Васильевич Ломоносов в 1750 г. занялся разработкой способа получения синей краски, известной в то время как «берлинская лазурь». Химическая формула этого соединения, уточненная уже в наши дни, — KFe [ Fe ( CN )6], гексацианоферрат( III ) железа( II )-калия. Попутно Ломоносов изучал взаимодействие желтой и красной кровяных солей, гексацианоферрата( II ) и гексацианоферрата( III ) с различными солями других металлов.
Изумительные «растения», похожие на нитевидные «водоросли» или ветки «подводного кустарника», вырастают в сосудах при взаимодействии в водном растворе гексацианоферратов калия с хлоридом или сульфатом марганца( II ), цинка ( II ), никеля( II ), кобальта( II ), хрома( III ). Для этого в раствор 30—50 г желтой кровяной соли — гексацианоферрата( II ) калия K 4[ Fe ( CN )6] в 1 л воды добавляют два-три кристаллика этих солей.
Появление водных «растений» связано с реакциями, в которых выпадают в осадок малорастворимые комплексные соли типа K 2 Zn [ Fe ( CN )6] или KCr [ Fe ( CN )6]. Эти соединения покрывают внесенные кристаллики полупроницаемой пленкой. Через пленку просачивается вода из раствора. Давление под пленкой возрастает, в некоторых местах она прорывается, и там начинают расти длинные изогнутые «трубочки» — «ветки» Диковинных растений. Рост будет продолжаться до тех пор, пока не израсходуется весь кристалл внесенной соли.
Синий «кустарник» вырастает, когда в раствор 100—150 г сульфата меди( II ) CuSO 4 в 1 л воды добавить кристаллики красной кровяной соли — гексацианоферрата( III ) калия K 3[ Fe ( CN )6]. Его появление вызвано реакцией образования малорастворимого гексацианоферрата( III ) меди( II )-калия KCu [ Fe < CN )6]:
Зеленые тонкие «водоросли» с синеватым оттенком появляются, если в водный раствор хлорида никеля( II ) NiCl 2 (30—50 г в 1 л воды) опустить кристаллик гексацианоферрата( III ) калия K 3[ Fe ( CN )6]. Они образуются по реакции:
Хроматный ос енний сад
Химический осенний сад с желтой «травой» и золотистыми «листьями» вырастает, если в водный раствор, содержащий 30 — 50 г хромата калия К2СгО4 в 1 л воды, добавить кристаллик дигидрата хлорида бария ВаС12∙2Н2 O . В желтом растворе будет протекать осаждение хромата бария ВаС r О4:
Тонкие нити желтого цвета, похожие на траву, появятся и в водном растворе нитрата свинца(П) Pb ( NOg )2, содержащем 100 — 150 г соли в 1 л воды, если в него опустить несколько кристалликов хромата калия. В этом случае «трава» это малорастворимый хромат свинда Р b Сг O 4:
Золотистые листочки в растворе
Чтобы получить «парящие» в водном растворе сверкающие золотистые листочки, надо в стеклянном сосуде смешать одинаковые объемы 10%-ных растворов нитрата свинца( II ) Pb ( NO 3)2 и иодида калия KI . Тотчас же выпадает желтый осадок иодида свинца( II ) Р bI 2. Ему дают отстояться, сливают с него жидкость и растворяют этот осадок в горячей воде, слегка подкисленной уксусной кислотой. Медленно охлаждая сосуд с раствором, получают в жидкости тончайшие золотистые пластинки кристаллов Р bI 2. «Осенний сад» в стеклянной банке получается по обменной реакции:
а полученный иодид свинца( II ) PbI 2 кристаллизуется из пересыщенного раствора при охлаждении.
Химическ ий аквариум
Если в высокую стеклянную банку налить 1 л жидкого стекла — полисиликата натрия с условной формулой Na 2 SiO 3 и добавить 0,5—0,7 л воды, перемешать, а потом одновременно из двух стаканов вылить в эту банку водные растворы сульфата хрома( III ) Cr 2( SO 4)3 и хлорида железа( III ) FeCl 3, то в банке вырастут силикатные «водоросли» желто-зеленого цвета, которые, причудливо переплетаясь, опускаются сверху вниз.
Рост «водорослей» — результат кристаллизации силикатов железа, меди и хрома, образующихся в результате обменных реакций, уравнения которых условно можно записать следующим образом:
Добавив в ту же банку по каплям раствор сульфата меди( II ) CuSO 4, мы заселим аквариум причудливыми «морскими звездами» и круглыми колючими «морскими ежами» синего цвета:
Оранж ерея Пелиго
Французский агрохимик Эжен Мелыпьор Пелиго в 1851 г. удивил своих коллег интересным опытом. Попробуйте повторить этот опыт.
Большой стеклянный цилиндр тщательно вымойте горячей водой и по стенке налейте в него горячий водный раствор тиосульфата натрия, наполняя цилиндр на 1/3 его высоты. Готовить этот раствор надо, внося в 45 мл горячей воды 450 г пентагидрата тиосульфата натрия Na 2 SO 3 S ∙5Н2О.
Осторожно по стеклянной палочке на этот раствор налейте, не смешивая с ним, горячий раствор ацетата натрия (300 г тригидрата ацетата натрия CH 3 COONa ∙3Н2О на 45 мл воды). Раствор ацетата натрия тоже Должен занять 1/3 высоты цилиндра.
Наконец, в верхнюю часть цилиндра на 1/3 его высоты налейте горячую воду, не перемешивая её с нижними слоями раствора. Затем цилиндр накройте часовым стеклом и дайте ему остыть до комнатной температуры.
После этого сделайте следующее. К концу стеклянной палочки прикрепите воском или парафином кристаллик Na 2 SO 3 S ∙5Н20 и осторожно опустите в самый нижний слой раствора. Тотчас же вокруг кристаллика начнется образование «цветка» из бесцветных кристаллов пентагидрата тиосульфата натрия. К другой стеклянной палочке прикрепите кристаллик ацетата натрия CH 3 COONa ∙3Н2О и опустите во второй слой раствора. Здесь также начнется кристаллизация «цветка» из соли, но кристаллы будут другой формы. Так вы получите в цилиндре «оранжерею» с диковинными «цветами», состоящую из двух слоев блистающих на свету прозрачных кристаллов изумительной красоты.
Фантастическ ие пейзажи на стекле
Чтобы запечатлеть причудливые узоры из мелких цветных кристалликов солей, существует следующий способ. Готовят теплый раствор 2—3 г желатина в 100 мл воды и 10—15%-ные водные растворы окрашенных солей (сульфата меди CuSO 4, дихромата калия К2С r 2О7, хлорида никеля NiCl 2, хлорида кобальта СоС l 2 и т. п.). Эти растворы будут содержать 10—15 г каждой соли в 100 г воды.
Затем раствор желатина смешивают с десятикратным объемом раствора соли и выливают смесь на обезжиренную стеклянную пластинку, чтобы получился слой толщиной 2—3 мм. Пластинку оставляют в горизонтальном положении для испарения воды. Через один − два дня тонкий слой раствора желатина с примесями солей высыхает и на стекле появляются причудливые узоры из цветных кристаллов синего, оранжевого, зеленого, розового цветов.
Коль ца Лизеганга
Немецкий физикохимик Рафаэль Лизеганг в 1867 г. придумал свой способ получения пейзажей на стекле, получивший название «кольца Лизеганга». В центр застывшего на стекле слоя желатина, содержащего 10% дихромата калия К2С r 2 O 7, помещают большую каплю концентрированного водного раствора нитрата серебра(1) AgNO 3 (90 г соли в 100 мл воды). Через несколько дней в слое желатина появляются концентрические кольца красно-бурого цвета. В застывшем слое желатина происходит отложение колец из кристаллического Ag 2 Cr 2 O 7, полученных по обменной реакции:
Вот в чем причина удивительной формы выделения осадка. Водный раствор нитрата серебра проникает в студень постепенно, и на некотором расстоянии от центра капли образуется насыщенный раствор дихромата серебра, из которого выделяются кристаллы этой малорастворимой соли. К месту их роста медленно подтягиваются находящиеся вблизи дихроматные анионы 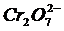
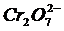
Заро сли из серы
Берут широкий химический стакан емкостью 2 л, в который вставляют до 1/3 высоты две П-образные стеклянные палочки разной высоты перпендикулярно друг другу так, чтобы одна из них проходила под другой и они не доходили до стенок стаканов на 4—5 мм. В стакан наливают раствор сульфата меди( II ) CuSO 4 с содержанием соли 50—100 г в 1 д воды. Жидкость должна наполнять стакан на 4/5 его объема. Стакан накрывают часовыми стеклами и ставят в холодильник для охлаждения.
В большую пробирку, закрепленную в деревянной или металлической держалке, насыпают примерно на 1/3 ее объема кусочки черенковой или комовой серы. Тонко измельченную серу («серный цвет») в этом опыте использовать не рекомендуется, так как при плавлении это вещество сильно вспенивается.
Пробирку осторожно нагревают над пламенем до тех пор, пока вся сера не превратится в желтую легкоподвижную жидкость. Затем усиливают нагревание. Расплав сначала становится густым, а потом, ближе к точке кипения, снова делается жидким. Когда сера закипит, ее выливают в раствор сульфата меди. При выливании расплава делают круговые движения рукой так, чтобы струйки расплава ложились в разные места на скрещенных стеклянных палочках. Иногда в этот момент сера загорается, но на это можно не обращать внимания: ведь ей предстоит встреча с водой. Если пробирка после выливания серы продолжает обгорать, ее надо наполнить водой из запасного стакана.
В результате на стеклянных палочках повисают тонкие, тягучие коричнево-желтые нити пластической серы — полная иллюзия тропических джунглей, перевитых лианами. Через час «лианы» становятся твердыми и на их поверхности появляется желтоватый налет мелких кристалликов серы. Благодаря раствору CuSO 4 нити «лиан» приобретают зеленоватый оттенок, поскольку рассматривать их приходится через голубую жидкость.
Замшел ые камни
На дно широкого стеклянного сосуда с достаточно толстыми стенками осторожно опускают речную гальку. Можно насыпать и бесцветный речной песок слоем толщиной 3—5 см. Затем наливают на половину объема сосуда концентрированный водный раствор сульфата меди( II ) CuSO 4. После этого в раствор добавляют смесь цинковой пыли и гранулированного цинка до исчезновения голубой окраски жидкости.
Частицы цинка покрываются лохматым налетом кирпично-красного цвета, похожим на мох, и оседают на камнях или песке. Это говорит о выделении кристаллов меди в результате окислительно-восстановительной реакции:
Цинк можно заменить алюминием А1, но в этом случае для предотвращения гидролиза сульфата алюминия A 12( SO 4)3, образующегося в реакции:
к раствору сульфата меди заранее добавляют 5—10 мл разбавленной серной кислоты, которая с медью не взаимодействует.
То, что арабский алхимик Джабир аль-Хайян на рубеже I и II тысячелетий называл «превращением железа в медь», на самом деле было процессом, очень похожим на рассмотренные здесь опыты. В растворе медного купороса железные клинки покрывались слоем меди, выделившейся по реакции:
Полная иллюзия превращения одного металла в другой! Жаль только, что алюминий во времена алхимиков еще не был известен.
Целлюло зные водоросли
В 1857 г. швейцарский химик Матиас Швейцер обнаружил, что концентрированный водный раствор комплексного соединения — гидроксида тетраамминмеди( II ) [ Cu ( NH 3)4]( OH )2 растворяет вату и кусочки фильтровальной бумаги. Это было для него первой неожиданностью, а второй оказалось превращение полученного раствора в нитевидные «водоросли», если полученный вязкий раствор влить тонкой струйкой в сосуд с разбавленной серной кислотой. Так Швейцер впервые в истории химии получил нити чистой целлюлозы.
Воспроизведем опыт Швейцера. В химический стакан емкостью 1—2 л нальем на 3/4 его объема разбавленную серную кислоту (54 мл концентрированной H 2 SO 4 на 1 л воды).
После этого приготовим реактив Швейцера. Для этого к 150—200 мл водного раствора сульфата меди (10—15 г соли на 100 мл воды) добавим в небольшом избытке разбавленный раствор гидроксида натрия, Выпавший голубой осадок гидроксида меди С u (ОН)2 отфильтруем, а потом обработаем 15%-ным раствором аммиака. Осадок превратится в растворимый ярко-синий комплекс — гидроксид тетраамминмеди( II ) [ Cu ( NH 3)4]( OH )2:
Теперь приступим к растворению целлюлозы. В химический стакан емкостью 500 мл нальем 100 мл раствора полученного аммиачного комплекса (реактива Швейцера) и туда же поместим небольшой кусок ваты или обрывки фильтровальной бумаги. После перемешивания целлюлоза растворяется и образуется темно-синяя жидкость. Набираем эту жидкость в шприц емкостью 25—50 мл и выпускаем ее в стакан с разбавленной серной кислотой. Образуются тонкие шелковистые нити своеобразных «водорослей». Раствор при этом становится небесно-голубым, как вода горного озера, отражающего чистое небо.
В кислотной среде аммиачный комплекс разрушается по реакции:
В результате выделяется осадок целлюлозы. Волокна медно-аммиачного «шелка», из которого состоят полученные нами «водоросли», в несколько раз тоньше волокон натурального шелка и далее тоньше паутины. Их долгое время использовали для изготовления легких тканей, подмешивали к шерсти, синтетическим волокнам.
Эмалевые пейзажи на металле
Мастера Древнего Египта, Индии, Китая и алхимики средневековой Европы умели готовить разноцветные эмали и с их помощью наносить на металл рисунки — мифологические сюжеты, жанровые сцены и пейзажи. «Рисовать» с помощью эмали — это целое искусство. Но им можно овладеть, если набраться терпения и точно следовать приведенным рецептам.
Один из самых простых способов получения и использования эмали заключается в следующем. Растирают в фарфоровой ступке 5 г тетрабората натрия Na 2 B 4 O 7∙10Н2О (буры), 10 г оксида свинца( II ) Р b О и 2 г оксида кобальта( II ) СоО, пересыпают полученную смесь в фарфоровый тигель, уплотняя ее слой стеклянной палочкой или фарфоровой ложечкой так, чтобы получился конус с вершиной в середине тигля. Уплотненная смесь должна занимать в тигле не более 3/4 его объема. Тигель помещают в муфельную или тигельную печь и нагревают до 800—900 0 С. После прекращения выделения пузырьков газа смесь сплавляется, и легкоплавкая эмаль готова. Горячий тигель с расплавом берут щипцами и сразу же выливают его содержимое на стальной лист с гладкой поверхностью. После охлаждения расплав превращается в «стекло» сине-фиолетового цвета. Это промежуточный этап получения эмали. Чтобы образовалось «стекло» зеленого цвета, вместо оксида кобальта( II ) в исходную смесь вводят 2 г оксида меди( II ) С u О.
Эмалевое «стекло» синего или зеленого цвета надо разбить молотком или фарфоровым пестиком и затем растереть в фарфоровой ступке. Порошок высыпают на лист толстого стекла, добавляют немного воды и растирают до сметанообразного состояния плоским дном фарфоровой ступки. Поверхность выбранной для эмалирования толстой металлической (алюминиевой или медной) пластинки зачищают тонкозернистой наждачной бумагой, обезжиривают (моют в растворе стирального порошка) и высушивают на воздухе. После этого на чистую и сухую поверхность металла шилом наносят контурный рисунок.
Полученные углубления с помощью кисточки заполняют полужидкой массой измельченного эмалевого «стекла» так, чтобы она выступала над поверхностью. Затем пластинку, не наклоняя, берут щипцами и высушивают над пламенем горелки, а после этого нагревают над тем же пламенем до тех пор, пока смесь не наплавится на металл в виде сине-фиолетового или зеленого узора по контуру рисунка. Не меняя горизонтального положения пластинки, ставят ее на металлическую подставку для охлаждения.
При сплавлении смеси, состоящей из тетрабората натрия, оксидов свинца и кобальта (или меди), образуются бораты, имеющие сложный состав.
Зимний п ейзаж на стекле
Приготовьте в химическом стакане при нагревании насыщенный раствор сульфата магния. К этому горячему раствору добавьте несколько капель заранее приготовленного столярного клея. Перемешайте содержимое стакана стеклянной палочкой. Полученную смесь надо нанести на кусок чистого оконного стекла ровным слоем при помощи кисти.
Через некоторое время на стекле появляются кристаллы, образующие «ледяные узоры»: при понижении температуры из пересыщенного раствора соли выпадают кристаллы ветвистой формы.
«Ин ей»
Насыпьте на дно химического стакана слой нафталина высотой 0,5—-1 см и укрепите в нем несколько еловых или березовых веточек. Стакан поставьте на электроплитку, а сверху на него поставьте наполненную водой круглодонную колбу. Через некоторое время после начала нагревания веточки покроются блестящими кристаллами нафталина, похожими на иней. Нафталин летуч и легко возгоняется, а потом кристаллизуется из газовой фазы.
Проводя опыт, нельзя допускать попадания паров нафталина в воздух помещения: они токсичны.
Марсианск ий пейзаж
Химическую «живопись» можно демонстрировать с большим успехом. Главное здесь тщательная предварительная подготовка «пейзажа», который будет возникать на бумаге на глазах у изумленных зрителей.
На листе плотной белой бумаги нарисуйте фантастический пейзаж, который будет включать красно-бурый, синий и белый цвета. Те участки бумаги, где цвет должен стать красно-бурым, пропитывают при помощи кисточки или ватного тампона раствором сульфата меди( II ) CuSO 4. Синие участки обрабатывают раствором хлорида железа( III ) FeCl 3. После того как бумага высохнет, картину обрабатывают из пульверизатора раствором желтой кровяной соли — гексацианоферрата( II ) калия K 4[ Fe ( CN )6], и на белом листе волшебным образом возникает пейзаж.
Появление красно-бурой и синей окраски отвечает уравнениям следующих реакций:
Мет ель в банке
Приготовьте пяти литровую стеклянную банку или аквариум и установите вверх дном на столик с отверстием для электроплитки или спиртовки, на которой будет установлена фарфоровая чашка с бензойной кислотой С6Н5СООН. Поместите под банку также несколько еловых веток или сухих травянистых растений. Вскоре после начала нагревания бензойной кислоты она плавится, а затем возгоняется, и «сад» покрывается белыми хлопьями «снега», создавая «зимний пейзаж».
Проводя опыт, нельзя допускать попадания паров бензойной кислоты в воздух помещения: они токсичны.
Вы добавили к капле ртути, находящейся под водой, водный раствор нитрата серебра и с удивлением обнаружили, что поверхность ртути словно ожила. На ней появились сверкающие ростки, которые начали ветвиться и постепенно превратились в сверкающие деревца.
В сосуде протекала реакция вытеснения серебра Ag из его нитрата AgNO 3 ртутью Hg :
Выделяющееся серебро образует на капле ртути нитевидные кристаллы. Причина протекающей реакции заключается в том, что серебро — менее активный металл, чем ртуть, поэтому ртуть восстанавливает серебро из растворов его солей в виде металла.
Источник


